HLA-B27阳性强直性脊柱炎患者淋巴细胞含量、DKK1和BMP-2因子表达研究
2012-01-03刘华,董青
刘 华,董 青
(江苏省苏州市中医院检验科 215007)
强直性脊柱炎(ankylosing spondylitis,AS)是一种危害骨骼系统与自身免疫相关的慢性疾病,症状表现为关节部位疼痛,行动不便,严重者甚至丧失活动能力,病理实验显示为关节的纤维化和骨性强直,进一步研究表明该疾病与人类白细胞抗原MHC-Ⅰ类分子HLA-B27高度相关,HLA-B27阳性成为AS的诊断指标之一[1]。Dickkopf(DKK1)是一种含有2个富半胱氨酸区域的分泌性糖蛋白,参与抑制Wnt/β-catenin信号[2],通过多种级联反应抑制成骨细胞,激活破骨细胞,破坏成骨与溶骨失衡。骨形成蛋白-2(bone morphogenetic protein,BMP-2)是一种生长因子,在体内、体外均有较强的骨诱导活性,可以使碱性磷酸酶的活性增高、骨桥蛋白、骨钙蛋白及1型胶原蛋白合成增加[3]。本研究通过流式细胞术检测淋巴细胞亚群在B27阳性患者和健康人之间的差别,通过酶联免疫反应检测DKK1和BMP-2在AS患者和健康人中的含量,探讨淋巴细胞亚群的结构与AS患病的关系,并进一步深入研究DKK1和BMP-2与AS疾病之间的关系,为研究AS疾病提供新的参考依据。
1 资料与方法
1.1一般资料 随机抽取30例HLA-B27阴性健康受试者(对照组),60例HLA-B27阳性住院患者(AS组),符合AS诊断标准。所有受试者均于当天抽取外周静脉血2 mL,EDTA-2K抗凝,标本在6 h之内测定。
1.2仪器与试剂 流式细胞仪购自美国BD公司;酶标仪、洗板机购自芬兰雷勃公司;离心机购自德国艾本德公司;隔水式培养箱购自海门市恒昌仪器厂。CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC(Cat NO:340499t)、CD3-FITC/CD16+56-PE/CD45-PerCP/CD19-APC(Cat NO:340500+)购自BD公司;人DKK1和BMP-2酶联免疫吸附测定(ELISA)试剂盒购自上海沪尚生物科技有限公司。
1.3方法
1.3.1流式细胞仪标本处理 选2支试管,分别加入CD3-FITC/CD8-PE/CD45-PerCP/CD4-APC、CD3-FITC/CD16+56-PE/CD45-PerCP/CD19-APC 20 μL,将标本充分混匀,分别加入50 μL标本,振荡器上充分混匀,避光放置15 min;加入溶血素2 mL,充分振荡,避光放置10 min。1 500 r/min离心5 min弃上清液,加入生理盐水2 mL振荡,1 500 r/min离心5 min弃上清液,加入生理盐水100 μL,充分振荡混匀,待测。
1.3.2流式细胞仪器设置及数据分析 采用FACS Comp调整仪器FSC、SSC、FL1、FL2、FL3、FL4的电压及补偿。采用CELL Quest软件获取20 000个淋巴细胞,分析CD3、CD4、CD8、CD19、CD16+56细胞占淋巴细胞的百分比。分别将他们与淋巴细胞绝对数相乘,得到各种表型细胞的绝对值。
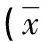
表1 对照组与AS患者的淋巴细胞亚群百分比±s)
1.3.3ELISA分析 按照试剂盒说明操作,标准品的稀释与加样:标准品稀释好5个梯度,每孔加样量均为50 μL;加样:分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL;温育:封板膜封板37 ℃ 温育30 min;洗涤:弃去液体,每孔加满洗涤液,静置 30 s后弃去,重复5次;加酶:每孔加入酶标试剂50 μL;温育:步骤同上;洗涤:步骤同上;显色:每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min;终止:每孔加终止液50 μL,终止反应;测定:450 nm波长依序测量各孔A值。
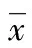
2 结 果
与对照组相比,HLA-B27阳性AS疾病患者总T细胞含量百分比显著下降,差异有统计学意义(P<0.05);CD4+T和CD8+T细胞百分比明显下降,而差异无统计学意义(P>0.05);T4/T8比值有所上升,但差异无统计学意义(P>0.05);B细胞含量百分比显著升高,差异有统计学意义(P<0.05);NK细胞百分比含量略有上升,差异无统计学意义(P>0.05),见表1。ELISA试剂盒标准曲线的绘制,通过标准品的梯度加样测定并绘制标准曲线,DKK1和BMP-2的标准曲线r2分别为0.998 5、0.997 9,HLA-B27阳性中DKK1和BMP-2的表达与对照组相比均显著上升,差异有统计学意义(P<0.05),见表2。

表2 对照组与AS患者的DKK1和
▲:P<0.05,△:P<0.05,与对照组比较。
3 讨 论
AS是与免疫学密切相关的疾病,有流行病学发病因素,也有遗传学易感因素[4]。早在1973年Brewerton等[5]和Schlosstein等[6]就分别证实HLA-B27抗原与AS有强关联性,并且 HLA-B27 阳性个体一生中患AS 的可能性为HLA-B27 阴性者的300倍,这提示HLA-B27基因或者是AS的疾病相关的基因,或者是与致病基因紧密连锁。有越来越多的证据表明,HLA-B27基因或与AS疾病相关,HLA-B27转基因大鼠骨量的变化,发现有疾病倾向的 HLA-B27大鼠骨量减少,该实验表明HLA-B27基因缺陷与疾病中骨量丢失有关[7]。HLA-B27基因多态性影响机体相关的免疫应答反应,本研究通过流式细胞术检测AS患者淋巴细胞亚群的含量百分比,探讨淋巴细胞的变化与疾病的关系,总T细胞百分含量有显著下降,B细胞百分含量显著上升,表明在本检测的患者体内,T细胞和B细胞较对照组异常,可能与AS有关,而T4、T8、T4/T8及NK细胞的百分比含量均有所变化,但差异无统计学意义(P>0.05)。
虽然HLA-B27阳性与AS 有强相关性,但是至今AS的发病机制仍然不清楚,提示AS发病机制的复杂性。AS是危害骨骼系统的疾病,临床主要表现为骶髂关节及中轴关节病变为特征的脊柱关节炎症疾病。DKK1蛋白属于Dickkopf家族,可通过诱导beta-catenin磷酸化及降解来抑制Wnt信号通路,从而阻断早期成骨细胞形成并诱导未成熟成骨细胞的凋亡[8]。DKK1是一种可溶性外泌型的糖蛋白,通过对Wnt信号的作用调节骨质重塑。有研究表明,过度表达DKK1或DKK1缺失表达分别可导致严重骨质丢失及大量骨质形成[9]。另有研究表明,多发性骨髓瘤(multiple myeloma,MM)细胞泌的DKK1通过与基质细胞表面的 LRP5 和(或)LRP6相互作用抑制β-catenin 组装,从而抑制成骨细胞发挥骨质重塑功能[10]。以上证据表明,DKK1与骨质的丢失和形成有关,本实验测得AS患者DKK1表达显著上升,这提示DKK1与AS疾病的发病相关,其具体机制尚待进一步深入研究。
BMP-2作为TGF-β超家族成员,是一种重要的成骨调节因子,有很强的促进成骨细胞分化的功能,并表达特异性的成骨细胞产物[11]。BMP-2可以促进骨髓基质间充质细胞体外增值和诱导其分化为成骨前体细胞[12]。重组人BMP-2(rhBMP-2)可诱导再生软骨和再生骨的形成[13]。本研究检测HLA-B27阳性AS患者中BMP-2的表达与对照组相比显著升高,AS与骨组织的逐步病变密切相关,有学者也提出BMPs类蛋白可能在AS发生过程中其重要作用,BMP-2的表达异常是否与患者骨组织病变有关,值得深入研究[14]。
虽然AS的研究广泛而深入,但尚不能揭示其发病的根本原因,也表明AS发病的复杂性及影响因素的复杂性,有免疫因素、遗传因素以及环境的互作,大多相关试验都在研究这些因素与AS的关系,而AS患者病理实验显示为关节的纤维化和骨性强直,提示调节骨质或者骨细胞生长发育的基因也很有可能直接或间接参与AS的发病,而这些研究比较少见。本研究利用传统的流式细胞术发现,MHC-Ⅰ类分子HLA-B27阳性AS患者T淋巴细胞和B淋巴细胞异常,进一步说明了AS的发病与HLA-B27遗传基因及免疫因素相关。采用ELISA分析发现,调节骨质和骨细胞生长发育的两个因子DKK1和BMP-2表达显著升高,该两种因子可能与AS发病有关,有待进一步探讨,这为深入研究AS发病机制及临床的诊断和治疗提供新的思路和方法。
[1]Díaz-PeoaR,López-VázquezA,López-LarreaC.OldandnewHLAassociationswithankylosingspondylitis[J].TissueAntigens,2012,80(3):205-213.
[2]Mao B,Wu W,Davidson G,et al.Kremen proteins are Dickkopf receptors that regulate Wnt/beta-catenin signaling[J].Nature,2002,417(6889):664-667.
[3]Nakashima K,de Crombrugghe B.Transcriptional mechanisms in osteoblast differentiation and bone formation[J].Trends Genet,2003,19(8):458-466.
[4]黄烽,杨春华.强直性脊柱炎临床及免疫发病机制的研究进展[J].中国免疫学杂志,2001,17(6):281-285.
[5]Brewerton DA,Hart FD,Nicholls A,et al.Ankylosing spondylitis and HL-A 27[J].Lancet,1973,1(7809):904-907.
[6]Schlosstein L,Terasaki PI,Bluestone R,et al.High association of an HL-A antigen,W27,with ankylosing spondylitis[J].N Engl J Med,1973,288(14):704-706.
[7]Rauner M,Stupphann D,Haas M,et al.The HLA-B27 transgenic rat,a model of spondyloarthritis,has decreased bone mineral density and increased RANKL to osteoprotegerin mRNA ratio[J].J Rheumatol,2009,36(1):120-126.
[8]Pinzone JJ,Hall BM,Thudi NK,et al.The role of Dickkopf-1 in bone development,homeostasis,and disease[J].Blood,2009,113(3):517-525.
[9]Mukhopadhyay M,Shtrom S,Rodriguez-Esteban C,et al.Dickkopf1 is required for embryonic head induction and limb morphogenesis in the mouse[J].Dev Cell,2001,1(3):423-434.
[10]Tian E,Zhan F,Walker R,et al.The role of the Wnt-signaling antagonist DKK1 in the development of osteolytic lesions in multiple myeloma[J].N Engl J Med,2003,349(26):2483-2494.
[11]Ebara S,Nakayama K.Mechanism for the action of bone morphogenetic proteins and regulation of their activity[J].Spine(Phila Pa 1976),2002,27(16 Suppl 1):10-15.
[12]Kirker-Head C,Karageorgiou V,Hofmann S,et al.BMP-silk composite matrices heal critically sized femoral defects[J].Bone,2007,41(2):247-255.
[13]Sila-Asna M,Bunyaratvej A,Maeda S,et al.Osteoblast differentiation and bone formation gene expression in strontium-inducing bone marrow mesenchymal stem cell[J].Kobe J Med Sci,2007,53(1/2):25-35.
[14]Carter S,Braem K,Lories RJ.The role of bone morphogenetic proteins in ankylosing spondylitis[J].Ther Adv Musculoskelet Dis,2012,4(4):293-299.
