人胃癌细胞中HSP27高表达与长春新碱耐药的关系
2012-01-03孙雪峰朱易凡杨轶轩
孙雪峰,朱易凡,杨轶轩,何 松△
(1.重庆三峡中心医院消化内科,重庆万州 404000;2.中山大学附属第一医院普通外科,广州510080;3.重庆医科大学附属第二医院消化科 400010)
胃癌细胞的多药耐药(MDR)是胃癌患者化疗失败的主要原因[1-5]。长春新碱耐药型细胞系SGC7901/VCR源自于人类胃癌细胞系SGC7901,通过在体外使用长春新碱逐步筛选而获得,对顺铂、依托泊苷、丝裂霉素C及5-氟尿嘧啶(5-FU)等其他抗肿瘤药物呈交叉耐药,是一个广泛使用的MDR细胞模型。本研究通过对SGC7901/VCR的研究,进一步了解胃癌MDR的分子生物学机制,期待能为胃癌患者提供更有效的治疗手段。
1 材料与方法
1.1细胞系 长春新碱MDR人类胃癌细胞系SGC7901/VCR及其母细胞系SGC7901,由第四军医大学的樊代明院士赠送。
1.2主要试剂及仪器 IPG干胶条、考马斯亮蓝G-250、三Tris Base、SDS、PVDF膜、ECL购自Amersham Biosciences。HSP27、HSP90、ACTIN的单克隆或多克隆抗体购自Santa Cruz Biotechnology,双向电泳系统、图像扫描器、电喷雾-四极杆-飞行时间串联质谱仪(ESI-Q-TOF-MS)购自Micromass公司。
1.3双向凝胶电泳 用裂解液(7 mol/L尿素,2 mol/L硫脲,100 mmol/L DTT,4% CHAPS,40 mmol/L Tris,2%载体两性电解质,1 mg/mL脱氧核糖核酸酶Ⅰ,1 mmol/L Na3VO4和1 mmol/L PMSF),使细胞裂解。将细胞裂解液4 ℃、15 000 r/min离心30 min,收集上清液,测定总蛋白浓度。水化液(含7 mol/L尿素,2 mol/L硫脲,0.2% DTT,0.5%(v/v) pH 3~10的IPG缓冲液,微量溴酚兰)将500 μg蛋白样品稀释至450 μ L,加样至IPG胶条上,然后30 V水化24 h。IEF参数为:500 V聚焦1 h,1 000 V聚焦1 h,8 000 V聚焦8.5 h,总计68 kVh。聚焦后IPG胶条使用平衡溶液(含6 mol/L尿素,2% SDS,30% 甘油,pH 8.8的50 mmol/L Tri-HCL,1%的DTT)平衡15 min,之后用同样的溶液(只是用2.5%碘乙酰胺代替上述溶液中的DTT)再平衡15 min。之后IPGphor,Ettan DALT II系统进行第二向SDS-PAGE电泳。电泳结束后G-250对双向电泳的凝胶进行染色,PDQuest系统加以分析[6]。
1.4ESI-Q-TOF-MS分析[7]剪下不同的蛋白质点迹和蛋白质条带,使用含乙腈的新配制溶液使之脱色,之后真空离心干燥。干燥后的凝胶块用10 μL胰酶溶液(含40 mmol/L NH4HCO3的9%ACN溶液和20 μg/mL蛋白质组级别的胰酶)在37 ℃下孵育10~12 h。使用Millipore Zip Tip C18纯化多肽混合物。将经过纯化的多肽混合物加样LC/MS,DDA模式进行质谱分析。质谱检测的参数:毛细管电压为3 000 V,进样锥电压为45 V,源温度为80 ℃,碰撞气体背压为15 psi。

表1 ESI-Q-TOF-MS鉴定出的差异表达蛋白质有100 mmol/L NH4HCO3的50%
a:Swiss-Prot号;b:↑表示与SGC7901相比,SGC7901/VCR有大于或等于2倍的增加。↓表示与SGC7901相比,SGC7901/VCR有大于或等于2倍的下降。
1.5数据库分析 将MS/MS产生的PKL格式的文件录入Mascot搜索引擎中。搜索参数按如下设置:质量容许误差为±1.0道尔顿;MS/MS容许误差为±0.5道尔顿;可允许有一个没有计数的剪切位点;固定修饰为半胱氨酸;可变修饰选择为氧化;数据格式选择为Micromass PKL格式;工具选择为ESI-Q-TOF。
1.6Western blot检测 使用裂解液(含50 mmol/L Tris,pH 7.4,100 mmol/L NaCl,1 mmol/L MgCl2,2.5 mmol/L Na3VO4,1 mmol/L PMSF,2.5 mmol/L EDTA,0.5% Triton X-100,0.5% NP-40)在4 ℃下将细胞裂解30 min,收取上清液,测定蛋白质浓度。SDS-PAGE电泳后,将蛋白质转移至PVDF膜上。5%脱脂奶粉的TBS缓冲液(20 mmol/L Tris,pH 7.6,100 mmol/L NaCl2,0.5%的Tween-20)阻断过夜。然后在室温下一抗溶液(5%脱脂奶粉的TBS缓冲液以1∶1 500~1∶2 000比例稀释)孵育3 h。二抗溶液(1∶3 000稀释)在室温下孵育1 h。TBS-T 3次洗脱后,ECL系统检测。所有的Western blot检测均重复3次。
1.7将HSP27的反义寡核苷酸链(ASO)导入细胞 所使用的HSP27的ASO对应HSP27的反义起始位置(5′-GGG ACG CGG CGC TCG GTC AT-3′)[8],错义ASO为对照(5′-CAG CGC TGA CAA CAG TTT CAT-3′)。转染前1 d,将SGC7901/VCR细胞接种在6孔板和96孔板中,细胞密度为105个/mL。当细胞呈30%~50%融合时,50 nmol/L HSP27 ASO 或错义ASO转染细胞。HSP27 ASO或错义ASO转染SGC7901/VCR细胞共2 d,转染结束时,用不同浓度的长春新碱或阿霉素孵育细胞24 h。Western blot分析测定HSP27的表达水平,MTT检查SGC7901/VCR的细胞活性。
1.8免疫共沉淀(IP) 4 ℃下将细胞在免疫共沉淀缓冲液中(含20 mmol/L Tris,pH 7.4,100 mmol/L的NaCl,1% NP-40,0.5 mmol/L EDTA,0.5 mmol/L Na3VO4,0.5 mmol/L PMSF)孵育30 min使细胞裂解。收集上清液,进行免疫共沉淀。首先使用非免疫血清对1 500 μg总蛋白进行预清除。接着,将20 μg HSP27抗体与预清除的上清液在4 ℃下共孵育3 h。然后加入100 μL protein-G 琼脂糖珠子,继续孵育1 h。离心30 s后,TBS-T缓冲液洗3次,用0.1 M的氨基乙酸(pH=3)洗脱免疫复合物。SDS-PAGE电泳后考马斯亮兰R-250染色,条带胰酶消化,进行质谱分析。
2 结 果
2.1差异表达蛋白质的鉴定 通过双向电泳,将SGC7901/VCR细胞株及其对应细胞株SGC7901的总蛋白进行差异展示(图1)。与SGC7901相比,SGC7901/VCR中20 kDa大小连续3个点的表达显著性上调(表1)。ESI-Q-TOF-MS分析,并结合数据库检索。3个点均鉴定为热休克蛋白27(HSP27)。图2显示了代表性的MS/MS结果。从y-片段电子系列中的质量差异中,鉴定出m/z值为974.327 0多肽片段的氨基酸序列为GPSWDPFRDWYPHSR,该序列是HSP27序列的一部分。
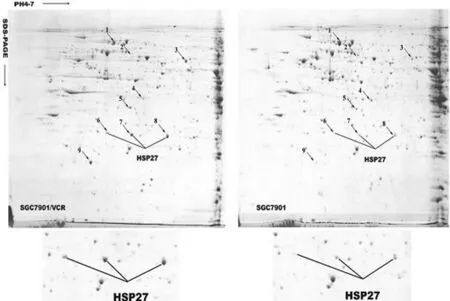
图1 SGC7901长春新碱耐药的SGC7901/VCR细胞系的双向电泳图
2.2HSP27与MDR的关系 Western blot分析显示HSP27 ASO转染后HSP27的表达显著下降,错义ASO转染后,其HSP27表达没有变化(图3A)。在HSP27 ASO转染后,与不同浓度的长春新碱和阿霉素共同孵育24 h,SGC7901/VCR对长春新碱和阿霉素的化疗敏感性增强,细胞活性显著降低(图3B)。
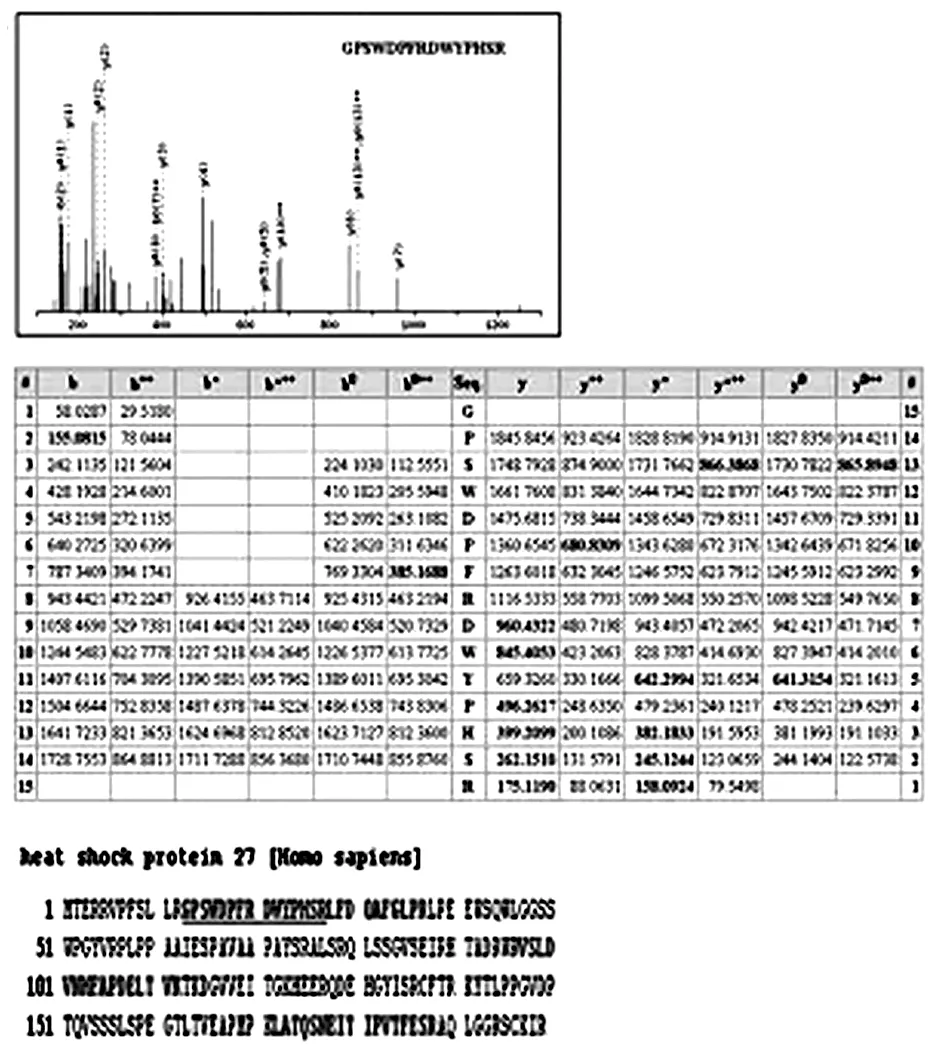
图2 蛋白的ESI-Q-TOF-MS分析结果

A: HSP27 ASO转染SGC7901/VCR细胞显著抑制了HSP27蛋白表达水平;B: HSP27 ASO转染SGC7901/VCR细胞增强了长春新碱和阿霉素的化疗敏感性。试验重复3次。*:P≤0.05。Oligofectamine组仅用转染因子oligofectamine转染细胞。
2.3HSP27相互作用蛋白的鉴定 通过免疫沉淀和质谱分析,在HSP复合物中共鉴定出25种蛋白。根据蛋白质的功能,鉴定出的蛋白质可分为8个功能种类:细胞骨架、分子伴侣、代谢酶、信号传导相关蛋白、核糖体蛋白、DNA修复蛋白、转录翻译蛋白以及RNA加工蛋白,这些功能与HSP27复合物的功能有很好的相关性。
2.4HSP27相互作用蛋白的确认 通过IP和Western blot分析证实β-catenin、HSP90和Actin与HSP27相互作用(图4),在IgY阴性对照中则未检测到。
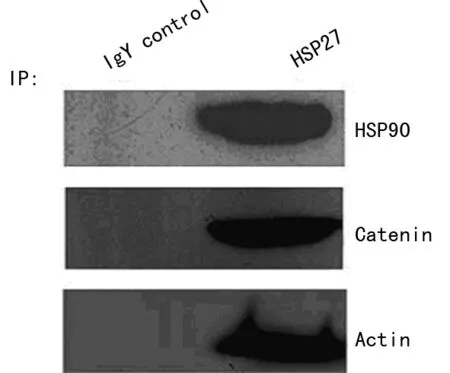
图4 Western blot验证HSP27的相互作用蛋白
3 讨 论
本研究发现,在长春新碱MDR的胃癌细胞系SGC7901/VCR及其母细胞系SGC7901之间,HSP27有显著性的差异表达。当SGC7901/VCR中的HSP27的过表达受到HSP27 ASO的抑制时,细胞对长春新碱和阿霉素的敏感性增加。这明确显示HSP27在SGC7901/VCR的过表达和SGC7901/VCR多药耐受表型相关。
作者进一步鉴定了25种与HSP27相互作用的蛋白,并免疫共沉淀确认了β-catenin、Actin及HSP90与HSP27的相互作用。这提示HSP27与细胞骨架蛋白(如肌动蛋白,肌动蛋白-类蛋白)形成一种复合物,参与肌动蛋白的动力学调节,防止细胞骨架因为多种应激因素而解离[9]。细胞骨架的解离是化疗药物造成细胞损伤早期的和核心的事件。化疗药物造成细胞损伤后,在细胞骨架重组期间,HSP27能与细胞骨架相互作用,而HSP27高表达进一步促进细胞细胞骨架的重组,从而逃避化疗药物杀伤。
本研究发现核糖体蛋白(包括核糖体蛋白P0和核磷蛋白)与HSP27相互作用。核磷蛋白是一种多功能蛋白,在细胞周期中,可穿梭于细胞核与细胞质之间。有学者猜测其穿梭能力与其分子伴侣活性有关[10-12],从而在细胞分化、凋亡的过程中,发挥重要的调节作用。核磷蛋白参与肿瘤的多药耐受表型,很可能是通过抑制细胞凋亡来实现[13]。本研究表明了HSP27与核磷蛋白形成复合物,并导致耐药的直接证据。
另外,与HSP27相互作用的一些蛋白,也参与调节细胞的增殖和分化。在这些蛋白中,β-catenin是经典Wnt信号通路中的关键组成成分[14-15]。β-catenin能与α-catenin及E-cadherin相互作用,激活经典Wnt信号通路,导致干细胞存活及肿瘤产生。
本研究证实在胃癌细胞SGC7901/VCR中,细胞MDR与HSP27的高表达相关,并且提供了HSP27与MDR机制紧密相关的证据。但是,HSP27在肿瘤长春新碱耐药中的作用机制仍有难以理解之处。可能与HSP27还参与细胞信号转导、细胞增殖分化等更为复杂的过程有关。
[1]Gottesman MM,Fojo T,Bates SE.Multidrug resistance in cancer:role of ATP-dependent transporters[J].Nat Rev Cancer,2002,2(1):48-58.
[2]郭剑伟,李杰.胃癌的化疗耐药性研究进展[J].复旦学报:医学版,2002,29(4):323-325.
[3]桂贤,刘会敏.肿瘤多药耐药发生机制的研究进展[J].上海医学,2005,28(2):161-164.
[4]Yeh KH,Chen CL,Shun CT,et al.Relatively low expression of multidrug resistance-1(MDR-1) and its possible clinical implication in gastric cancers[J].J Clin Gastroenterol,1998,26(4):274-278.
[5]Fujii H,Tanigawa N,Muraoka R,et al.Clinical significance of multidrug resistance and P-glycoprotein expression in patients with gastric carcinoma[J].J Surg Oncol,1995,58(1):63-69.
[6]Candiano G,Bruschi M,Musante L.Blue silver:a very sensitive colloidal coomassie G-250 staining for proteome analysis[J].Elec-trophoresis,2004,25(9):1327-1333.
[7]Yang YX,Xiao ZQ,Chen ZC,et al.Proteome analysis of multidrug resistance in vincristine--resistant human gastric cancer cell line SGC7901/VCR[J].Proteomics,2006,6(6):2009-2021.
[8]Rocchi P,Beraldi E,Ettinger S,et al.Increased Hsp27 after androgen ablation facilitates andro-gen-independent progression in prostate cancer via signal trans-ducers and activators of transcription 3-mediated suppression of apoptosis[J].Cancer Res,2005,65(23):11083-11093.
[9]Kampinga HH,Henning RH,van Gelder IC,et al.Beat shock proteins and atrial Wbrillation[J].Cell Stress Chaperones,2007,12(2):97-100.
[10]Wu MH,Chang JH,Chou CC,et al.Involvement of nucleophosmin/B23 in the response of HeLa cells to UV irradiation[J].Int J Cancer,2002,97(3):297-305.
[11]Grisendi S,Mecucci C,Falini B,et al.Nucleophosmin and cancer[J].Nat Rev Cancer,2006,6(7):493-505.
[12]Lim MJ,Wang XW.Nucleophosmin and human cancer[J].Cancer Detect Prey,2006,30(6):481-490.
[13]Li J,Zhang X,Sejas DP,et al.Negative regulation of p53 by nucleophosmin antagonizes stress-induced apoptosis in human normal and malignant hematopoietic cells[J].Leuk Res,2005,29(12):1415-1423.
[14]Tepera SB,McCrea PD,Rosen JM.A beta-catenin survival signal is required for normal lobular development in the mammary gland[J].J Cell,2003,116(6):1137-1149.
[15]Daniels DL,Spink K,Weis WI.Beta-catenin:molecular plasticity and drug design[J].Trends Biochem Sci,2001,26(11):672-678.
