水溶性壳聚糖的热分解动力学研究
2012-01-02刘廷国
刘廷国,李 斌
(1.华中农业大学 食品科技学院,武汉 430070;2.池州学院 化学与食品科学系,安徽 池州 247100)
水溶性壳聚糖的热分解动力学研究
刘廷国1,2,李 斌1*
(1.华中农业大学 食品科技学院,武汉 430070;2.池州学院 化学与食品科学系,安徽 池州 247100)
利用多重扫描速率法研究了商品水溶性壳聚糖(盐酸盐)的热分解反应动力学.主分解过程可以分为两个阶段,首先是高分子盐的分解,其次是高分子链的解聚合,两个阶段的反应活化能E和指前因子lnA 值分别为173.99±2.63,128.97±1.87kJ·mol-1和35.28±0.62,24.69±0.44min-1.利用Achar微分法判定该物质两个阶段的热分解最概然机理函数相同,为f(α)=1-α,该模型属于每个颗粒上只有一个核心的随机成核和随后生长机理.
水溶性壳聚糖;热分解;动力学;多重扫描速率
甲壳素是迄今为止人类发现的唯一大量存在的天然碱性多糖,具有许多独一无二的生物、化学活性[1].广泛应用于医药保健、生物环保、食品工业、纺织印染、农业、畜牧业、日用化工、化学分析等领域[2-3].然而甲壳素不溶于酸、碱和一般有机溶剂,其部分脱乙酰产物壳聚糖也只能溶于某些特殊的稀酸性溶液中.但其在酸溶液中会迅速发生降解,黏度和分子质量迅速降低而影响品质稳定,极大限制了其广泛应用[4].而且这种溶解实际上是在稀酸溶液中,壳聚糖分子链上的氨基(—NH2)发生质子化形成阳离子—NH+3而溶于水中,而不是壳聚糖溶于水中[5].因此,研究壳聚糖盐的性质更有利于为其在工业中的应用积累经验和数据.
已有不少学者关注壳聚糖热解行为,与其它多糖一样其降解主要包括氧化还原自由基解聚、酸、碱或者酶催化水解,但主要是对壳聚糖溶液进行研究,极少有学者关注壳聚糖盐在固体状态下的降解机理.Holme等人将壳聚糖盐酸盐(chitosan hydrochloride,CHC)放置在60~120℃的环境中进行热降解,研究其热解机理,认为热降解与是否有氧存在无关,而与壳聚糖脱乙酰度和pH值有关[6].但该研究主要利用降解产物的表观黏度和特性粘度进行测定,方法繁杂费时.
多重扫描速率法是指用不同升温速率所测得的几条热分析曲线来进行动力学分析的一种方法.它常用到几条热分析曲线上同一转化率α处的数据进行动力学处理,又称为等转化率法(Iso-conversional method).最大的优势是在不引入动力学模型函数的前提下得到比较可靠的活化能值,消除了因反应机理函数的假设不同而可能带来的误差,所以也称之为无模式函数法(Model-free method)[7-8].研究者们已发现用多重扫描速率法所得的结果比用单个扫描速率法所得的结果准确,广泛用于研究无机材料的脱水、分解、降解,配合物的解离,金属材料的相变和非晶材料的晶化,石油和煤的热裂解,以及高聚物的聚合、固化、结晶、降解等领域中[9-10].但目前的研究数据多由热重(TG)曲线获得,用差示扫描量热法(DSC)进行研究的文献较少[11-12].与 TG 相比,一条 DSC曲线可以获得更为丰富的信息,对其深入研究能够节省检测成本.
本研究利用DSC法获得的壳聚糖盐酸盐在不同升温速率下的数据,研究水溶性壳聚糖的热分解机理.期望为其热分解过程提供一个快速的监测手段,进而指导壳聚糖和水溶性壳聚糖的生产和储存.
1 材料与方法
1.1 实验材料与设备
水溶性壳聚糖(食品级,脱乙酰度DDA=86.45%,含氯量=14.85%,过80目筛),购自浙江金壳生物化学有限公司.除特别说明外,所用化学试剂均为分析纯.
红外光谱仪(NEXUS 470FT-IR):美国 Nicolet公司;差示扫描量热仪(204-F1):德国 Netzsch公司.
1.2 热分解动力学
按文献 [13]方法,分别 以 5.0、10.0、15.0、20.0和25.0℃·min-1的升温速率从室温升至600℃,获得样品在不同扫描速率下的DSC曲线.
1.3 热稳定性
称取10mg样品置于敞口坩埚中,按设定方案进行热处理,处理结束后取出置于干燥器中冷却后测定残留物的红外光谱.
2 结果与分析
2.1 热分解动力学
图1为CHC在动态N2气氛中不同升温速率条件下的DSC曲线,CHC反映出与壳聚糖和甲壳素不同的热分解机理.DSC曲线上最先出现的放热峰可能是由于CHC相变时引起的基线漂移,紧接着出现的两个吸热峰则可能是由CHC热分解引起的.其分解过程可能分为两步,第一步是无水铵盐的分解,生成壳聚糖和HCl气体,此分解过程迅速且需吸收大量热量;第二步是经分解生成的壳聚糖进一步裂解,发生断链、产生小分子挥发性产物,该过程可能不及前一步分解迅速,在慢速升温时(5℃·min-1)几乎被掩盖.
2.1.1 动力学数据处理 Friedman法和Ozawa-Flynn-Wall法是多重扫描速率法中的经典方法,常被其他学者用来检验由假设反应机理函数的方法求出的活化能值.根据文献方法将DSC曲线数据分别转化为转化率α对温度的关系曲线[14].对于 Ozawa 法(lnβ=ln[AE/RG(α)]-5.3305-1.0516E/RT),在多个升温速率β下选择相同的数个α,以各个α时的lnβ对1/T进行线性回归,由斜率得到不同转化率α条件下的活化能E值.而对于Friedman法(ln[(dα/dT)β]=lnAf(α)-E/RT),当转化率α一定时,lnAf(α)是常数,以ln[β(dα/dT)]对1/T作图可得直线,由斜率可计算得到E 值[13-14].
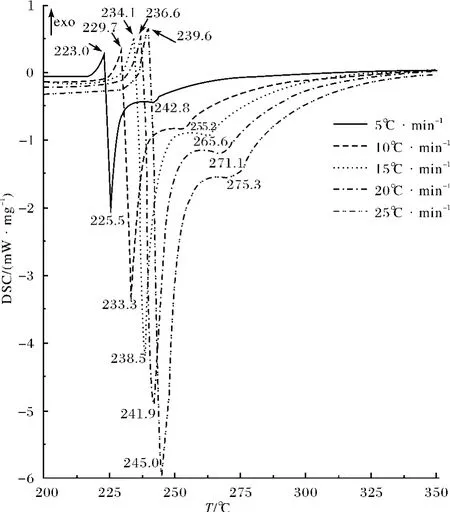
图1 CHC在动态N2中不同升温速率下的DSC曲线Fig.1 DSC curves of CHC in dynamic nitrogen at different heating rates
利用微分法(Achar法)将文献报道的21种常见固体非等温非均相反应动力学机理函数分别代入 Achar方程(ln[(dα/dT)β]-ln[f(α)]=lnAE/RT),经迭代和最小二乘法拟合后由斜率求出E值,由截距求出lnA值,通过与Friedman法和Ozawa法所得结果进行比对进而获得样品的热分解机理函数[13-14].
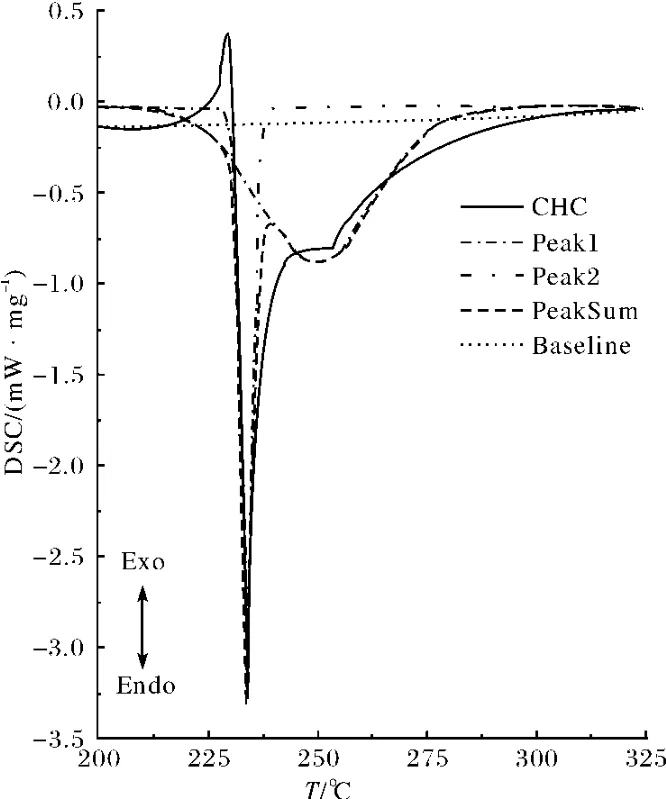
图2 CHC(10℃·min-1)DSC曲线的Gauss拟合结果Fig.2 Peak fitting of CHC using Gauss function with a 10℃·min-1 heating rate
2.1.2 热分解反应活化能 用Friedman法和Ozawa法分别计算CHC在不同转化率下的反应活化能,或许是CHC的多级反应的复杂性,计算活化能时线性拟合曲线的相关系数只有0.76~0.97,而且活化能强烈依赖于转化率,不适宜直接计算活化能.对主分解阶段的DSC数据采用逐步迭代法,用Gauss函数进行分峰处理,拟合结果如图2所示,与原图重叠较好,峰分离效果比较满意.
将两个分离峰的数据分别计算和用最小二乘法拟合后转化为转化率与温度的关系图.分别用Friedman法和Ozawa法计算E值,列于表1中.不同转化率下的曲线拟合结果都比较好,线性相关系数均在0.990 0以上,说明进行峰分离将热分解过程分为两步是合理的.由于计算过程中采用数据逐点计算法,不可避免地产生累积误差,因而取两种方法所得结果的平均数作为热分解的活化能,进而推测反应机理函数.则CHC在两个不同分解阶段的活化能分别为172.26±7.86和128.81±8.84kJ·mol-1.
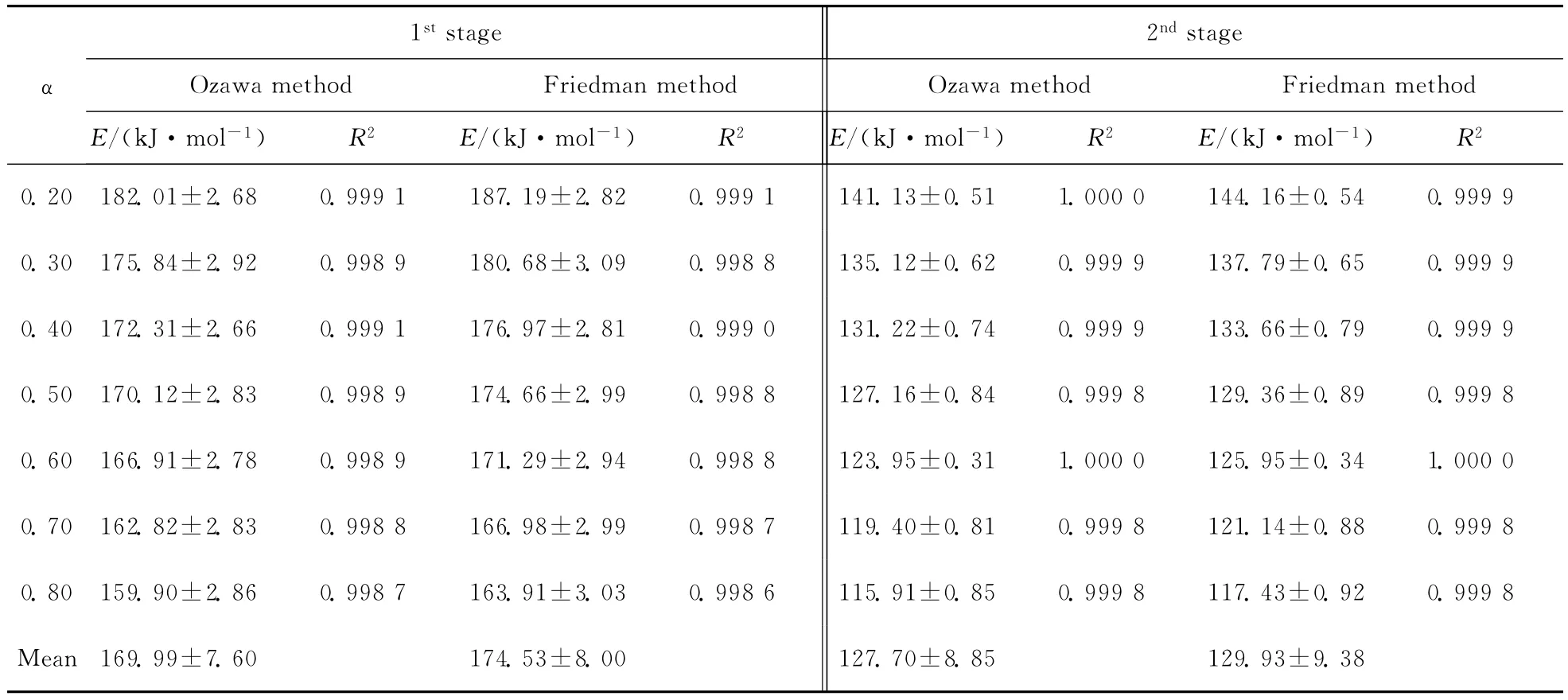
表1 用不同方法计算的CHC不同热分解阶段活化能Tab.1 Activation energies calculated via different methods during the decomposition of CHC on different stages
图3描述了不同分解阶段的活化能与转化率的关系(Ozawa法),每一步反应的活化能都强烈依赖于转化率.随反应的进行,活化能呈线性递减,可见每步分解反应可能都不是单一的反应,而是由一系列动力学参数接近的平行反应控制的复杂反应.而且阶段二的活化能明显低于阶段一,说明第一步反应相对较困难,但一旦引发,即可迅速进行,并可诱发第二阶段反应的进行.
2.1.3 反应机理函数 将21种常见固体反应动力学机理函数f(α)以及各个样品的DSC基础数据分别带入 Achar方程,首先计算出ln[(dα/dT)β]-ln[f(α)]和1000/T,然后以ln[(dα/dT)β]-ln[f(α)]对1000/T 分别作图,经迭代和最小二乘法进行多元线性回归拟合,得到不同动力学模型函数的E,lnA及相关系数R2,结果列于表2中.与Friedman法和Ozawa法计算出的E值比较,选取E值较为接近且相关系数较好、自身偏差较小的一组,即为该反应的热分解机理函数.CHC在两个阶段的分解机理函数相同,均为 No.7(f(α)=1-α),该模型属于每个颗粒上只有一个核心的随机成核和随后生长机理[14],但尚难与真实的微观反应过程建立直接联系,仍有待进行深入研究.
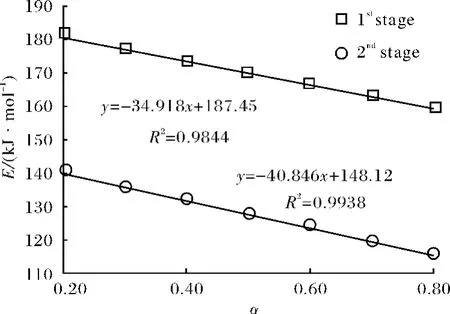
图3 CHC不同热分解阶段转化率α与反应活化能E之间的关系Fig.3 Relationship of E vsαfor pyrolysis of CHC on different stages
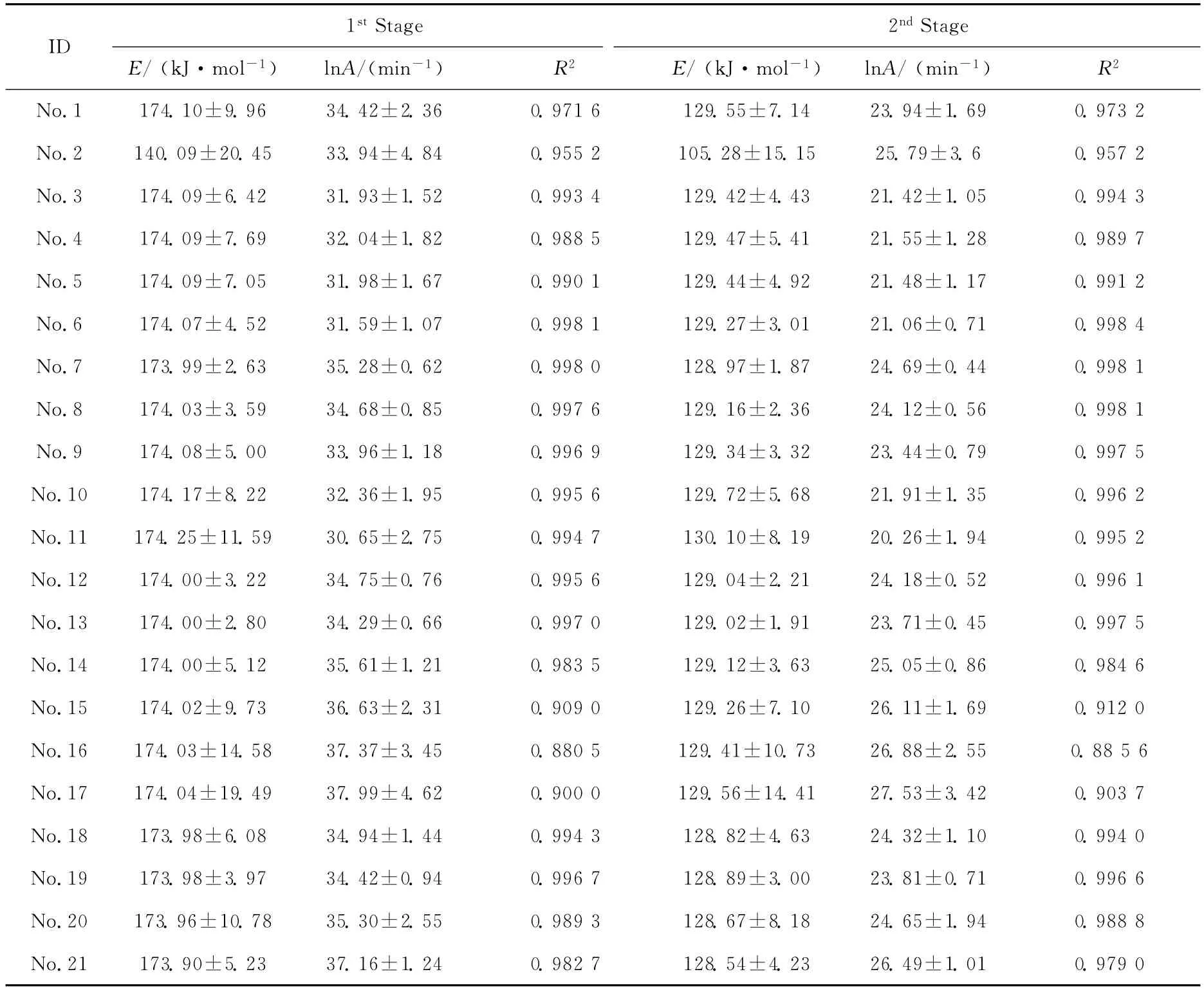
表2 CHC不同热分解阶段的反应动力学参数的微分法计算结果Tab.2 Fitted kinetic parameters of CHC resulting from differential method on different pyrolysis stage
2.1.4 动力学补偿效应 在应用Arrhenius方程讨论一定温度T下活化能E对反应速率常数k的影响时,习惯上的叙述是活化能愈大的反应,其反应速率常数愈小,反之亦然.显然这种叙述是以指前因子A值基本不变为前提.但是在均相或多相的系列相关反应中(如有机高聚物的热分解反应等)常会发现随着E值增大,A值亦增大;E值减小,A值也随之减小,即活化能与指前因子这两个对反应速率起着相反影响的动力学参数之间存在着相互补偿的关系.这种关系称之为动力学补偿效应(Kinetic Compensation Effect,KCF)或等动力学效应(Isokinetic Effect),它是热分析动力学研究的另一项重要内容.其数学表达式为:lnA=aE+b(式中,a和b为补偿参数,a的单位为mol·kJ-1)[15-16].该式表明,A 对E 变化的效应得到部分补偿.用判定的机理函数计算不同转化率时的lnA和E值,并用最小二乘法拟合得到CHC在不同分解阶段的动力学补偿效应方程分别为lnA=0.1271E+15.245(R2=0.9916,1st)和lnA=0.1809E+2.4856(R2=0.9985,2nd).
2.2 热稳定性
将CHC在N2保护下,以10℃·min-1升温至不同温度后测残留物的IR光谱,如图4所示.加热到190℃残渣的红外图谱与原始样品的红外图谱没有显著差异,说明加热到190℃并未引起CHC分子链发生降解.继续加热到225℃,-OH在3 417cm-1的吸收峰明显减弱,而890cm-1附近糖环吸收并未减弱,说明1 624和1 088cm-1处吸收峰的微小变化是由于多糖水化物在高温条件下失水引起的.加热到235℃,从IR图谱上可以看到变化非常显著,除了1 624和1 518cm-1酰胺吸收带变化不显著外,其他吸收峰均明显下降,说明在225~235℃这个比较窄的温度范围内CHC完成了大部分降解过程,说明盐具有催化降解的作用.从235℃开始在1 700cm-1附近出现了微弱吸收,与壳聚糖样品的相似,说明从此温度段开始,CHC的分解过程开始与壳聚糖相似,主要是高分子链的解聚合,类似的结果出现在200℃恒温30min(图5)和190℃恒温60min及更长时间(图6)的IR图谱上.加热到265℃已基本看不到C—O—C和糖环的振动吸收峰,说明CHC的主链降解基本完成.从235℃开始,790cm-1处出现了强的归属于长碳链的CH平面摇摆振动的吸收峰,即使加热到325℃,仍能观测到微弱的酰胺吸收峰,说明高分子主链解聚,但并未完全降解.
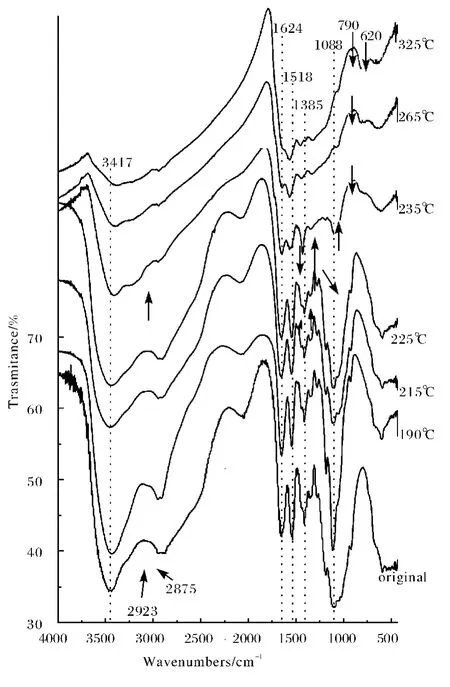
图4 CHC在不同温度热处理后的FT-IR图谱Fig.4 FT-IR spectra of CHC after heat-treatment at different temperature
将CHC在N2保护下以10℃·min-1升温至设定温度保温30min(15min),残渣的IR图谱见图5,在200℃下恒温处理30min即可达到加热至235℃的效果,壳聚糖已经完成盐的分解,主要开始糖主链的解聚,210℃恒温30min主链几乎解聚完全,此后继续处理变化不大.
N2保护下190℃恒温处理0~90min的IR光谱见图6.在该温度下即使恒温90min,也不能使CHC主链完全分解,说明CHC具有一定热稳定性,特别是高分子盐的分解需要一定的温度.这与热分析动力学计算的CHC第一阶段的反应活化能高于壳聚糖,其值为172.26±7.86kJ·mol-1相吻合.
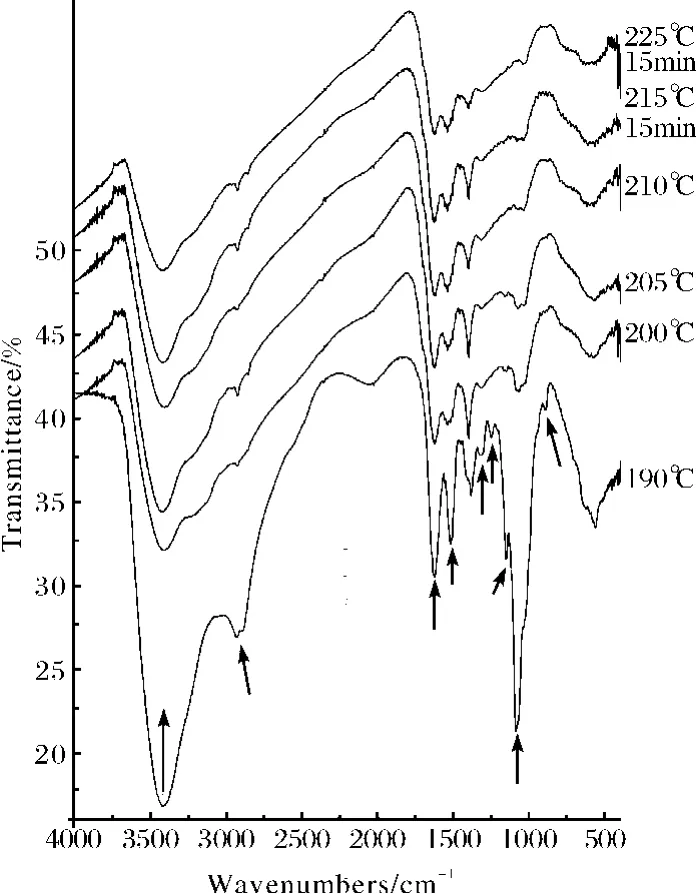
图5 CHC在不同温度热处理30min后的FT-IR图谱Fig.5 FT-IR spectra of CHC after 30min heat-treatment at different temperature
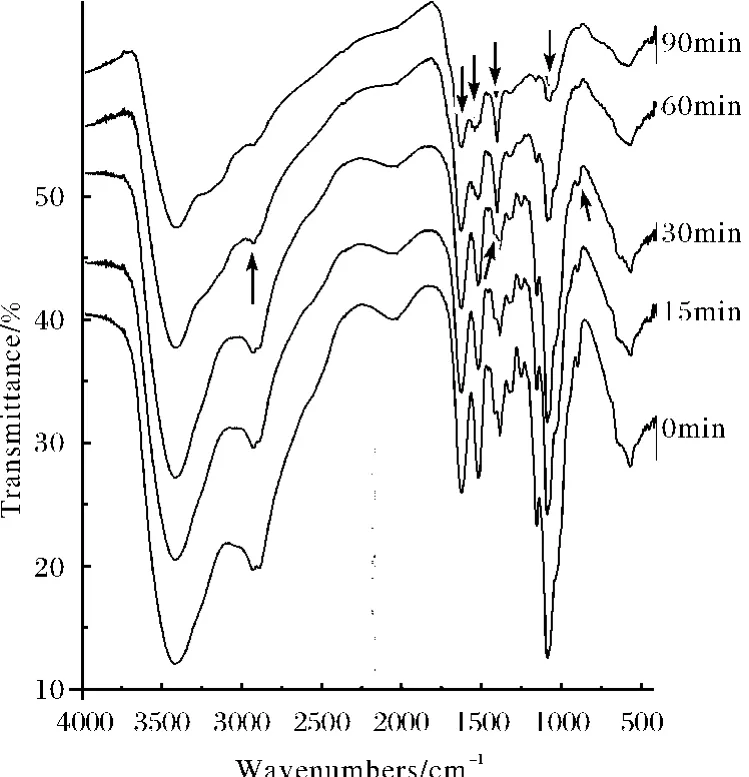
图6 CHC在190℃恒温处理不同时间的FT-IR图谱Fig.6 FT-IR spectra of CHC with isothermal treatment at 190℃for different time
3 结论
利用多重扫描速率法研究了商品水溶性壳聚糖(盐酸盐)的热分解反应动力学,主分解阶段可以分为两个阶段,第一个阶段为高分子盐的分解,第二阶段为高分子链的解聚合,两个阶段的反应活化能E和指前因子lnA值分别为173.99±2.63,128.97±1.87kJ·mol-1和35.28±0.62,24.69±0.44min-1.热处理样品残渣红外光谱分析结果显示,样品热分解过程最先发生的是高分子盐的分解,其次是糖苷键的断裂.
[1]刘廷国,陈 艳,李 斌,等.冻融循环对甲壳素凝聚态结构和脱乙酰反应的影响[J].农业机械学报,2009,40(10):140-145.
[2]Baxter S,Zivanovic S,Weiss J.Molecular weight and degree of acetylation of high-intensity ultrasonicated chitosan[J].Food Hydrocolloids,2005,19(5):821-830.
[3]No H K,Park N Y,Lee S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].Int J Food Microbiol,2002,74(1-2):65-72.
[4]杨凌霄,李素芬,刘廷国,等.水溶性壳聚糖的制备及其应用初探[J].食品与发酵工业,2010,36(10):89-93.
[5]王爱勤.甲壳素化学[M].北京:科学出版社,2008:114-117.
[6]Holme H K,Foros H,Pettersen H,et al.Thermal depolymerization of chitosan chloride[J].Carbohyd Poly,2001,46(3):287-294.
[7]孙秋香,张克立,李 鹏,等.水杨酸锌热分解动力学研究[J].华中师范大学学报:自然科学版,2008,42(2):247-251.
[8]沈玉芳,陈栋华,袁誉洪.一种新的热分析动力学处理方法[J].华中师范大学学报:自然科学版,2003,37(1):75-79.
[9]张 堃,林少琨,林木良.热分析动力学多元非线性拟合法简介及其应用[J].现代科学仪器,2002(5):15-18.
[10]任 宁,张建军.热分析动力学数据处理方法的研究进展[J].化学进展,2006,18(4):410-416.
[11]张国春,焦宝娟,周春生,等.C8H3O6NNa2·H2O脱水过程的热分析动力学[J].西北大学学报:自然科学版,2011,41(3):448-454.
[12]冯金玲,张建国,李志敏,等.高氮含能配合物[Co(AZT)2(H2O)4](HTNR)24H2O的合成、晶体结构及性质[J].化学学报,2010,68(24):2493-2499.
[13]刘廷国,李 斌,张近祥,等.壳聚糖和甲壳素热分解动力学研究[J].食品与发酵工业,2010,36(7):32-36.
[14]胡荣祖,高胜利,赵凤起,等.热分析动力学(第二版)[M].北京:科学出版社,2008.
[15]汪海东,李延团,陈 勇,等.Cu(Ⅱ)草酰胺衍生物热分解动力学研究[J].四川大学学报:自然科学版,2002,39(4):733-737.
[16]刘乃安,汪秉宏,范维澄,等.生物质热解的动力学补偿效应[J].火灾科学,2002,11(2):63-69.
Kinetic studies on the pyrolysis of a water-soluble chitosan
LIU Tingguo1,2,LI Bin1
(1.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070;2.Department of Chemistry and Food Science,Chizhou University,Chizhou,Anhui 247100)
Multiple scan rate nonisothermal DSC curves were employed to investigate the pyrolysis kinetics of a commercial water-soluble chitosan(chitosan hydrochloride,CHC).The pyrolysis process can be separate into two stages,the frist stage is the decomposition of the polymer salt and the second stage is the depolymerization of the polymer chain.The apparent activation energy(E)and frequency factor(lnA)for thermal decomposition were 173.99±2.63,128.97±1.87kJ·mol-1and 35.28±0.62,24.69±0.44min-1,respectively.And the most probable mechanism function was obtained by Achar's differential method.And the functions were same for two stages,the equation expressed as f(α)=1-α,which conformed to a random nucleation and subsequent growth mechanism with only one core of each particle.
water-soluble chitosan;pyrolysis;kinetic;multiple scan rates
TS254.9;O636.9
A
1000-1190(2012)01-0065-06
2011-07-13.
国家“863”资助项目(2007AA10Z310);安徽高等学校省级自然科学研究项目(KJ2011B110);池州学院化学材料与工程省级示范实验中心建设项目(皖教高〔2008〕4号);池州学院材料学院级重点学科建设项目(2011XK04).
*通讯联系人.E-mail:libinfood@mail.hzau.edu.cn.
