黑莓品种‘Boysen’果实水提物和色素对DPPH·的反应动力学特性及清除能力研究
2011-12-31赵慧芳吴文龙李维林
赵慧芳,方 亮,吴文龙,李维林
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
近年来,抗氧化剂广泛用于食品、化妆品行业,需求量逐年增加,开发安全、高效的天然抗氧化剂成为现代工业的一项重大课题。黑莓(Rubus spp.)原产北美,果实柔嫩多汁、酸甜爽口、风味独特、色泽艳丽、营养丰富,富含色素等多酚类物质,具有较强的抗癌、抗衰老、抗氧化和清除自由基的作用[1-3],其鲜果和加工品深受欧美消费者的青睐。
植物提取成分的体外抗氧化活性测定方法有很多,其中,近年来发展起来的1,1-二苯基-2-苦基肼自由基(DPPH·)分光光度法简便、灵敏、稳定,在国内外已广泛应用[4-7]。利用该法进行测定时,大部分学者采用固定反应时间的方式进行测定[8-10]。笔者在研究中发现,在固定反应时间内(如30或 40 min),无论是对照品2,6-二叔丁基对甲酚(BHT)还是供试样品(黑莓果实水提物),与DPPH·的反应并未达到终点;很多研究结果也表明,不同抗氧化剂清除DPPH·的速率是有差异的。因此,在定量测定合成或天然抗氧化剂对DPPH·的清除能力时,首先要进行反应动力学研究以确定其达到稳定态时所需的反应时间。
作者以VC和BHT为对照,通过DPPH·分光光度法研究了黑莓品种‘Boysen’果实水提物及色素与DPPH·的反应动力学特性,并依据反应动力学结果比较二者对DPPH·清除能力的差异,以期为黑莓鲜果及其制品抗氧化性能的研究及深度开发提供实验基础。
1 材料和方法
1.1 材料
供试的黑莓品种‘Boysen’果实于2009年采自江苏省·中国科学院植物研究所黑莓品种园,于-38℃速冻后于-18℃保存、备用。
DPPH·标准品(纯度大于99%)由美国Sigma公司生产,VC和BHT均为分析纯。所用仪器有:TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司)、KQ-100DE数控超声清洗仪(昆山市超声仪器有限公司)和PL-5-B型低速离心机(上海安亭科学仪器厂)等。
1.2 方法
1.2.1 DPPH·标准曲线的绘制 精确称取DPPH·标准品4.5 mg,用无水乙醇配制浓度为115μmol·L-1的DPPH·标准品母液。分别吸取2.0 mL标准品母液,用无水乙醇稀释至浓度分别为115、76、57、46、38和32μmol·L-1,于517 nm处测定吸光度。以浓度x为横坐标、吸光度y为纵坐标绘制标准曲线。回归方程为y=0.010 5x+0.013 2,R2=0.997 1(极显著相关),说明在32~115μmol·L-1浓度范围内DPPH ·与吸光度具有较好的线性关系。
1.2.2 黑莓果实水提物和色素的制备 速冻果经解冻、打浆,以质量体积比1∶9的比例将果浆和纯净水混合,于40℃超声(功率60W)提取40 min后,4 000 r·min-1离心10 min,上清液即为果实水提物,配制成质量浓度分别为10.00、12.50、16.67、25.00、50.00和100.00 g·L-1的溶液备用。
参照文献[11]的方法制得果实色素粉末,经pH示差法[12]测得总花色苷含量为(18.50±0.85)%。精确称取黑莓色素制品0.050 0 g,分别用体积分数50%乙醇溶解并定容至250 mL,逐步稀释为质量浓度0.03、0.06、0.11、0.13、0.16和0.21 g·L-1的溶液备用。
1.2.3 反应动力学研究 用无水乙醇配制质量浓度0.51、0.81、1.01、1.35、2.02和4.04 g·L-1的BHT溶液及0.05、0.09、0.10、0.12、0.13和0.26 g·L-1的VC溶液。取不同质量浓度的BHT、VC、水提物和色素溶液各200μL,分别加入2.80 mL DPPH·标准品母液,采用动力学监测法,以无水乙醇为空白,于517 nm处测定不同反应时间溶液的吸光度(Ai),其中,0~5 min隔30 s测定1次,5~10min隔60 s测定1次,10~30 min隔5 min测定1次,30 min之后隔10 min测定1次,待吸光度基本不变(前后2次差值小于0.01%)时视为样品与自由基反应完全,所有动力学实验均在10℃条件下进行。另外,按同法分别测定200μL无水乙醇加2.80 mL DPPH·母液在517 nm下的吸光度(AC)和200μL供试溶液加2.80mL无水乙醇在517 nm下的吸光度(Aj)。按照公式计算自由基清除率[7]:清除率=〔1-(Ai-Aj)/AC〕×100%。
反应速率常数(k)的确定:根据反应动力学原理,一级反应符合方程v=-dc/dt=kc和ln(c)=-kc〔其中,v为反应速率;c为DPPH·浓度(μmol·L-1);t为反应时间〕,即以ln(c)对t作图,直线的斜率即为-k,反应速率常数k值越大说明反应速率越快[13-14]。根据反应速率常数确定反应到达终点所需的时间。
1.2.4 清除自由基能力的计算 根据不同质量浓度供试溶液清除DPPH·的曲线,计算得出DPPH·初始浓度减少至50%时所对应的供试品质量浓度即为半数有效浓度(EC50)[15]。根据EC50及此时对应清除DPPH·的量,计算总抗氧化能力值(TCA)[16],即在半数有效浓度下1 mL供试溶液清除DPPH·的量。
根据EC50及在此浓度下反应达到终点所需的时间,求得供试样品的清除自由基能力(AE)[5,17],AE值越大,表明供试品清除自由基的能力越强。
1.3 数据处理
采用Excel 2003分析软件进行数据的统计、计算和分析,并绘制BHT、VC、果实水提物和色素清除DPPH·的动力学曲线及清除率曲线。
2 结果和分析
2.1 与DPPH·的反应动力学特性比较
2.1.1 BHT和VC对DPPH·的反应动力学特性 不同质量浓度BHT和VC对DPPH·的反应动力学曲线见图1。0.51~4.04 g·L-1BHT与DPPH·的反应在120 min时基本达到稳定,而0.05~0.26 g·L-1VC与DPPH·的反应均在1 min内瞬间完成,连续测定10 min,各质量浓度VC对DPPH·的清除率均维持不变,说明在1 min时反应均已结束。

图1 不同质量浓度BHT和VC对DPPH·的反应动力学曲线Fig.1 Reaction kinetic curves of different concentrations of BHT and VC to DPPH·
根据不同质量浓度BHT和VC的反应动力学曲线,分别将DPPH·的浓度进行对数换算。以ln(c)对t作图,根据斜率计算反应速率常数k,结果见表1。由表1可见,在120 min反应时间内,0.51~4.04 g· L-1BHT对DPPH·的反应分为2个阶段:第1个阶段为0~30 min,反应速率较快;第2个阶段为30~120 min,反应速率较慢。在第1个反应阶段中,4.04 g·L-1BHT与DPPH·的反应速率常数k1为0.028 5μmol·L-1·min-1;随着 BHT质量浓度的降低,k1逐渐降低,当BHT质量浓度达到0.51 g·L-1时,k1仅为0.004 1μmol·L-1·min-1。在第2个反应阶段中,随BHT质量浓度的降低,反应速率常数k2整体上也呈逐渐降低的趋势,但k2明显低于k1。由于实验条件的限制,动力学反应只持续进行了120 min,第2个反应阶段的k2为0.002 3~0.008 1μmol·L-1·min-1,均大于0.001μmol·L-1·min-1,据此推测该反应可能还存在反应速率常数更低的第3反应阶段,这与Bondet等[18]报道的“BHT对DPPH·的反应属于慢反应过程”是一致的。
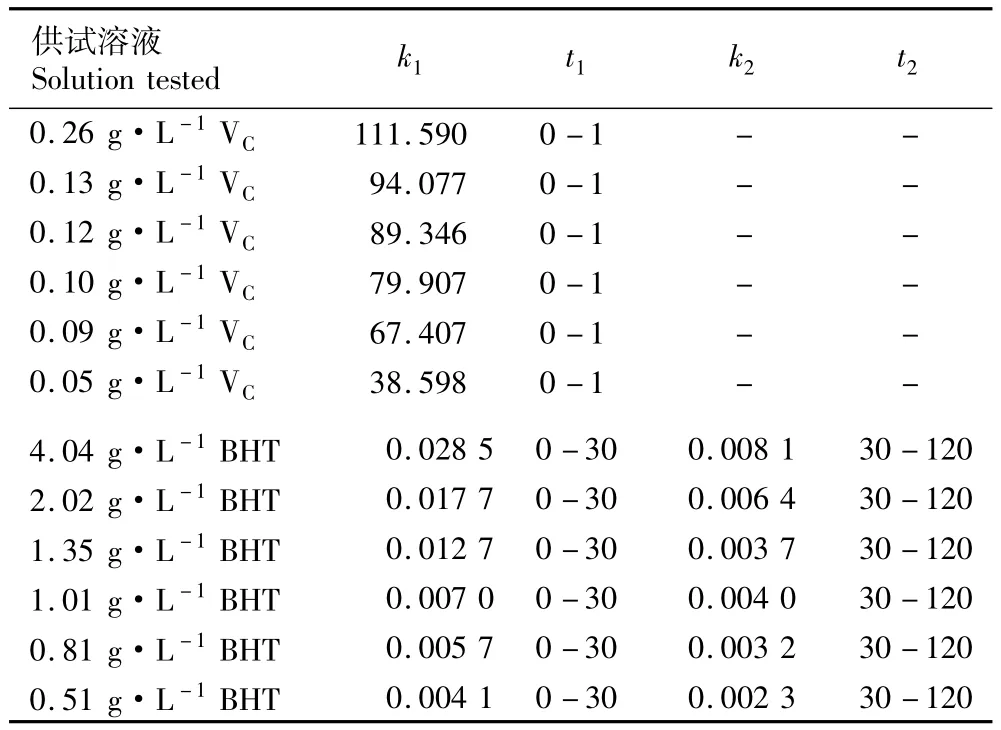
表1 不同质量浓度VC和BHT对DPPH·的反应动力学特征1)Table 1 Reaction kinetic property of different concentrations of VC and BHT to DPPH·1)
0.05~0.26 g·L-1VC对DPPH·反应的反应速率常数在0~1 min内均较大,0.05 g·L-1VC对DPPH·的反应速率常数k1为38.598μmol·L-1·min-1,随着VC质量浓度的提高k1逐渐增大,0.26 g·L-1VC对DPPH·的k1最高,达111.590μmol·L-1·min-1,表明VC对DPPH·的清除反应为瞬时反应。
2.1.2 黑莓果实水提物和色素对DPPH·的反应动力学特性 黑莓品种‘Boysen’果实的不同质量浓度水提物和色素对DPPH·的反应动力学曲线见图2。10.00~100.00 g·L-1水提物和0.03~0.21 g·L-1色素对DPPH·的反应均在100 min时趋于稳定。
根据水提物和色素与DPPH·的反应动力学曲线,可将10.00~100.00 g·L-1水 提 物 或0.03~0.21 g·L-1色素与DPPH·的整个反应均分为3个阶段,各反应阶段的反应速率常数见表2。
100.00 g·L-1水提物与DPPH·的反应于28 min趋于稳定,整个反应可分为0~4、4~10和10~28 min 3个反应阶段;10.00~50.00 g·L-1水提物与DPPH·的反应均在100 min时趋于稳定,整个反应均可分为0~4、4~30和30~100 min 3个反应阶段。同一质量浓度水提物的反应速率常数由大到小依次为k1、k2、k3,即第1个反应阶段反应速率最快,第2个反应阶段次之,第3个反应阶段最慢。3个反应阶段的反应速率常数均随水提物质量浓度的提高而增大,其中100.00 g·L-1水提物的反应速率常数最大。100.00 g·L-1水提物在第1、第2和第3反应阶段对应的k1、k2和k3均最大,分别为0.327 9、0.152 4和0.042 8μmol·L-1·min-1;在28~100min内反应速率常数仅为0.000 7μmol·L-1·min-1,小于0.001 μmol·L-1·min-1,说明28 min时反应已结束。与BHT和VC相比,黑莓果实水提物与DPPH·反应的反应时间较BHT短,但比VC长;反应速率常数也较BHT大,而比VC小。
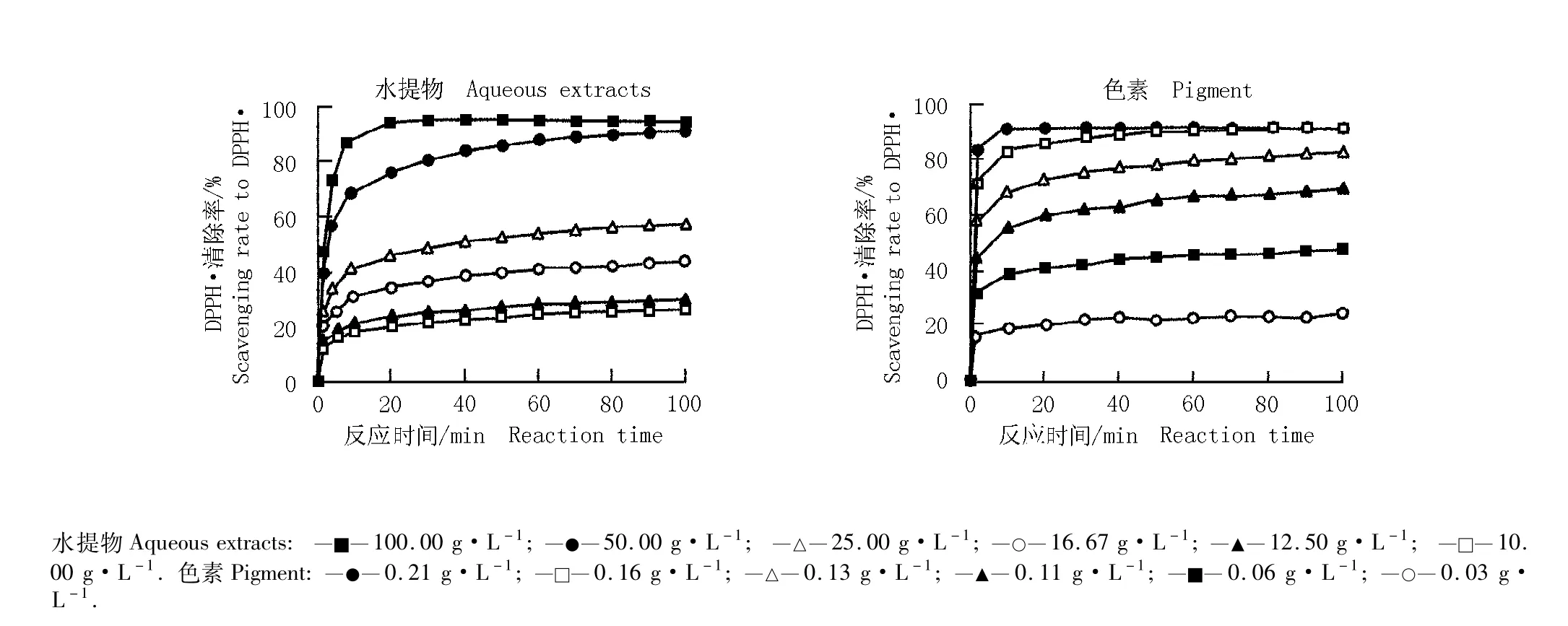
图2 黑莓品种‘Boysen’果实的不同质量浓度水提物和色素对DPPH·的反应动力学曲线Fig.2 Reaction kinetic curves of different concentrations of aqueous extracts and pigment from blackberry (Rubus spp.)cultivar‘Boysen’fruit to DPPH·
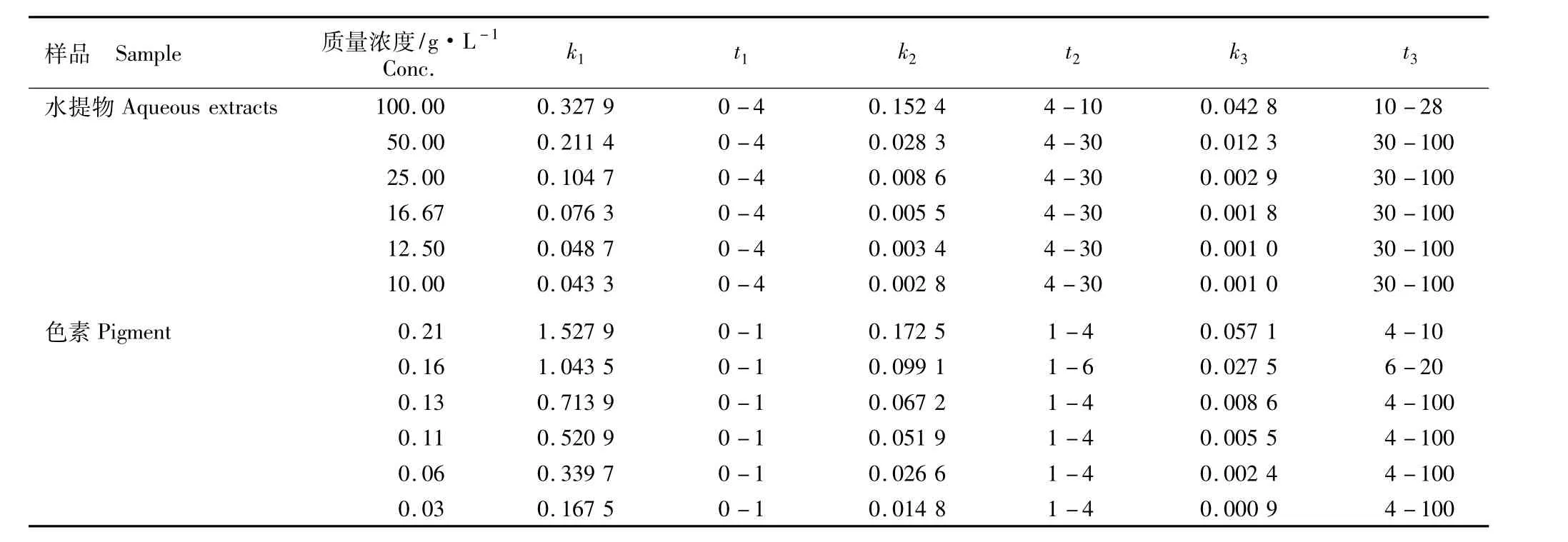
表2 黑莓品种‘Boysen’果实的不同质量浓度水提物和色素对DPPH·的反应动力学特征1)Table 2 Reaction kinetic property of different concentrations of aqueous extracts and pigment from blackberry(Rubus spp.)cultivar‘Boysen’fruit to DPPH·1)
由表2可见,0.21 g·L-1色素与DPPH·的反应在10 min时趋于稳定,整个反应可分为0~1、1~4和4~10 min 3个阶段;0.16 g·L-1色素与DPPH·的反应在20 min时趋于稳定,整个反应可分为0~1、1~6和6~20 min 3个反应阶段;0.03~0.13 g·L-1色素与DPPH·的反应均在100 min时趋于稳定,整个反应均可分为0~1、1~4和4~100 min 3个阶段。随色素质量浓度的提高,第1、第2和第3反应阶段的反应速率常数逐渐增大;随反应时间的延长,不同质量浓度色素在第1、第2和第3反应阶段的反应速率常数则逐渐减小,0.21 g·L-1色素在第1、第2和第3反应阶段的k1、k2和k3均最大,分别为1.527 9、0.172 5和0.057 1μmol·L-1·min-1。在第1、第2和第3反应阶段,不同质量浓度黑莓色素的反应速率常数的变化趋势与黑莓果实水提物相同。
从反应速率常数和反应时间上可以看出,黑莓色素与DPPH·的反应速率较黑莓果实水提物和BHT高,但低于VC;色素与DPPH·的反应速率为水提物的4~7倍,质量浓度较高的色素与DPPH·的反应在10~20 min时即达到终点,而水提物最少需要28 min,这可能与黑莓果实水提物成分较为复杂有关。
2.2 对DPPH·清除作用的比较
2.2.1 BHT和VC对DPPH·的清除作用 根据反应动力学研究结果,以反应120 min时0.51~4.04 g·L-1BHT和反应1 min时0.05~0.26 g·L-1VC对DPPH·的清除率为最终清除率,分别绘制不同质量浓度BHT和VC对DPPH·的清除率曲线,结果见图3。在0.00~1.35 g·L-1质量浓度范围内,DPPH·清除率(y)和BHT质量浓度(x)的线性关系良好,回归方程为y=40.999x,R2=0.958 4,呈极显著相关。根据回归方程求得BHT的EC50为1.22 g·L-1,在此浓度下,TCA为47.5μmol,AE为6.83×10-3。
在0.00~0.13 g·L-1质量浓度范围内,DPPH·清除率(y)和VC质量浓度(x)有较好的线性关系,回归方程为y=643.99x,R2=0.999 5,呈极显著相关。根据回归方程求得VC的EC50为7.76×10-2g·L-1,在此浓度下,TCA为724μmol,AE为12.9。
2.2.2 黑莓果实水提物和色素对DPPH·的清除作用
以反应100 min时10.00~100.00 g·L-1果实水提物和0.03~0.21 g·L-1色素对DPPH·的清除率为最终清除率,分别绘制不同质量浓度水提物和色素对DPPH·的清除率曲线,结果见图4。水提物质量浓度在0.00~25.00 g·L-1范围内,DPPH·清除率(y)和果实水提物的质量浓度(x)线性关系良好,回归方程为y=2.497 2x,R2=0.983 4,呈极显著相关。根据回归方程求得水提物的EC50为20.0 g·L-1,TCA为2.89μmol,AE为4.99×10-4,其中,水提物的EC50高于VC和BHT,而其TCA和AE均较VC和BHT低。
在0.00~0.12 g·L-1范围内,DPPH·清除率(y)和黑莓果实色素质量浓度(x)的线性关系良好,回归方程为y=698.19x,R2=0.986 8,呈极显著相关。根据回归方程求得色素的EC50为7.16×10-2g·L-1,远低于黑莓果实水提物和BHT,与VC接近;TCA为809μmol,分别是VC、BHT和水提物的1.1、17.0和279.9倍;AE为1.40×10-1,低于VC,仅为VC的1.1%,但高于BHT和水提物,分别是BHT和水提物的20.5和280.6倍。
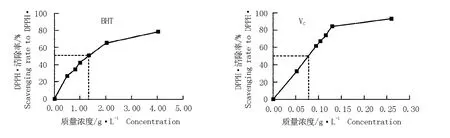
图3 不同质量浓度BHT和VC对DPPH·的清除率曲线Fig.3 Curves of scavenging rate of different concentrations of BHT and VC to DPPH·
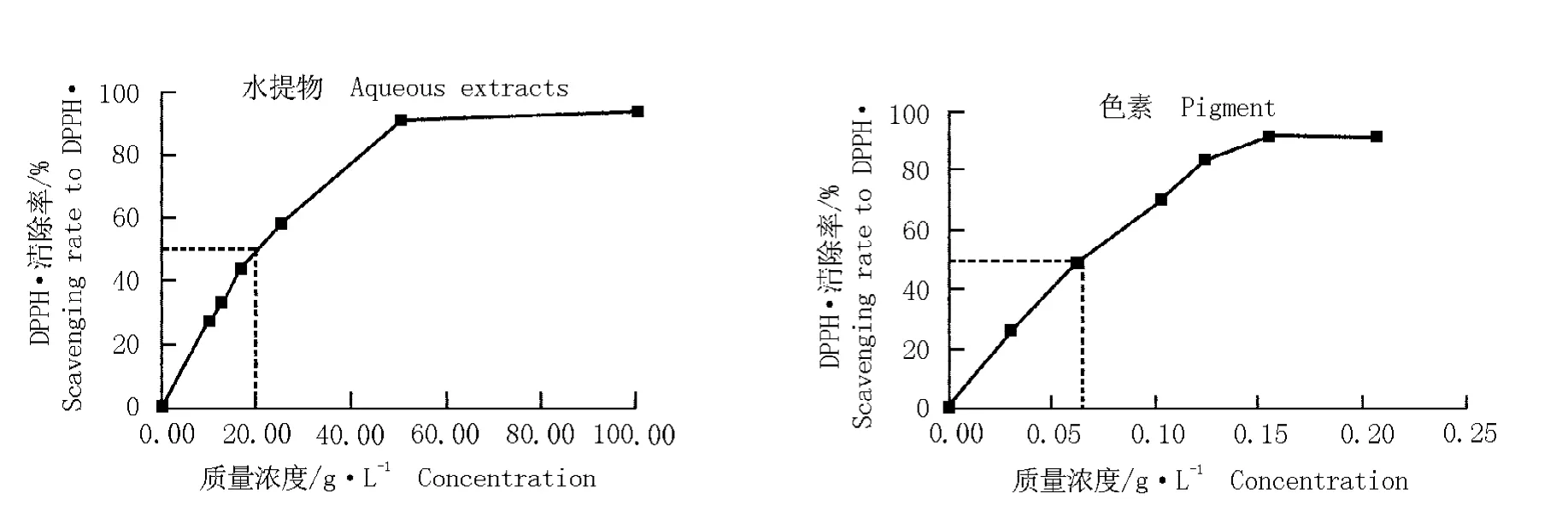
图4 黑莓品种‘Boysen’果实的不同质量浓度水提物和色素对DPPH·的清除率曲线Fig.4 Curves of scavenging rate of different concentrations of aqueous extracts and pigment from blackberry (Rubus spp.)cultivar‘Boysen’fruit to DPPH·
3 讨论和结论
植物体内的抗氧化体系通常是一个复合体系,不同物种间或者同一物种不同提取物的抗氧化组分间均存在差异[19]。因此,以DPPH·清除率来表征植物的抗氧化力时应充分考虑其反应的动力学特点。本实验结果表明,不同的抗氧化物对DPPH·的清除速率和反应达到平衡所需的时间存在很大差异。VC在瞬间完成反应,反应速率常数(k)为38.598~111.590 μmol·L-1·min-1;而BHT与DPPH·的反应则为慢反应,在0~30 min的反应时间内,0.51~4.04 g· L-1BHT的k值为0.004 1~0.028 5μmol·L-1· min-1;水提物和色素对DPPH·的清除速率介于VC和BHT之间,在0~4min反应时间内10~100 g·L-1水提物的k值为0.043 3~0.327 9μmol·L-1·min-1,在0~1 min反应时间内0.03~0.21 g·L-1色素的k值为0.167 5~1.527 9μmol·L-1·min-1;k值由大到小依次为VC、色素、水提物、BHT。唐勇等[16]的研究结果表明,在抗氧化剂和DPPH·反应的后期,DPPH·浓度的缓慢下降是由于自然衰减引起的。笔者在进行反应动力学研究时对空白溶液的吸光度随时间的变化也进行了测定,未发现DPPH·的自然衰减现象,因此可以排除这一因素的影响。
一般情况下,在k小于0.001时,即可判定反应接近终点。根据该原理可以确定VC、BHT、黑莓果实水提物和色素与DPPH·反应到达终点时所需要的时间,VC仅为1 min,BHT超过120 min,水提物为28~100 min,色素为10~100 min。不同浓度的VC、BHT、水提物和色素对DPPH·的清除速率也有所差异,浓度越高反应速率越大,达到反应终点所需的时间越短。
以VC和BHT为对照,比较黑莓果实水提物和色素的抗氧化能力,结果表明,水提物的清除自由基能力较VC和BHT低,但与DPPH·的反应速率明显大于BHT,反应时间也较BHT短;色素的EC50较VC低,其TCA是VC的1.1倍,但由于色素和DPPH·反应达到终点的时间较VC长,因此色素的清除自由基能力较VC低,但明显高于BHT,是BHT的20.5倍。
综上所述,黑莓果实具有一定的清除自由基活性,清除效果与其浓度存在明显的量效关系。过量的自由基是人体多种疾病(如肿瘤、炎症、衰老和血液病)的元凶[20],因此黑莓果实不仅可以作为一种保健食疗的水果,以黑莓果实为原料提取的色素清除自由基的活性也远高于人工合成的抗氧化剂BHT,可以同VC媲美,具有进一步开发利用的价值。
[1]Tate P,God J,Bibb R,etal.Inhibition ofmetalloproteinase activity by fruit extracts[J].Cancer Letters,2004,212(2):153-158.
[2]Seeram N P,Momin R A,Nair M G,et al.Cyclooxygenase inhibitory and antioxidant cyanidin glycosides in cherries and berries[J].Phytomedicine,2001,8(5):362-369.
[3]Boateng J,Verghese M,Shackelford L,et al.Selected fruits reduce azoxymethane(AOM)-induced aberrant crypt foci(ACF)in Fisher 344 male rats[J].Food and Chemical Toxicology,2007,45(5): 725-732.
[4]Dall’Acqua S,Cervellati R,Loi M C,et al.Evaluation of in vitro antioxidant properties of some traditional Sardinian medicinal plants: investigation of the high antioxidant capacity of Rubusulmifolius[J].Food Chemistry,2008,106(2):745-749.
[5]Bortolomeazzi R,Verardo G,Liessi A,et al.Formation of dehydrodiisoeugenol and dehydrodieugenol from the reaction of isoeugenol and eugenol with DPPH radical and their role in the radical scavenging activity[J].Food Chemistry,2010,118(2):256-265.
[6]申海进,郭巧生,房海灵.野菊花60%乙醇提取物的酚类成分组成及其清除自由基和防霉变能力分析[J].植物资源与环境学报,2010,19(1):20-25.
[7]Romano C S,Abadi K,Repetto V,etal.Synergistic antioxidantand antibacterial activity of rosemary plus butylated derivatives[J].Food Chemistry,2009,115(2):456-461.
[8]曲欢欢,李白雪,燕 菲,等.用清除有机自由基DPPH法评价连翘不同部位抗氧化作用[J].中国中医药信息杂志,2008,15 (增刊):32-34.
[9]徐金瑞,张名位,刘兴华,等.黑大豆种皮花色苷的提取及其抗氧化作用研究[J].农业工程学报,2005,21(8):161-164.
[10]连喜军,王 亮,王 吰,等.DPPH法研究不同品种甘薯抗性淀粉抗氧化性[J].粮食与油脂,2009(6):26-28.
[11]赵慧芳,李维林,王小敏,等.黑莓果实色素纯化及干燥工艺研究[J].食品科学,2009,30(12):35-39.
[12]Elisia I,Hu C,Popovich D G,et al.Antioxidant assessmentof an anthocyanin-enriched blackberry extract[J].Food Chemistry,2007,101(3):1052-1058.
[13]Brand-WilliamsW,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel-Wissenschaft und-Technologie,1995,28(1):25-30.
[14]程 霜,崔庆新,陈 玮.毛樱桃籽脂溶性抗氧化成分及其体外抗自由基活性[J].食品科学,2006,27(5):83-87.
[15]Xu J,Chen SB,Hu Q H.Antioxidant activity of brown pigment and extracts from black sesame seed(Sesamum indicum L.)[J].Food Chemistry,2005,91(1):79-83.
[16]唐 勇,赵 靖,徐 静,等.植物总抗氧化能力的微孔板定量测定及评价[J].第三军医大学学报,2008,30(6):517-520.
[17]Sánchez-Moreno C,Larrauti JA,Saura-Calixto F.A procedure to measure the antiradical efficiency of polyphenos[J].Journal of the Science of Food and Agriculture,1998,76(2):270-276.
[18]Bondet V,Brand-WilliamsW,Berset C.Kinetics and mechanisms of antioxidant activity using the DPPH· free radical method[J].Lebensmittel-Wissenschaft und-Technologie,1997,30(6):609-615.
[19]张丽华,童华荣.抗氧化能力测定方法的研究进展[J].中国食品添加剂,2004(3):108-113.
[20]Nair S,Li W,Kong A N.Natural dietary anti-cancer chemopreventive compounds: redox-mediated differential signaling mechanisms in cytoprotection of normal cells versus cytotoxicity in tumor cell[J].Acta Pharmacologica Sinica,2007,28(4):459-472.
