基于改良RAPD标记的花梅与果梅品种的遗传关系分析
2011-12-31王玉娟房经贵于华平汪诗珊李晓颖陈翔高
王玉娟,房经贵,①,于华平,汪诗珊,李晓颖,陈翔高
梅 (PrunusmumeSieb.et Zucc.)为蔷薇科(Rosaceae)李属 (PrunusL.)植物,系中国主产的传统名花佳果。梅在中国已有 7 000年以上的应用历史,栽培历史也有 3 000年以上[1-3]。根据主要用途的不同,可将梅分为果梅与花梅 (梅花)2种类型[3-4]。果梅雌蕊发育充实,多能正常受精结实,产量较高,花瓣以单瓣为主;花梅的大部分品种雌蕊发育较差,花粉量少,花芽萌发率低,一般不能大量结实或果实品质较差,但仍有部分花梅品种能正常受精结实。例如,现今很多的江梅品种仍保留着结果的习性,成为既有观花价值又有食用价值的花果兼用梅。
相关资料表明[5]:花梅是从果梅或野梅演化而来的,而且,花梅的实生选种以及杂交育种也是以果梅为材料。在植物分类系统中花梅与果梅都属于同一类群,并没有进行进一步区分。L i等[6]和 Hayashi等[7]曾分别利用 SNP和 SSR分子标记技术对花梅和果梅进行研究,并都得出这 2类梅在遗传上是同一种植物的结论。它们的区别主要是花器官的形态差异与利用目的的不同,花梅与果梅是栽培过程中依据不同的园艺性状得出的分类结果。经过长期的自然选择和人工选育栽培,花梅与果梅形成了品种繁多、表型性状丰富、遗传进化关系复杂的重要植物类群。
尽管在实际利用与研究中有花梅与果梅之分,但是由于长期自然进化、天然杂交、实生选种以及杂交育种等原因,现存的梅种质资源和人工栽培品种的遗传背景较为复杂。例如:花梅实生选种来自天然杂交的果核,杂交育种需要果梅亲本;很多花梅品种具备不同能力的结果习性;有些果梅品种具有很高的观赏性,这些现象的存在使得有关花梅与果梅遗传关系的研究成为梅研究的重要内容。关于梅品种资源的遗传基础研究已有不少[8-12],但尚未见利用不同 DNA分子标记技术同时对花梅和果梅不同品种资源的遗传关系进行分析的研究报道。
20世纪 90年代后期发展起来的随机扩增多态性 DNA(random am p lified po lymorphic DNA,RAPD)技术是由 W illiam s等[13]和 W elsh等[14]建立的基于PCR技术的一种分子标记技术。RAPD分子标记技术检测的多态性位点是无限的,且不需要预知基因组序列,所用引物为随机引物,扩增条带的多态性受引物结合位点碱基变化以及引物扩增序列的长短或有无等因素影响。RAPD技术被广泛应用于许多植物种类的品种分类研究、种质资源的遗传基础研究、基因连锁标记、遗传图谱的构建等方面[15-18],对于研究植物种内亲缘关系具有重要意义。
作者采用改良的 RAPD标记技术对 25个花梅品种和 21个果梅品种的遗传关系进行了研究,以期为梅的科学分类以及品种资源的遗传基础研究提供更丰富的理论依据。
1 材料和方法
1.1 材料
供试的 25个花梅品种分属于 9个品种群,各品种的叶片均采自江苏省南京市中山陵园的梅园; 21个果梅品种的叶片均采自南京农业大学梅资源圃。随机采集各品种健康完整的嫩叶,采集后置于液氮中速冻,放置在 -40℃冰箱中保存、备用。供试花梅及果梅的品种名、类型及原产地见表 1。
1.2 方法
1.2.1 基因组总 DNA的提取方法 利用 DNeasy PlantM ini Kit试剂盒 (Q iagen Sciences公司生产)分别提取各品种的基因组总DNA,采用核酸蛋白测定仪(德国 Eppendorf公司生产)测定 DNA浓度,用质量体积分数 1.3%琼脂糖凝胶电泳检测DNA质量。
1.2.2 扩增引物的筛选及 PCR方法 实验用 RAPD随机引物由上海 Invitrogen生物技术公司合成,PCR扩增参照 Shim ade等[12]的方法。在前期研究中已知增加引物长度及严格选择 PCR退火温度可以克服RAPD分析过程中的不稳定性[19],因此,经过预实验从 100个长度为 11 bp的随机引物中筛选出 23个引物进行RAPD分析。筛选条件为:连续2次梯度 PCR条带清晰且不弥散、PCR产物重复出现、有质量好的条带指纹;温度以偏高为佳,对于适宜温度范围较大的引物则选择中间温度。
反应体系总体积为 15μL,包括 0.2mmo l·L-1dNTPs、1.5mmo l·L-1M g2+、0.8mmol·L-1引物、90 ng模板 DNA、0.4 UTaqDNA聚合酶和 1×PCR buffer,用双蒸水补足至 15μL。扩增反应程序为:
94℃预变性 5m in;94℃变性 30 s,35℃~45℃退火70 s,72℃延伸 2m in,共 42个循环;最后在 72℃条件下延伸 10 m in。扩增反应结束后将扩增产物置于4℃条件下保存。扩增产物用质量体积分数 1.3%琼脂糖凝胶电泳 30~50m in,紫外灯下观察并拍照。

表 1 供试花梅及果梅的品种名、类型及原产地1)Tab le 1 Nam e,type and or ig in of tested cu ltivars of flower ing and fru itingm ei(Prunusm um e Sieb.et Zucc.)1)
1.2.3 基因组总DNA的 RAPD-PCR分析方法 46个梅品种基因组总DNA的RAPD-PCR扩增反应体系总体积为 30μL,其组成成分及扩增反应程序与引物筛选实验相同,但不同引物退火温度略有差异,以各引物的最佳退火温度为准。扩增反应结束后将扩增产物置于 4℃条件下保存。
扩增产物用质量体积分数 1.3%琼脂糖凝胶电泳30~50m in,紫外灯下观察、拍照,并统计 23个引物扩增出的电泳条带数与多态性条带数。
1.3 数据处理
在电泳图谱上,同一位点上有条带记为“1”,无条带记为“0”,将获得的 0、1矩阵图输入 Excel表格中,采用 NYSYS-pc分析软件计算遗传相似系数,并用UPGMA聚类法构建遗传关系树状图。
2 结果和分析
2.1 RAPD-PCR的扩增结果分析
利用筛选出的 23个随机引物对 46个梅品种的基因组总DNA进行RAPD-PCR标记分析,扩增结果见表2;图 1所示则为引物 Y30的 RAPD-PCR扩增图谱。扩增结果显示:不同引物扩增条带的长度范围不同,23个随机引物总体扩增条带的长度范围为 250~3 000 bp。23个随机引物共扩增出 131条清晰的DNA条带,平均每个引物扩增出条带 5.7条。不同引物扩增得到的条带数不同,扩增条带最少的为引物Y53和 Y57,均只扩增出 2条带;扩增条带最多的为引物 Y10和 Y59,均扩增出 9条带。引物 Y11、Y23、Y28、Y30、Y33、Y57和A 4扩增出的条带全部为多态性条带,即扩增出的多态性条带百分率为 100.0%;引物 Y48和 Y53扩增出的多态性条带百分率最低,仅为 50.0%;23个引物扩增出的多态性条带百分率平均值为 81.7%。由此可见,供试的 46个花梅和果梅品种具有较丰富的遗传多样性。
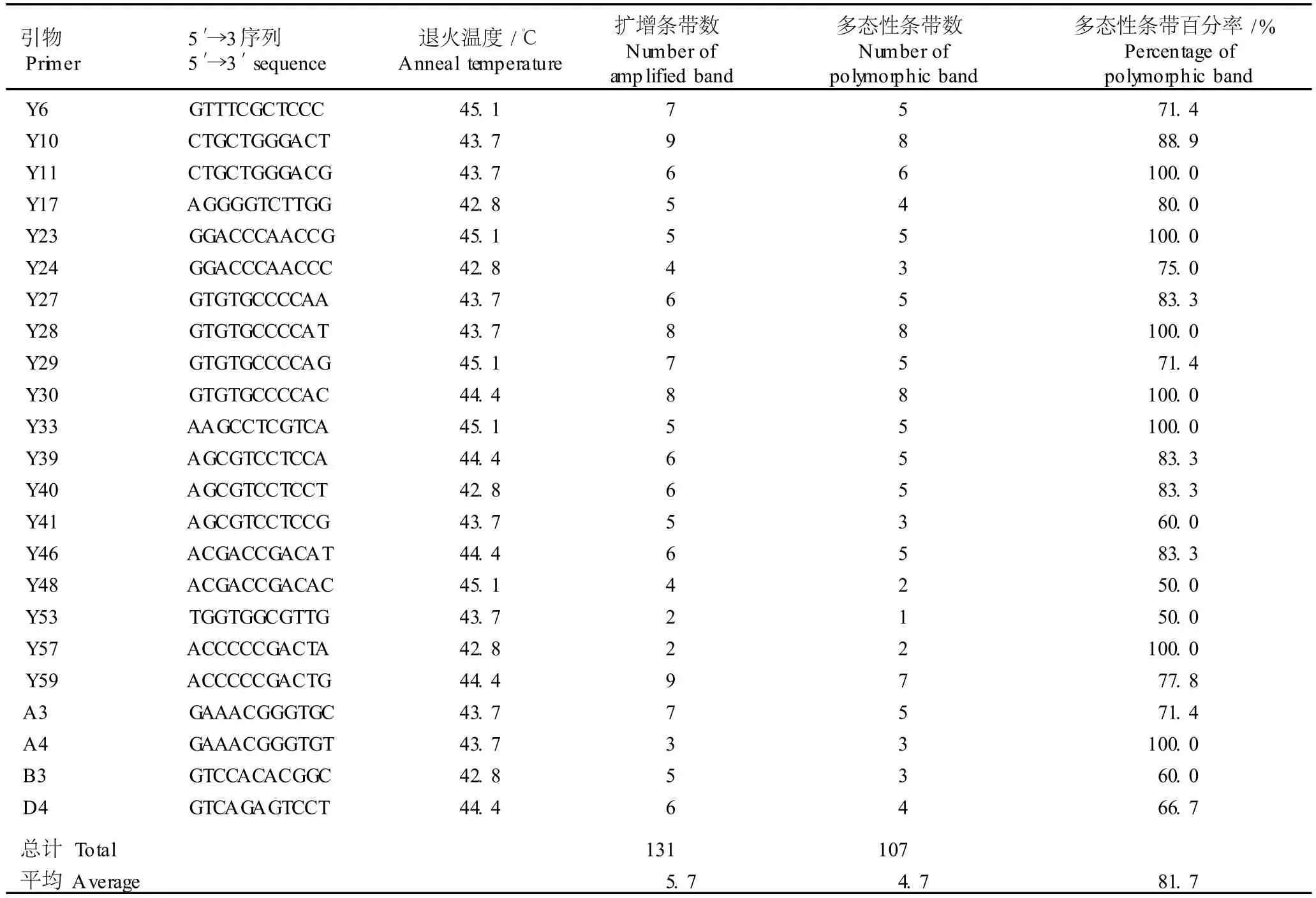
表2 用于46个花梅和果梅品种基因组总DNA RAPD-PCR分析的随机引物碱基序列及 RAPD-PCR扩增结果Tab le 2 Base sequences of random p r im ers used for RAPD-PCR ana lysis of tota l genom ic DNA from for ty-six cu ltivars of flower ing and fru iting m ei(Prunusm um e Sieb.et Zucc.)and RAPD-PCR am p lified resu lts
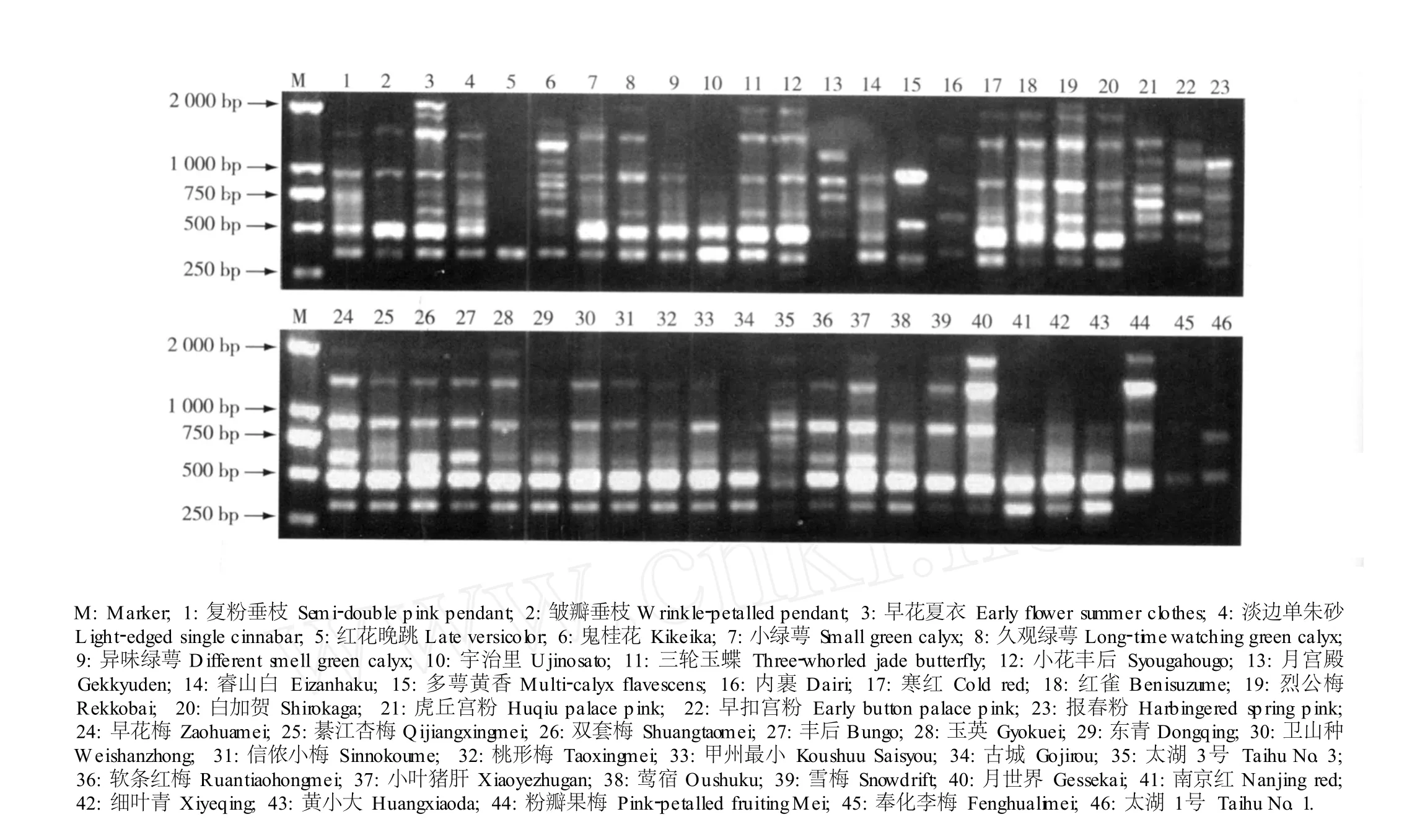
图1 引物Y 30对46个花梅和果梅品种基因组总DNA的 RAPD-PCR扩增图谱F ig.1 RAPD-PCR am p lified pa ttern of to ta l genom ic DNA from for ty-six cu ltivars of flower ing and fru itingm ei (Prunusm um e Sieb.et Zucc.)by pr im er Y 30
2.2 基于 RAPD扩增结果的花梅和果梅品种间的聚类分析
根据 23个 RAPD随机引物对 46个花梅和果梅品种基因组总DNA的 PCR扩增结果、利用NYSYS-pc分析软件进行系统聚类分析,获得了 46个花梅和果梅品种间遗传关系聚类图 (图 2)。由图 2可见,所有 46个品种的遗传相似系数为 0.63~0.83,在遗传相似系数 0.66处可将 46个品种分成A、B、C、D和 E组。A组包含 6个果梅品种和 11个花梅品种,其中果梅品种‘白加贺’、‘月世界’与花梅品种‘寒红’、‘红雀’、‘烈公梅’、‘雪梅’和‘粉瓣果梅’聚在一起,其中‘寒红’、‘红雀’、‘烈公梅’、‘雪梅’和‘粉瓣果梅’等品种均属于花梅中的江梅品种群,鉴于其既有观花价值又有食用价值的花果兼用的特点,因此很多结果习性较好的江梅类品种也可以视为观赏性高的果梅;另外,果梅品种‘綦江杏梅’、‘卫山种’、‘太湖3号’和‘软条红梅’与花梅品种‘复粉垂枝’、‘皱瓣垂枝’、‘小绿萼’、‘久观绿萼’、‘异味绿萼’和‘睿山白’聚在一起,其中,‘复粉垂枝’和‘皱瓣垂枝’属于花梅中的垂枝品种群,‘小绿萼’、‘久观绿萼’和‘异味绿萼’属于花梅中的绿萼品种群,‘睿山白’属于花梅中的玉蝶品种群,表明‘綦江杏梅’、‘卫山种’、‘太湖 3号’和‘软条红梅’与这些花梅品种群品种具有较近的亲缘关系。B组仅包含 4个品种,且均为花梅品种,分属于朱砂品种群和玉蝶品种群。C组共包含16个品种,除‘小花丰后’为花梅品种外,其余品种均为果梅,且从日本引进的果梅品种有 6个,其中花梅品种‘小花丰后’与从日本引进的果梅品种‘丰后’聚在一起,说明‘小花丰后’和‘丰后’可能是由于地域或一致的育种来源等原因而具有较近的亲缘关系。D组仅包含 4个品种且均为花梅品种,其中‘红花晚跳’和‘鬼桂花’这 2个品种均属于花梅中的洒金品种群,虽然二者的原产地分别为中国和日本,但二者具有较近的遗传关系;该组中的‘月宫殿’属于玉蝶品种群,‘多萼黄香’属于黄香品种群。E组共包含 5个梅品种,且均属于花梅中的宫粉品种群。从聚类图中可以看到:供试的 21个果梅品种和 25个花梅品种并不是简单地被分成 2类,而是根据遗传关系的远近被聚在不同的分组中,说明花梅和果梅品种具有一定的遗传相似性。此外,各分组中二类梅品种的数量差异较大,可能与不同品种的地理来源或遗传背景以及不同品种群的取样量等因素有关。
3 讨论和结论
从46个花梅和果梅品种的 RAPD-PCR扩增结果来看,用筛选出的 23个随机引物共扩增出 131条带,其中多态性条带 107条,即 46个花梅和果梅品种基因组总DNA包含 107个多态性位点,多态性条带百分率达到 81.7%,表明RAPD分子标记技术在梅的品种鉴定以及遗传多样性分析中具有一定的高效性。从遗传聚类分析结果看,46个品种并没有单纯地聚为花梅和果梅 2大类,而基本上是根据遗传相似系数互相交叉混合聚成 5类,部分花梅品种单独成组可能与品种之间具有相似的育种系谱有关。
花梅和果梅在园艺学性状上具有一定的差别,在应用过程中人们主要利用花的颜色、花瓣数和果实颜色来区分梅的类型与品种。但是,基于 RAPD标记技术的聚类分析结果显示:花梅和果梅在遗传学上是亲缘关系极近的同一类群植物,这与 L i等[6]和 Hayashi等[7]分别利用 SNP和 SSR分子标记得出的研究结果一致。大量花梅与果梅品种的出现与人为选择和利用以及有计划的育种密切联系。将果实与果核应用于花梅的实生选种以及杂交育种工作中,使得大量花梅品种具备一定的结实能力;花果兼用型梅品种的存在也在一定程度上证明了花梅与果梅同属于一个类群,具有相近的遗传背景。
[1]任万明,王吉怀,郑乃武.1979年裴李岗遗址发掘报告[J].考古学报,1984(1):23-52.
[2]陈俊愉.中国梅花[M].海口:中国海南出版社,1996:2-5.
[3]褚孟嫄.中国果树志:梅卷[M].北京:中国林业出版社,1999: 1-10.
[4]张加延.李杏资源研究与利用进展(五)[M].北京:中国林业出版社,2008:117-124.
[5]陈俊愉.中国梅花品种图志 [M].北京:中国林业出版社, 2009:1-4.
[6]Li X,W ang Y,W ang B,et al.Genetic relationships between fruiting and flowering mei(Prunusmume)cu ltivars using SNP markers[J].The Journal of Horticultural Science and B iotechno logy,2010,85(4):329-334.
[7]Hayashi K,Shimazu K,Yaegaki H,et al.Genetic diversity in fruiting and flower-ornamental Japanese ap ricot(Prunusmume) germp lasm s assessed by SSRmarkers[J].B reeding Science,2008, 58(4):401-410.
[8]Yorhihiko T S,KihachirU,M ichio L.A c lassification technique for cu ltivarsofPrunusmumeSieb.et Zucc.by isozymes[J].Journalof Japanese Forestry Society,1987,69(3):105-108.
[9]Ozaki T,Shimada T,Nakanishi T,et al.RAPD analysis for parentage determ ination inPrunusmumeSieb.et Zucc.[J]. Journalof the Japanese Society forHorticu ltural Science,1995,64 (2):235-242.
[10]陈俊愉,包满珠.中国梅 (Prunusmume)的植物学分类与园艺学分类[J].浙江林学院学报,1992,9(2):12-25.
[11]康素红,包满珠,陈龙清,等.梅花品种分类的花粉形态学研究[J].园艺学报,1997,24(2):67-71.
[12]Shimade T,Haji T,YamaguchiM,et al.C lassification ofmume (PrunusmumeSieb.et Zucc.)by RAPD assay[J].Journalof the Japanese Society for Horticultural Science,1994,63(3):543-551.
[13]W illiam s JG,Kubelik A R,L ivak K J,etal.DNA polymorphism amp lified by arbitrary p rimers are useful genetic markers[J]. Nucleic AcidsResearch,1990,18(22):6531-6535.
[14]W elsh J,Petersen C,M cC lelland M.Po lymorphism s generated by arbitrarily p rimed PCR in the mouse: app licatio to strain identification and genetic mapp ing[J].Nucleic A cids Research, 1991,19(2):303-306.
[15]L in K H,Lai Y C,Li H C,et al.Genetic variation and its relationship to rootweight in the sweetpotato as revealed by RAPD analysis[J].Scientia Horticulturae,2009,120(1):2-7.
[16]An N,Guo H B,KeW D.Genetic variation in rhizome lotus (NelumbonuciferaGaertn.ssp.nucifera)germp lasm s from China assessed by RAPD markers[J].Agricultural Sciences in China, 2009,8(1):31-39.
[17]Yang RW,Zhou Y H,D ing C B,et al.Relationship s amongLeymusspecies assessed by RAPD markers[J].B iologia Plantarum,2008,52(2):237-241.
[18]房海灵,李维林,梁呈元,等.基于 RAPD标记的薄荷属(MenthaL.)植物亲缘关系分析 [J].植物资源与环境学报, 2010,19(1):14-19.
[19]于华平,房经贵,张美勇,等.RAPD标记用于葡萄、苹果等七种果树的品种鉴定的研究[J].江西农业学报,2009,21(10): 5-9.
