NaCl胁迫条件下木槿嫁接苗和扦插苗及其砧木海滨木槿的生理差异
2011-12-31芦治国殷云龙於朝广莫海波
芦治国,殷云龙,於朝广,莫海波
〔江苏省·中国科学院植物研究所(南京中山植物园),江苏 南京 210014〕
嫁接可以提高植物耐盐性,接穗耐盐性的提高主要依靠砧木,但与接穗本身的耐盐性也有关[1]。目前,通过嫁接法提高园艺作物耐盐性的研究较多。Ruiz等[2]研究了盐胁迫条件下耐盐型烟草(Nicotiana tabacum L.)品种‘BB-162’和‘H-20’的根系对提高和改善敏感型烟草接穗产量和品质的作用;白丽萍等[3]以优良高抗茄子(Solamun melongena L.)品种‘托鲁巴姆’为砧木,研究比较了茄子品种‘辽茄5号’嫁接苗和自根苗中Na+和K+的分配情况,认为嫁接茄子可能是通过Na+和K+从根向地上部的选择性运输,减少地上部Na+含量和Na+/K+值,使耐盐性得到提高;陈淑芳等[4]的研究结果表明:NaCl胁迫条件下番茄(Lycopersicon esculentum Mill.)嫁接苗的保护酶活性、渗透调节物质和光合作用等均优于自根苗,耐盐性明显提高。
锦葵科(Malvaceae)木槿属(Hibiscus L.)植物广泛分布于全世界热带和亚热带地区,温带地区也发现了个别种。该属大多数种类花朵大而艳丽,观赏特性高,目前广泛作为观赏植物栽培;另外该属部分种类还可供药用及食用,在化工、食品添加剂和油脂等方面也具有较广阔的应用前景[5]。海滨木槿(H.hamabo Sieb.et Zucc.)为木槿属落叶树种,原产亚洲东部沿海地区,具有典型的盐生植物特征,能耐短时间的海水浸泡,具有耐盐、抗风和抗旱等特点[6-8]。以海滨木槿为砧木对木槿(H.syriacus L.)进行嫁接,嫁接亲和力很强[9],且嫁接植株生长良好。
为探讨以海滨木槿为砧木对木槿嫁接苗耐盐性的影响,作者在前期研究[9-10]的基础上,对不同质量浓度NaCl胁迫条件下木槿嫁接苗、作为砧木的海滨木槿扦插苗及作为接穗的木槿扦插苗的多项生理指标及其不同部位Na+和K+含量、K+/Na+值的差异进行了测定和比较。
1 材料和方法
1.1 材料
供试的海滨木槿和木槿为2008年夏季扦插的1年生扦插苗,扦插枝条来源于江苏省·中国科学院植物研究所实验苗圃。木槿嫁接苗采用同一批扦插成活的海滨木槿为砧木,于2009年3月上旬进行枝接,将嫁接苗置于控温温室内抚育管理,自然光照,白天温度为18℃~20℃、夜间温度不低于15℃,促其提前萌动,以利于接口处愈合。
1.2 方法
1.2.1 NaCl胁迫处理方法 2009年5月下旬植株恢复生长后,参照文献[10]的方法进行NaCl胁迫处理,共设置0(CK)、2、4、6、8和10 g·kg-16个NaCl质量浓度水平,每个处理5次重复,每一重复为1盆,每盆栽植3株。NaCl胁迫时间为50 d。
1.2.2 生理指标测定方法 胁迫处理结束后,选择植株中上部完全展开、生长状况良好的功能叶片用于生理指标的测定,每盆分别取样。取叶片4~8 g,自来水冲洗3遍后,用去离子水冲洗2遍,擦干备用。采用组织液外渗电导法[11]302测定相对电导率;采用茚三酮比色法[11]303测定脯氨酸含量;采用氮蓝四唑光化还原法[11]314测定超氧化物歧化酶(SOD)活性;采用硫代巴比妥酸法[11]305测定丙二醛(MDA)含量;采用乙醇-丙酮混合液提取法[12]134测定叶绿素含量;采用蒽酮比色法[12]195测定可溶性糖含量。
1.2.3 Na+和K+含量测定方法 胁迫处理结束后用去离子水将全部植株冲洗干净,吸干水分后于105℃快速杀青1 h,然后于85℃烘干至恒质量,分株称取干质量;将每一植株的根、茎、叶分开,采用FW80粉碎机(天津市泰斯特仪器有限公司)粉碎,过0.5 mm筛,备用。分别称取根、茎、叶粉末干样0.3 g,加入1 mol·L-1HCl30 mL,于35℃恒温水浴浸提24 h,用HY-2调速多用振荡器(常州国华电器有限公司)振摇1.5 h,过滤,用火焰光度法[12]121测定滤液中的Na+和K+含量,并计算不同部位的K+/Na+值。
据了解,津巴布韦农业投入品市场由当地私营和国际公司主导,这些公司利用政府增加的农业支持计划,提高自己的利润,加强在该国的业务。
1.3 数据分析
采用统计分析软件SPSS16.0和Excel2003进行数据处理,采用新复极差法(Duncan’s法)进行多重比较。
2 结果和分析
2.1 NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片叶绿素含量的比较
在质量浓度0~10 g·kg-1NaCl胁迫条件下,木槿嫁接苗、木槿和海滨木槿扦插苗叶片叶绿素含量的差异见表1。由表1可见:随NaCl质量浓度的提高,木槿嫁接苗叶片叶绿素含量呈先升高后降低的趋势,其中,在2 g·kg-1NaCl胁迫条件下木槿嫁接苗叶绿素含量最高,显著高于其他处理,且比对照增加了29.96%;随NaCl质量浓度的提高,与对照相比,木槿嫁接苗叶片叶绿素含量的增幅有所下降,10 g·kg-1NaCl胁迫条件下叶绿素含量与对照相近。随NaCl质量浓度的提高,木槿扦插苗叶片叶绿素含量呈先略升高后显著降低的趋势,至10 g·kg-1NaCl胁迫条件下木槿扦插苗全部死亡;在2 g·kg-1NaCl胁迫条件下木槿扦插苗叶绿素含量略高于对照但差异不显著,而在NaCl质量浓度高于或等于4 g·kg-1的条件下木槿扦插苗叶片叶绿素迅速分解,在8 g·kg-1NaCl胁迫条件下达到最低,仅为对照的13.33%。随NaCl质量浓度的提高,海滨木槿扦插苗叶片叶绿素含量呈现波动变化,但波动幅度较小;在NaCl质量浓度较低的条件下(2和4 g·kg-1)略低于对照但差异不显著;在8 g·kg-1NaCl胁迫条件下与对照基本持平;在6 g·kg-1NaCl胁迫条件下最高,但仅较对照提高了10.67%;而在10 g·kg-1NaCl条件下也高于对照但提高幅度略减小且与对照差异不显著。
在NaCl质量浓度相同的条件下,木槿嫁接苗叶片叶绿素含量总体上显著高于木槿和海滨木槿扦插苗。对照组木槿扦插苗的叶片叶绿素含量高于木槿嫁接苗及海滨木槿扦插苗,且在2 g·kg-1NaCl胁迫条件下木槿扦插苗的叶绿素含量也显著高于海滨木槿扦插苗但显著低于木槿嫁接苗。但随NaCl质量浓度的提高,在中、高质量浓度(高于或等于4 g·kg-1)的NaCl胁迫条件下,木槿嫁接苗与海滨木槿扦插苗叶片叶绿素含量变化幅度均无较大波动且维持在较高水平,其中木槿嫁接苗的叶绿素含量均最高;而木槿扦插苗的叶绿素含量显著降低,均显著低于前二者。表明以海滨木槿作为砧木进行嫁接,其根系对木槿接穗的叶绿素合成有一定的促进作用。
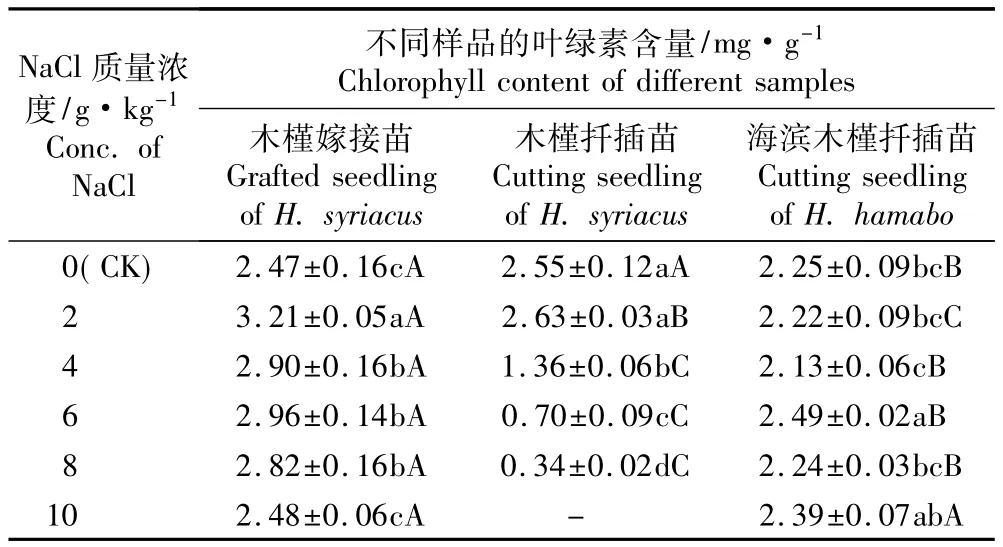
表1 不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片叶绿素含量的比较1)Table1 Comparison of chlorophyll content in leaf of grafted seedling of Hibiscus syriacus L.,cutting seedlings of H.syriacus and H.hamabo Sieb.et Zucc.under NaCl stress with different concentrations1)
2.2 NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片脯氨酸和可溶性糖含量的比较
逆境条件下,植物体内渗透调节物质含量的增加可以使植株保持适当的渗透势而防止脱水,同时对稳定和保护生物大分子的结构和功能具有重要意义[13],目前研究较多的有机渗透调节物质是可溶性糖和脯氨酸[14-15]。在不同质量浓度NaCl胁迫条件下,木槿嫁接苗、木槿和海滨木槿扦插苗叶片脯氨酸及可溶性糖含量的测定结果见表2。
2.2.1 脯氨酸含量的比较 由表2可见:随NaCl质量浓度(0~10 g·kg-1)的提高,木槿扦插苗叶片脯氨酸含量呈先升高然后逐渐下降的趋势,木槿嫁接苗叶片脯氨酸含量则呈现逐渐升高然后下降的趋势,而海滨木槿扦插苗叶片脯氨酸含量则呈现逐渐降低后略有升高的趋势。总体上看,木槿嫁接苗叶片脯氨酸含量及其变化幅度显著高于木槿和海滨木槿扦插苗。各处理组木槿嫁接苗叶片的脯氨酸含量均显著高于对照,并在8 g·kg-1NaCl胁迫条件下达到最高且显著高于其他处理组,并比对照增加了292.82%;在10 g·kg-1NaCl胁迫条件下其脯氨酸含量虽有所降低,但仍较对照增加了244.14%。木槿扦插苗叶片脯氨酸含量变化与嫁接苗明显不同,在2 g·kg-1NaCl条件下其脯氨酸含量较对照略有增加但差异不显著,仅为对照的1.18倍;在4~8 g·kg-1NaCl胁迫条件下,其脯氨酸含量均低于对照且呈现出逐渐降低的趋势,至8 g·kg-1NaCl胁迫条件下仅为对照的65.54%。各处理组海滨木槿扦插苗叶片脯氨酸含量均显著低于对照;在2和4 g·kg-1NaCl胁迫条件下,其叶片脯氨酸含量逐渐降低,至4 g·kg-1NaCl胁迫条件下脯氨酸含量下降为对照的57.05%,与对照差异显著;在6和8 g·kg-1NaCl胁迫条件下,其脯氨酸含量又逐渐增加但仍低于对照;而在10 g·kg-1NaCl胁迫条件下其脯氨酸含量略为降低,但仅较对照降低了33.29%。
2.2.2 可溶性糖含量的比较 由表2还可见:各处理组木槿嫁接苗和海滨木槿扦插苗叶片可溶性糖含量总体上高于或显著高于对照。在2、4和6 g·kg-1NaCl胁迫条件下,木槿嫁接苗和海滨木槿扦插苗可溶性糖含量逐渐增加,均在6 g·kg-1NaCl胁迫条件下达到最高,分别较对照增加了56.93%和42.17%;但在8和10 g·kg-1NaCl胁迫条件下,可溶性糖含量降低,但仍高于对照,在10 g·kg-1NaCl胁迫条件下分别比对照增加了11.36%和29.43%。各处理组木槿扦插苗叶片的可溶性糖含量均显著低于对照,在2、4和6 g·kg-1NaCl胁迫条件下,随NaCl质量浓度的提高,可溶性糖含量呈逐渐下降趋势,在6 g·kg-1NaCl胁迫条件下达到最低,仅为对照的41.30%。总体上看,木槿嫁接苗叶片可溶性糖含量均显著高于木槿和海滨木槿扦插苗。
综合上述分析结果表明:在NaCl质量浓度大于2 g·kg-1的胁迫条件下,木槿嫁接苗叶片脯氨酸和可溶性糖含量均显著高于木槿及海滨木槿扦插苗,说明在NaCl胁迫条件下木槿嫁接苗的渗透调节能力强于木槿和海滨木槿扦插苗。

表2 不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片脯氨酸和可溶性糖含量的比较1)Table2 Comparison of contents of proline and soluble sugar in leaf of grafted seedling of Hibiscus syriacus L.,cutting seedlings of H.syriacus and H.hamabo Sieb.et Zucc.under NaCl stress with different concentrations1)
2.3 NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片相对电导率和丙二醛(MDA)含量的比较
2.3.1 相对电导率的比较 由表3可以看出:2~10 g·kg-1NaCl胁迫条件下,木槿嫁接苗、木槿和海滨木槿扦插苗叶片相对电导率基本上均高于对照,其中海滨木槿扦插苗和木槿嫁接苗叶片相对电导率的增加幅度较小,而木槿扦插苗的增加幅度较大。在2~8 g·kg-1NaCl胁迫条件下,木槿嫁接苗叶片相对电导率与对照差异不显著,仅在10 g·kg-1NaCl胁迫条件下显著高于对照,但增加幅度仅为22.54%。在2和4 g·kg-1NaCl胁迫条件下海滨木槿扦插苗叶片的相对电导率与对照无显著差异,而在6、8和10 g·kg-1NaCl胁迫条件下,其叶片的相对电导率逐渐减小,但均显著高于对照,增加幅度分别为39.83%、35.55%和25.83%。随NaCl质量浓度的提高,木槿扦插苗叶片的相对电导率逐渐增加,且在4、6和8 g·kg-1NaCl胁迫条件下显著高于对照,分别为对照的1.47、1.69和1.82倍。
总体上看,在NaCl质量浓度较低(2 g·kg-1)的条件下,木槿嫁接苗与扦插苗的叶片相对电导率差异不显著,但均显著高于海滨木槿扦插苗;而在4、6和8 g·kg-1NaCl胁迫条件下,木槿扦插苗的叶片相对电导率显著高于木槿嫁接苗及海滨木槿扦插苗,表明木槿嫁接苗及海滨木槿扦插苗叶片细胞质膜受损程度明显小于木槿扦插苗。
2.3.2 MDA含量的比较 由表3还可见:各处理组木槿嫁接苗和扦插苗叶片MDA含量均高于或显著高于对照,其中,随着NaCl质量浓度的提高,木槿嫁接苗叶片MDA含量呈现波动的变化趋势,在4 g·kg-1NaCl胁迫条件下达到最高,为对照的1.41倍,其后有所下降;而木槿扦插苗叶片MDA含量则持续升高,在8 g·kg-1NaCl胁迫条件下达到对照的2.08倍,差异显著。在2和4 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗叶片MDA含量均低于对照,但差异不显著;而在6、8和10 g·kg-1NaCl胁迫条件下海滨木槿扦插苗叶片MDA含量逐渐增加,且均显著高于对照,在10 g·kg-1NaCl胁迫条件下达到对照的2.66倍。
总体上看,在NaCl质量浓度相同的条件下,海滨木槿扦插苗叶片的MDA含量显著高于木槿嫁接苗和扦插苗,而木槿嫁接苗的MDA含量基本上也均高于木槿扦插苗。
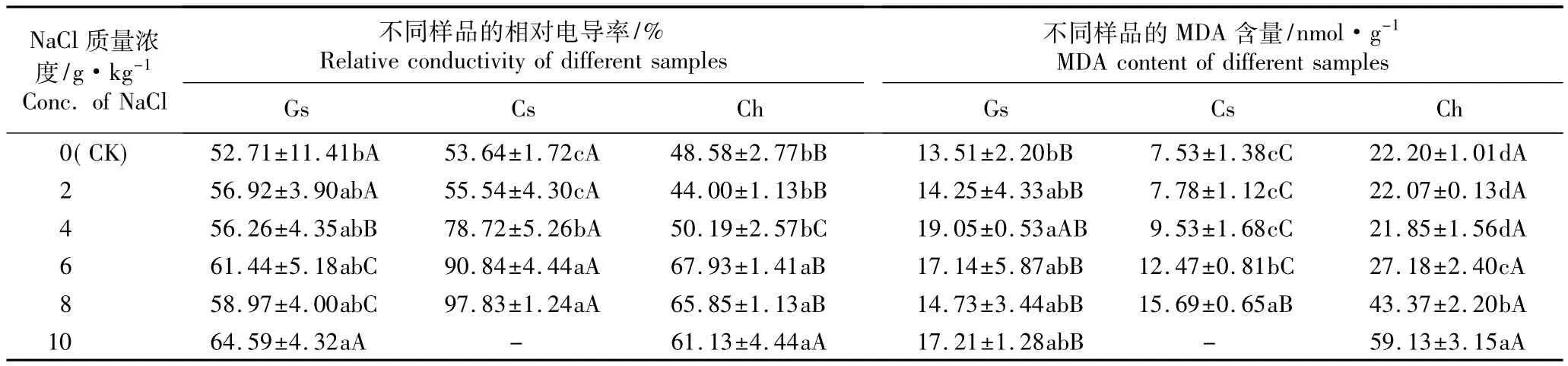
表3 不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片相对电导率和丙二醛(MDA)含量的比较1)Table3 Com parison of relative conductivity and MDA content in leaf of grafted seed ling of Hibiscus syriacus L.,cutting seed lings of H.syriacus and H.hamabo Sieb.et Zucc.under NaCl stress with different concentrations1)
2.4 NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片超氧化物歧化酶(SOD)活性的比较
SOD是植物体内酶促抗氧化保护系统的主要组成之一,对清除逆境胁迫下植物体内产生的活性氧(AOS)具有重要作用,对维持细胞膜的完整性和保证细胞的正常代谢活动都具有重要意义[15]。在不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片SOD活性测定结果见表4。
由表4可见:各处理组木槿嫁接苗叶片的SOD活性均显著高于对照,但总体上各处理组的SOD活性变化幅度较小。在2 g·kg-1NaCl胁迫条件下,木槿扦插苗叶片的SOD活性高于对照但差异不显著;而在4、6和8 g·kg-1NaCl胁迫条件下,其SOD活性均小于对照,其中6 g·kg-1NaCl胁迫处理组SOD活性显著低于对照及其他处理组。在2、4和6 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗叶片SOD活性均小于对照,且随NaCl质量浓度的提高呈现逐渐上升的趋势,但与对照均无显著差异,其中2 g·kg-1NaCl处理组的SOD活性最低;在8和10 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗叶片SOD活性均显著高于对照及其他处理组。
总体上看,在对照及2 g·kg-1NaCl胁迫条件下,木槿扦插苗叶片SOD活性高于木槿嫁接苗和海滨木槿扦插苗;而在4和6 g·kg-1NaCl胁迫条件下,木槿嫁接苗叶片的SOD活性均显著高于木槿和海滨木槿扦插苗;在8和10 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗叶片的SOD活性高于木槿嫁接苗和木槿扦插苗。
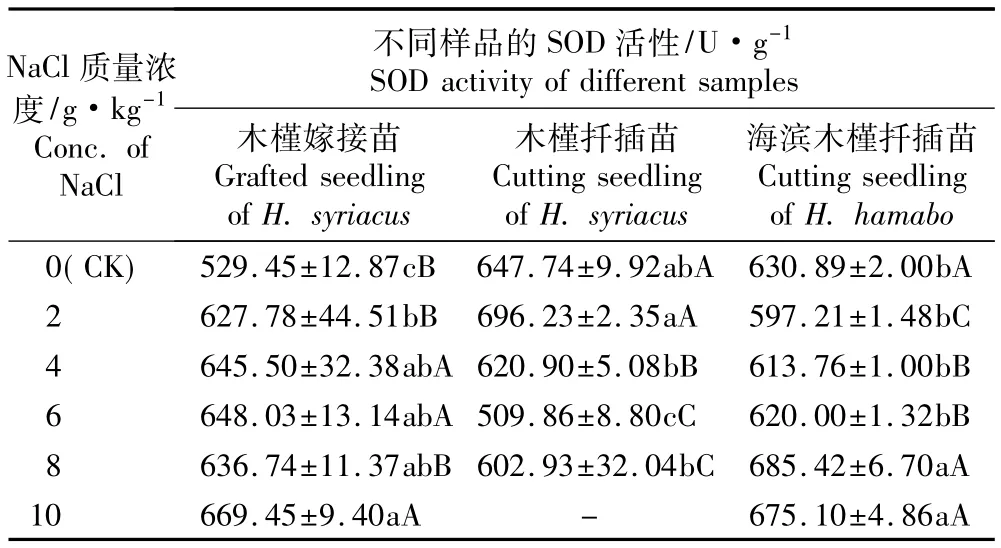
表4 不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗叶片超氧化物歧化酶(SOD)活性的比较1)Table4 Com parison of SOD activity in leaf of grafted seedling of Hibiscus syriacus L.,cutting seedlings of H.syriacus and H.hamabo Sieb.et Zucc.under NaCl stress with different concentrations1)
2.5 NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗不同部位Na+和K+含量及K+/Na+值的比较
对于非盐生植物来说,盐胁迫条件下过量Na+的摄入会对植物产生离子毒害,植物耐盐性与植株地上部对Na+和Cl-积累的限制力及保持高K+/Na+值的能力有关[16]。在不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗不同部位Na+和K+含量及K+/Na+值的变化见表5。
由表5可见:各处理组木槿嫁接苗、木槿和海滨木槿扦插苗根、茎、叶中的Na+含量均高于或显著高于对照,其中,木槿嫁接苗各器官以及木槿扦插苗茎和叶中的Na+含量随NaCl质量浓度的提高总体上呈逐渐增加的趋势,木槿扦插苗根及海滨木槿扦插苗各器官的Na+含量随NaCl质量浓度的提高呈先增加后减少的趋势。木槿嫁接苗叶和海滨木槿扦插苗根、茎和叶中K+含量总体表现出在NaCl质量浓度较低的条件下增加、在NaCl质量浓度较高的条件下降低的变化趋势,而木槿的嫁接苗和扦插苗根和茎中的K+含量呈现逐渐减小的趋势、木槿扦插苗叶中K+含量则呈现逐渐增加的趋势。各处理组木槿嫁接苗、木槿和海滨木槿扦插苗不同部位的K+/Na+值均随NaCl质量浓度的提高呈逐渐下降趋势,且总体上均低于对照。方差分析结果表明:NaCl胁迫对木槿嫁接苗、木槿和海滨木槿扦插苗根、茎、叶中的Na+和K+含量的影响均达显著水平。
在对照及2和4 g·kg-1NaCl胁迫条件下,木槿嫁接苗和扦插苗根和茎中的K+含量差异不显著,但均显著高于海滨木槿扦插苗的根和茎;而在叶片中,海滨木槿扦插苗的K+含量显著高于木槿嫁接苗和扦插苗。在6 g·kg-1NaCl胁迫条件下,根中的K+含量以海滨木槿扦插苗最高、木槿扦插苗最低;茎中的K+含量以木槿嫁接苗最高、木槿扦插苗最低;叶中的K+含量以海滨木槿扦插苗最高、木槿嫁接苗最低,差异均达显著水平。在8 g·kg-1NaCl胁迫条件下,根中的K+含量以海滨木槿扦插苗最高、木槿扦插苗最低;茎中的K+含量以木槿扦插苗最低,木槿嫁接苗和海滨木槿扦插苗差异不显著;叶中的K+含量以木槿嫁接苗最高、木槿和海滨木槿扦插苗则差异不显著。在10 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗根和茎中的K+含量显著高于木槿嫁接苗,叶中的K+含量显著低于木槿嫁接苗。
在对照条件下,木槿扦插苗各器官的Na+含量均最低,海滨木槿扦插苗各器官的Na+含量均最高;在2和4 g·kg-1NaCl胁迫条件下,木槿嫁接苗和扦插苗根中的Na+含量显著高于海滨木槿扦插苗、茎和叶中的Na+含量则显著低于后者;而在6 g·kg-1NaCl胁迫条件下,木槿嫁接苗茎和叶中的Na+含量均最低,海滨木槿扦插苗根中的Na+含量最低,木槿扦插苗根和叶的Na+含量均最高,海滨木槿扦插苗茎中的Na+含量最高;在8 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗根中的Na+含量最高,木槿扦插苗茎和叶中的Na+含量均最高,分别为对照的9.47和36.00倍;而木槿扦插苗根、木槿嫁接苗茎和海滨木槿扦插苗叶中的Na+含量均最低,分别仅为对照的3.40、2.51和1.93倍;在10 g·kg-1NaCl胁迫条件下,木槿嫁接苗根和叶中的Na+含量显著高于海滨木槿扦插苗,而叶中的Na+含量则显著低于后者。
海滨木槿扦插苗地上部分(茎和叶)K+/Na+值变化幅度明显小于木槿的嫁接苗和扦插苗。总体上看,不同处理组海滨木槿扦插苗根的K+/Na+值均最大,木槿嫁接苗地上部分的K+/Na+值均最大。在2和4 g·kg-1NaCl胁迫条件下,海滨木槿扦插苗地上部分的K+/Na+值均最低,而在质量浓度较高的NaCl胁迫条件下,木槿扦插苗各部位的K+/Na+值均最低。
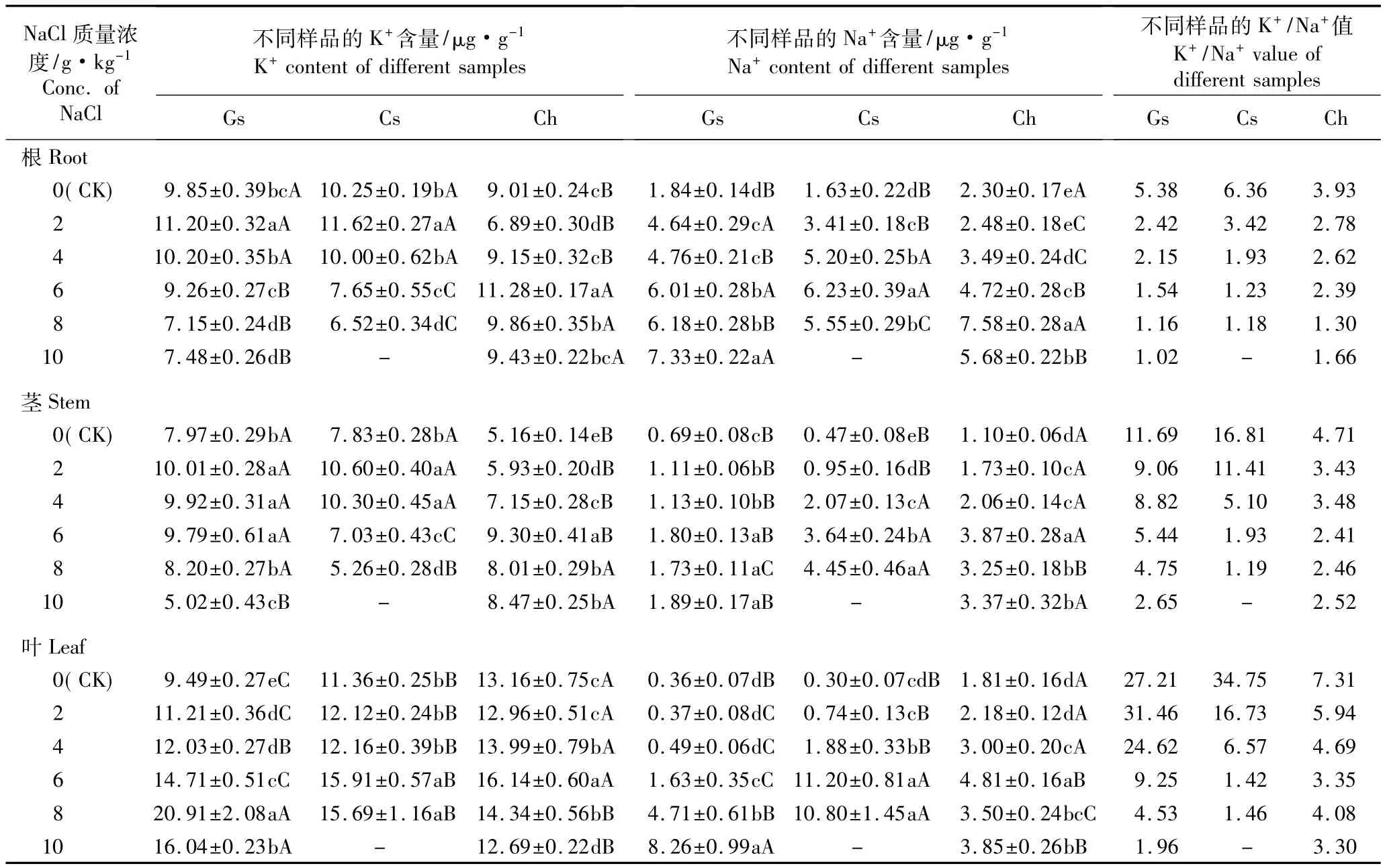
表5 不同质量浓度NaCl胁迫条件下木槿嫁接苗、木槿和海滨木槿扦插苗不同部位K+和Na+含量及K+/Na+值的比较1)Table5 Comparison of K+and Na+contents and K+/Na+value in different parts of grafted seedling of Hibiscus syriacus L.,cutting seedlings of H.syriacus and H.hamabo Sieb.et Zucc.under NaCl stress with different concentrations1)
3 讨论和结论
3.1 叶绿素含量的变化
刁丰秋等[17]和Strogonov[18]认为:在盐胁迫条件下,不同植物叶绿素合成与分解的反应机制各异。本研究结果表明:随NaCl胁迫浓度的提高,海滨木槿扦插苗叶片叶绿素含量表现出波动的变化趋势,可能与盐生植物耐盐机制启动有关。木槿嫁接苗叶片叶绿素含量在低浓度NaCl胁迫条件下显著增加,随NaCl胁迫浓度的提高其增幅有所下降,直至降至对照组水平;而木槿扦插苗叶片叶绿素含量在NaCl胁迫条件下显著下降。说明NaCl胁迫条件下,作为砧木的盐生植物海滨木槿对木槿接穗叶片叶绿素的合成与分解产生了重要作用,低质量浓度NaCl胁迫下促进了木槿接穗叶片叶绿素的合成、高质量浓度NaCl胁迫下有效缓解了接穗叶片叶绿素的分解。叶绿素含量的变化直接关系到植物光合同化过程,影响植物同化产物的积累,进而影响其生长。在NaCl胁迫条件下,木槿嫁接苗叶片叶绿素含量显著高于木槿扦插苗,二者的高生长和生物量的积累也表现出基本一致的规律[10]。
3.2 细胞膜透性、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的变化
王爱国等[19]的研究结果表明:MDA含量与细胞膜透性构成一对矛盾统一体,细胞膜透性直接反映膜受伤害的程度,MDA含量间接表示膜受损状况,并兼有反馈作用。酶促保护系统是植物体内抗氧化保护体系的重要组成部分,包括SOD、POD和CAT等酶类,其中SOD是抗氧化系统中极为重要且在生物体内普遍存在的金属酶。陈洁等[20]认为:在盐胁迫初期或胁迫强度较小时,植物体内的抗氧化保护体系能及时猝灭过量的活性氧,植物表现出一定的抗性;但随着盐胁迫时间的延长或胁迫强度的加大,植物体内积累较多的活性氧,活性氧代谢系统的平衡受到影响,SOD、CAT、POD和GSH等活性氧清除剂的活性受到破坏,导致植物对活性氧的防御能力下降,植物体内活性氧产生和猝灭的动态平衡被打破,引起生物膜受损等一系列伤害。
木槿嫁接苗、木槿和海滨木槿扦插苗叶片相对电导率和MDA含量变化均反映出随NaCl胁迫浓度的提高细胞膜受损程度呈增大趋势,但由于对NaCl耐性的差异,3种苗木间相对电导率和MDA含量变化差异显著。总体来看,海滨木槿扦插苗和木槿嫁接苗叶片相对电导率的变化较木槿扦插苗平缓,中、高质量浓度NaCl胁迫条件下其相对电导率显著小于木槿扦插苗,表明前二者的细胞膜损伤程度较小。MDA含量变化与相对电导率变化情况相似,而对照组海滨木槿扦插苗叶片MDA含量显著高于木槿嫁接苗和扦插苗,但并未受到明显伤害,这有可能与海滨木槿具有盐生植物的特点有关[20]。在中、高质量浓度NaCl胁迫条件下,海滨木槿扦插苗和木槿嫁接苗叶片维持了较高的SOD活性水平,10 g·kg-1NaCl处理组二者叶片的SOD活性显著高于对照;而在2 g·kg-1NaCl胁迫条件下木槿扦插苗叶片SOD活性较对照略有提高,之后随NaCl质量浓度的提高,SOD活性显著下降直至植株死亡;木槿嫁接苗叶片SOD活性变化趋势与木槿扦插苗明显不同,表明砧木根系对维持接穗的SOD活性、减小盐离子对接穗质膜的胁迫以及减少叶片MDA的产生具有重要作用。
3.3 脯氨酸和可溶性糖含量的变化
无论是盐生植物还是非盐生植物,都是通过从外界吸收盐离子和自身合成有机小分子物质进行渗透调节,只是不同植物用于渗透调节的无机离子和有机小分子物质的种类和比例不一样[21]。脯氨酸在胁迫条件下易于积累,是植物体抵抗渗透胁迫的有效方式之一[14];但也有学者认为脯氨酸积累并不代表植物耐盐能力的大小[20],不能作为耐盐性生理指标,可能更适宜作为胁迫敏感性指标[22]。本研究结果显示:随着NaCl质量浓度的提高,海滨木槿扦插苗叶片脯氨酸含量呈现持续下降的趋势,而木槿嫁接苗和扦插苗叶片脯氨酸含量均表现为先增加然后下降的趋势。随着NaCl质量浓度的提高,木槿嫁接苗和海滨木槿扦插苗叶片可溶性糖含量也呈先增加后下降的趋势,且同一处理组木槿嫁接苗叶片可溶性糖含量显著高于海滨木槿和木槿扦插苗。可溶性糖及脯氨酸均为植物生理代谢过程中的产物,这两类物质的生成均与植物光合同化过程有紧密联系,随着NaCl胁迫浓度达到一定阈值,木槿嫁接苗、木槿和海滨木槿扦插苗叶片可溶性糖和脯氨酸含量普遍下降,这有可能与逆境下植物光合同化过程受到抑制有关。根据上述分析结果可见:NaCl质量浓度在一定范围内,由于砧木的影响,木槿嫁接苗的渗透调节作用明显优于其扦插苗,抗逆性得到显著提高。
3.4 Na+、K+吸收及K+/Na+值的变化
决定植物耐盐能力的关键在于其对Na+、K+和Cl-等离子的吸收,通过限制Na+和Cl-进入体内、选择性吸收K+,提高植物的耐盐碱能力,因而,植物体内Na+和K+水平是反映植物耐盐特性的良好指标[23]。随NaCl胁迫浓度的提高,木槿嫁接苗、木槿和海滨木槿扦插苗不同部位的Na+含量均不同程度提高,而K+/Na+值均呈下降趋势;在6 g·kg-1NaCl胁迫条件下,木槿嫁接苗茎和叶中的Na+含量显著增加,但随NaCl质量浓度的提高,茎中的Na+含量无显著变化,而叶片中的 Na+含量急剧增加;在中、高质量浓度NaCl胁迫条件下,木槿嫁接苗地上部分(茎和叶)中Na+含量显著低于木槿扦插苗,维持了较高的K+/Na+值。
K+/Na+值随NaCl质量浓度的提高而下降,表明Na+的大量进入降低了植物对K+的选择性吸收。在中、高质量浓度NaCl胁迫条件下,木槿嫁接苗和海滨木槿扦插苗茎和叶中的K+/Na+值明显大于木槿扦插苗,说明在一定NaCl质量浓度范围内,作为砧木的海滨木槿根系对K+的选择性吸收能力较强,并在一定程度上限制了Na+向木槿嫁接苗地上部分的输送,使木槿嫁接苗地上部分的K+/Na+值大于其扦插苗。
研究结果还表明:NaCl胁迫条件下,木槿嫁接苗叶片的SOD活性、细胞膜透性、叶绿素和可溶性糖含量等生理指标总体上显著优于木槿扦插苗,在一定NaCl质量浓度范围内,砧木(海滨木槿)限制了Na+进入木槿嫁接苗体内并使Na+在根部有效积累,使木槿嫁接苗地上部分Na+含量显著低于木槿扦插苗(P<0.05),维持了较高的K+/Na+值;而在中、高质量浓度NaCl胁迫条件下木槿嫁接苗叶片的脯氨酸和可溶性糖含量显著高于海滨木槿和木槿扦插苗,表明渗透调节物质的积累有可能是木槿嫁接苗耐盐性提高的生理机制之一。这与白丽萍等[3]和陈淑芳等[4]对嫁接茄子和嫁接番茄耐盐性的研究结果一致。
综上所述,以耐盐植物为砧木可在一定程度上提高接穗的耐盐性,砧木对接穗生理指标变化的影响除与根系对Na+的吸收和运输特性有关以外,是否还和砧木与接穗间生长物质、细胞内含物甚至遗传物质之间的交换有关?尚待进一步的探讨。木槿栽培品种和变型较多,以不同抗性的个体作为接穗,其耐盐性是否存在差异?有待进一步深入的比较和研究。
[1]EstañMT,Martinez-Rodriguez MM,Perez-Alfocea F,et al.Grafting raises the salt tolerance of tomato through limiting the transport of sodium and chloride to the shoot[J].Journal of Experimental Botany,2005,56(412):703-712.
[2]Ruiz JM,Ríos J J,Rosales MA,et al.Grafting between tobacco plants to enhance salinity tolerance[J].Journal of Plant Physiology,2006,163(12):1229-1237.
[3]白丽萍,周宝利,李 宁,等.盐胁迫下嫁接茄的离子吸收和运输[J].植物生理学通讯,2005,41(6):767-769.
[4]陈淑芳,朱月林,刘友良,等.NaCl胁迫对番茄嫁接苗保护酶活性、渗透调节物质含量及光合特性的影响[J].园艺学报,2005,32(4):609-613.
[5]李秀芬,朱建军,张德顺.木槿属树种应用与研究现状分析[J].上海农业学报,2006,22(2):108-110.
[6]杨 华,杜国坚,汪奎宏.胁迫环境下海滨木槿生理特性的研究[J].浙江林业科技,2008,28(3):43-47.
[7]李会欣,吴 明,方炎明,等.NaCl胁迫对海滨木槿叶片生理特性的影响[J].植物资源与环境学报,2010,19(3):55-61.
[8]俞慈英,徐树华.海滨木槿的驯化及开发利用前景[J].林业科学研究,1999,12(2):210-213.
[9]芦治国,殷云龙,於朝广.以海滨木槿为砧木嫁接培育耐盐型木槿属苗木的方法:中国,200910184249.1[P].2011-02-03.[10]芦治国,周冬琴,魏秀君,等.NaCl胁迫对嫁接木槿生长的影响[J].江苏农业科学,2010(3):241-243,247.
[11]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999.
[12]李合生.植物生理生化实验原理和技术[M].1版.北京:高等教育出版社,2000.
[13]李 彦,张英鹏,孙 明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258-265.
[14]郭艳茹,詹亚光.植物耐盐性生理生化指标的综合评价[J].黑龙江农业科学,2006(1):66-70.
[15]徐鲜钧,沈宝川,祁建民.植物耐盐性及其生理生化指标的研究进展[J].亚热带农业研究,2007,3(4):275-280.
[16]罗 辉.玉米幼苗对盐胁迫的响应和适应[J].井冈山师范学院学报:自然科学,2004,25(5):23-28.
[17]刁丰秋,章文华,刘友良.盐协迫对大麦叶片类囊体膜组成和功能的影响[J].植物生理学报,1997,23(2):105-110.
[18]Strogonov BP.Structure and Function of Plant Cell in Saline Habitats:New Trends in the Study of Salt Tolerance[M].New York:John Wiley&Sons,Inc.,1973:78-80.
[19]王爱国,邵从本,罗广华.丙二醛作为脂质过氧化指标的探讨[J].植物生理学通讯,1986,22(2):55-57.
[20]陈 洁,林栖凤.植物耐盐生理及耐盐机理研究进展[J].海南大学学报:自然科学版,2003,21(2),177-182.
[21]赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993:9-10.
[22]Liu J,Zhu JK.Proline accumulation and salt-stress-induced gene expression in a salt-hypersensitivemutant of Arabidopsis[J].Plant Physiology,1997,114(2):591-596.
[23]廖 岩,彭友贵,陈桂珠.植物耐盐性机理研究进展[J].生态学报,2007,27(5):2077-2089.
