耐力训练对急性酒精性肝损伤线粒体自噬功能的影响及机制研究
2011-12-29马国栋刘艳环
马国栋,刘艳环
耐力训练对急性酒精性肝损伤线粒体自噬功能的影响及机制研究
马国栋,刘艳环
目的:研究耐力训练对大鼠急性酒精性肝损伤肝脏线粒体自噬变化规律及其机制。方法:以SD大鼠建立急性酒精性肝损伤模型,以12周无负重游泳为运动手段,测定血清ALT和AST以及肝脏线粒体活性氧生成、线粒体MDA含量、线粒体顺乌头酸酶活性、线粒体膜电位、线粒体自噬蛋白BNIP3、NIX和HIF-1αmRNA表达以及HIF-1α蛋白表达。结果:急性酒精摄入导致血清ALT和AST显著升高以及肝脏线粒体活性氧生成显著升高,线粒体MDA含量显著升高,线粒体顺乌头酸酶活性显著降低,线粒体膜电位显著降低,线粒体自噬蛋白BNIP3、NIX和HIF-1αmRNA以及HIF-1α蛋白表达显著升高;耐力训练后急性酒精摄入使血清ALT和AST以及肝脏线粒体活性氧生成,线粒体MDA含量,线粒体顺乌头酸酶活性,线粒体膜电位,线粒体自噬蛋白BNIP3、NIX和HIF-1αmRNA以及HIF-1α蛋白表达均表现出与未耐力训练急性酒精摄入相同的变化规律,但变化幅度相对较小;注射HIF-1抑制剂YC-1无论是未耐力训练还是耐力训练大鼠再给予急性酒精摄入时BNIP3、NIX mRNA表达均显著低于未注射抑制剂组,而HIF-1αmRNA表达未见显著性差异,但HIF-1α蛋白表达显著降低。结论:急性酒精摄入引起肝脏线粒体自噬加强,其自噬与HIF-1表达增加有关,而耐力训练可能通过增强肝脏氧气供应能力,进而引起HIF-1表达降低,导致线粒体自噬功能减弱。
耐力训练;急性酒精性肝损伤;线粒体自噬;鼠;动物实验
1 序言
在日常生活中,常常因为某些原因出现短期大量饮酒的现象,短期过量饮酒会导致急性酒精中毒,造成肝脏的急性损伤。急性酒精性肝损伤与氧化应激和炎症反应关系密切。氧化应激导致线粒体异常,而异常线粒体的清除程度与急性酒精性肝损伤的程度密切相关。线粒体的清除与线粒体自噬有关。线粒体自噬是指通过选择性地清除线粒体的过程。线粒体自噬发生与许多因素有关,有研究发现,低氧诱导因子-1和活性氧均能引起线粒体自噬加强[20]。急性酒精性肝损伤过程中线粒体自噬变化如何以及引起线粒体自噬的信号通路如何,目前鲜见报道。笔者前期工作证实,耐力训练能够预防非酒精性脂肪肝,改善线粒体的功能[1],但耐力训练对急性酒精性肝损伤肝脏线粒体自噬的影响如何,目前罕见报道。本研究拟在这方面进行探讨,为更好地了解急性酒精性肝损伤发病的线粒体机制提供实验依据。
2 材料与方法
2.1 实验设计
雄性6周龄SD大鼠72只,体重181±4.10g,购自北京大学医科部实验动物中心。每天光照均为12h,自由饮水。实验动物随机分为6组:1)对照组(C,n=12);2)12周游泳运动组(E,n=12);3)12周游泳运动+5天酒精摄入组(EA,n=12);4)12周游泳运动+5天酒精摄入+YC-1组(EAY,n=12);5)对照组+5天酒精摄入组(CA,n=12);6)对照组+5天酒精摄入+YC-1组(CAY,n=12)。每一组在实验结束,禁食12h处死,取肝脏,用于测定各项指标。YC-1为HIF-1α抑制剂3-(5′-hydroxymethyl-2′-furyl)-1-benzylindazole(YC-1)。采用腹腔注射的方式,按照10mg/kg,每天1次,共5天,与酒精摄入同步进行。
2.2 耐力训练模型
游泳运动方案:采用无负重游泳训练,水温(29±2)℃,第1周每天运动0.5h,第2周增至1h,从第3周开始增至1.5h,每周5次,共12周。
2.3 急性酒精性肝损伤模型
参照文献[2]:模型组每次按0.8ml/100g给大鼠灌胃红星二锅头酒(56°),每天2次,中间间隔1h;对照组同模型组的方法相同灌服同体积的生理盐水。连续灌胃5天。
2.4 肝脏样本制备与线粒体提取
断头处死迅速取出肝脏约2g,用冷生理盐水冲洗净血污、剪碎,加10ml预冷生理盐水,电动匀浆(B.Braun,Germany)。0℃~4℃离心(Beckman),600g离心10min,弃沉淀,上清于10 000g离心10min。沉淀加入5ml冷生理盐水混匀。10 000g离心10min。沉淀悬浮在约2ml冷生理盐水中。悬浮液即为线粒体。
2.5 指标测定
2.5.1 血清ALT和AST的测定
分离血清,测定血清及肝脏组织ALT和AST活性,严格按照南京建成生物工程研究所的试剂盒说明书进行检测。
2.5.2 线粒体ROS生成的测定
取已定量的大鼠肝脏线粒体悬液,加入测定介质中(pH 7.4)。加入底物苹果酸0.1mmol/L和谷氨酸1 mmol/L以启动态4呼吸。最后加入DCFH-DA,终浓度为5μmol/L。反应总体系为3ml。避光37℃水浴15min。水浴后立即于荧光分光光度计(RF-5301PC,日本)下测定5~10min(激发波长499nm,发射波长521nm)。测定设置为:时间增量1s;积分时间1s。测试过程保持37℃恒温。根据荧光变化情况测定线粒体ROS的生成。
系统工程助推新时代的强国梦....................................................................................................................................................薛惠锋(1)
2.5.3 肝脏线粒体顺乌头酸酶活性、MDA含量的测定
按文献[10]方法,测定顺乌头酸酶活性;根据过氧化脂质降解产物中的丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物,在分光光度计(Cintr10,澳大利亚)532nm处有最大吸收峰,测定MDA含量。
2.5.4 线粒体膜电位的测定
采用荧光分光光度计(Cary Eclipse,Varian Co.美国),利用荧光探针流动透析装置来定量测定线粒体跨膜电位。0.5ml的反应介质(基点为O点)先加0.4μmol/L Rh123(Sigma Co.),待扫描平衡后(A点),再加入0.8μmol/L Rh123,再扫描平衡(B点),用作标定荧光基准,然后加入0.5mg的肝脏线粒体,由于存在静息态跨膜电位使荧光淬灭(R点),当平衡后加入苹果酸(0.1mmol/L)和谷氨酸(1mmol/L),出现与能化态跨膜电位差相关的荧光强度下降,描记到平衡为止(N点)。温度25℃,激发波长500 nm,发射波长525nm,能化态跨膜电位差按Nernst方程计算。

2.5.5 RT-PCR扩增线粒体自噬蛋白BNIP3、NIX以及低HIF-1αmRNA的表达
以上述的肝脏组织,用Trizol Reagent试剂盒(Mrcgene产品)与逆转录试剂盒(Ferment产品)参照说明书进行逆转录反应,以备用于线粒体自噬蛋白BNIP3和NIX以及低氧诱导因子HIF-1αmRNA的扩增。采用PE-9600(PE-Cetus Co,USA)PCR扩增仪扩增mRNA表达。自行设计引物:

反应参数:95℃预变性5min,然后进行如下5个循环:94℃30s,45℃45s72℃45s,然后进行25个循环,变性温度与延伸温度不变,终末延伸72℃7min,退火温度分别为52.5℃、54.5℃和56℃。
2.5.6 Western blotting测定肝脏HIF-1α蛋白表达
肝脏组织匀浆,将上样缓冲液与匀浆液样品混合煮沸10min,在垂直电泳仪(BIO-RAD,USA)上用相同体积的10μg蛋白质样品经15%SDS-PAGE分离后,转移于PVDF膜(Millipore产品)上。1∶1 000兔抗鼠HIF-1α血清4℃孵育过夜,洗涤3次,再以1∶1 000辣根过氧化物酶标记的羊抗兔IgG(H+L)抗体室温孵育1h,充分洗涤后,使用ECL试剂盒发光显影,X光胶片压片曝光,扫描定量各条带的与对照组的相对灰度值,对照组定位1。
2.6 统计学分析
3 结果
3.1 肝脏线粒体ROS、MDA含量以及顺乌头酸酶活性与血清ALT和AST的变化
如表1所示,MDA含量、线粒体ROS生成以及血清ALT和AST表现出相同的变化规律,E组显著低于C组,而EA组、EAY组、CA组、CAY组均显著高于C组,EA组、EAY组、CA组、CAY组均显著高于E组,EAY组、CA组、CAY组均显著高于EA组,CAY组显著高于EAY和CA组,EAY组与CA组未见显著性差异;顺乌头酸酶活性E组显著高于C组,而EA组、EAY组、CA组和CAY组均显著低于C组,而EA组、EAY组、CA组和CAY组均显著低于E组,EAY组、CA组和CAY组均显著低于EA组,CAY组显著低于EAY组和CA组,而EAY组与CA组未见显著性差异。
3.2 肝脏线粒体膜电位在各组大鼠中的变化
线粒体膜电位EAY组、CA组和CAY组均显著高于C组、E组和EA组,而EAY组、CA组和CAY组间未见显著性差异,C组、E组和EA组间也未见显著性差异(表2)。
表1 本研究各组大鼠肝脏线粒体MDA含量、线粒体ROS产生、顺乌头酸酶活性以及血清ALT和AST的比较一览表Table 1 The Comparison of Content of MDA,Mitochondrial ROS Production and Activity of Aconitase in Liver Mitochondria and ALT and AST in Serum in Different Group Rats (±S)

表1 本研究各组大鼠肝脏线粒体MDA含量、线粒体ROS产生、顺乌头酸酶活性以及血清ALT和AST的比较一览表Table 1 The Comparison of Content of MDA,Mitochondrial ROS Production and Activity of Aconitase in Liver Mitochondria and ALT and AST in Serum in Different Group Rats (±S)
注:*P<0.05,**P<0.001与C组比较;△P<0.01,△△P<0.001与E组比较;#P<0.05,##P<0.01,与EA组比较;&P<0.05,与EAY组比较;$P<0.01,与CA组比较。
MDA(nmol/mg·pro) ROS(unit/sec.mg pro) 顺乌头酸酶活性(U/mg) ALT(U/L) AST(U/L)C组 2.61±0.41 7.54±1.20 42.87±4.98 91.25±9.78 146.23±10.25 E组 1.49±0.25* 4.92±0.67* 53.22±5.68* 52.81±6.53* 107.54±8.78*EA组 3.56±0.74*△ 15.67±2.01**△△ 30.05±3.29*△ 134.28±10.65*△△ 180.65±12.37*△EAY组 4.24±0.74**△△# 20.01±2.37**△△# 24.21±2.37**△△# 150.21±11.24**△△# 200.32±13.59**△△#CA组 4.17±0.68**△△# 23.46±2.60**△△# 22.17±2.14**△△## 164.57±12.47**△△#& 221.34±14.56**△△#&CAY组 5.39±0.89**△△##&$32.58±3.42**△△##&$15.49±1.21**△△##&$199.56±15.63**△△##&$ 265.38±18.32**△△##&$
表2 本研究各组大鼠肝脏线粒体膜电位的变化一览表Table 2 The Change of Mitochondrial Potential in Liver in Different Group Rats (±S)

表2 本研究各组大鼠肝脏线粒体膜电位的变化一览表Table 2 The Change of Mitochondrial Potential in Liver in Different Group Rats (±S)
注:*P<0.05,与C组比较;△P<0.05,与E组比较;#P<0.05,与EA组比较。
C组 E组 EA组 EAY组 CA组 CAY组膜电位(mV)175.20±20.14 181.41±21.03 174.52±22.57 162.43±21.89*△# 165.60±20.16*△# 164.19±21.07*△#
3.3 线粒体自噬蛋白BNIP3、NIX以及HIF-1αmRNA在大鼠肝脏中的表达
HIF-1αmRNA表达EA组、EAY组、CA组和CAY组均显著高于C组和E组,CA组和CAY组均显著高于EA组和EAY组,C组与E组间未见显著性改变,CA组与CAY组也未见显著性改变(图1);BNIP3mRNA表达E组显著低于C组,而EA组、CA组和CAY组均显著高于C组,EA组、EAY组、CA组和CAY组均显著高于E组,EAY组和CAY组显著低于EA组,而CA组显著高于EA组和EAY组,EAY组与CAY组未见显著性改变,CAY组显著低于CA组(图2);NIX mRNA表达EA组、EAY组、CA组和CAY组均显著高于C组和E组,EA组与EAY组未见显著性差异,CA组与CAY组均显著高于EA组和EAY组,CA组与CAY组未见显著性差异(图3)。

图1 低氧诱导因子HIF-1αmRNA在各组大鼠肝脏中表达的变化示意图Figure 1. The Change of HIF-1αmRNA in Liver in Different Group Rats
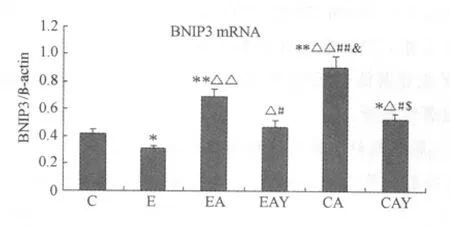
图2 BNIP3mRNA在各组大鼠肝脏中表达的变化示意图Figure 2. The Change of BNIP3mRNA in Liver in Different Group Rats
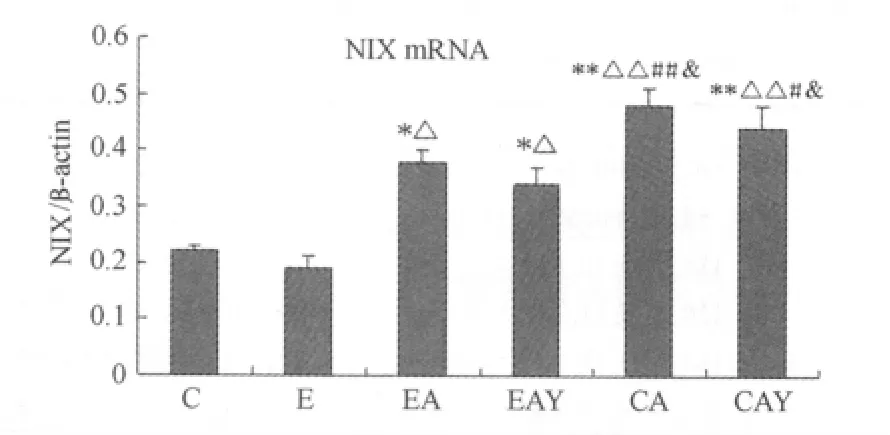
图3 NIX mRNA在各组大鼠肝脏中表达的变化示意图Figure 3. The Change of NIX mRNA in Liver in Different Group Rats
3.4 大鼠肝脏HIF-1α蛋白表达在各组中的变化
肝脏组织HIF-1α蛋白EA组与CA组显著高于C组和E组,CA组显著高于EAY组和CAY组,而C组、E组、EAY组和CAY组之间未见显著性差异(图4)。
4 讨论
4.1 急性酒精性肝损伤与线粒体自噬
在日常生活中,由于种种原因,会出现急性大量酒精摄入的情况。急性酒精摄入会导致肝脏产生大量的活性氧(ROS)造成氧化损伤和引起急性酒精性肝炎。急性酒精摄入导致氧化应激时,线粒体是最易受到攻击的对象。常常会使线粒体膜中不饱和脂肪酸氧化,线粒体DNA缺失等。更为严重地,是急性酒精的摄入不仅导致肝脏线粒体的氧化损伤和线粒体DNA的缺失,而且也会引起心脏、骨骼肌、大脑以及胰腺等线粒体DNA的缺失与线粒体的氧化损伤[14]。本研究发现,经过急性酒精摄入,血清ALT和AST以及线粒体ROS生成和MDA含量显著升高,而顺乌头酸酶活性显著降低(顺乌头酸酶位于线粒体中,其活性的抑制被认为是线粒体超氧阴离子产生的可靠标记[9],其活性的高低可以反映线粒体超氧阴离子产生的多少),说明急性酒精性肝损伤导致肝脏出现氧化应激现象。
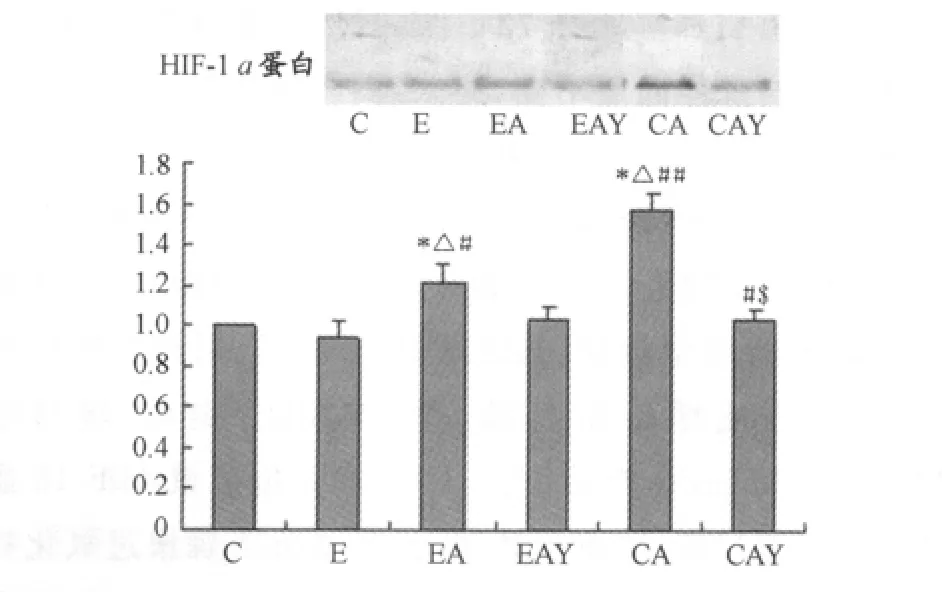
图4 低氧诱导因子HIF-1α蛋白在各组大鼠肝脏中表达的变化示意图Figure 4. The Change of HIF-1αProtein in Liver in Different Group Rats
线粒体作为细胞内重要的细胞器之一,不仅提供了机体所需的大部分能量,而且也是活性氧的重要来源,其良好功能的维持是保证细胞正常运行的基础之一。线粒体是高度动态的细胞器,这一动态的维持依赖于线粒体的融合/分裂以及线粒体自噬,这一平衡的维持对修复受损的线粒体和保证线粒体健康至关重要[18]。线粒体自噬是2005年由Lemasters命名的[13],界定为“经过特殊的、有选择性的、有目的性地通过自噬清除掉过多的或受损的线粒体”。自从发现这一过程后,线粒体自噬被认为在移除功能异常或去极化的线粒体以及产生大量ROS线粒体方面发挥着重要作用,而这一过程是维持线粒体的健康所必需的[11]。
给予大鼠50%热量限制1周,然后再恢复正常膳食1周,肝脏线粒体效率更高,态3呼吸能力更强,抗氧化能力增强[6],而在限食过程中,线粒体自噬增强[5],说明线粒体自噬是一种有效地保护线粒体的方式。预先给予心脏缺血-再灌注适应,心脏线粒体功能提高,从而保护心脏。其机理可能是通过线粒体自噬清除掉受损的线粒体,而受损的线粒体会产生大量的ROS,ROS会对健康的线粒体造成氧化损伤,线粒体自噬避免了这一情况的出现,从而保护心脏免受氧化应激的损伤。在酵母[17]和哺乳动物细胞[21]中,线粒体分裂要早于线粒体自噬,长的线粒体被分裂成易于包裹的片断,然后通过线粒体自噬清除掉受损的线粒体,从而控制线粒体的质量(即线粒体质量控制)[24]。除了线粒体质量控制外,线粒体自噬还可以调整线粒体数量以满足代谢需求[12],如红细胞的分化过程[19]。所有这些均说明线粒体自噬在维持线粒体功能方面所发挥的重要作用。
在哺乳动物中,与线粒体自噬直接相关的蛋白质有BNIP3蛋白、NIX蛋白、parkin和PINK1等。由于BNIP3和NIX与低氧关系密切,而parkin和PINK1与神经系统关系密切,因此,本研究选择BNIP3和NIX蛋白作为研究指标。BNIP3和NIX是Bcl-2家族蛋白成员,它们均含有一个BH3结构域,这一结构域是一个线粒体目标序列,它位于线粒体膜上[3,26]。在心肌细胞中,BNIP3与低氧诱导的线粒体自噬有关,在这一研究中发现,增加BNIP3的表达,直接与降低线粒体DNA分子数量有关,而普遍认为,线粒体分子数的减少与线粒体自噬有关[3]。相反,NIX功能的缺失通过影响线粒体自噬而损害正常网织红细胞的发育[19],这一结果表明,在网织红细胞发育过程中,NIX对线粒体与自噬体结合是必需的,缺少了线粒体自噬,对细胞是极为有害的。接下来的工作表明,NIX与自噬相关蛋白LC3和GABARAP结合,而这两个蛋白是形成融酶体所必需的[16]。细胞应激、生长或分化均影响到NIX表达,NIX使线粒体外膜通透性增加,细胞色素C从线粒体中释放出来,引起细胞调亡。更为重要的是,NIX缺陷细胞能够通过线粒体去极化剂使网织红细胞正常发育,这表明,NIX启动的线粒体自噬是通过线粒体去极化实现的。
线粒体自噬与帕金森综合症关系密切,目前关于线粒体自噬与疾病关系方面的研究主要集中在这一领域[22]。而线粒体自噬与急性酒精性肝损伤关系如何,目前鲜见报道。本研究发现,急性酒精摄入后,线粒体自噬蛋白BNIP3和NIX mRNA表达显著升高,而且线粒体膜电位也降低(线粒体去极化是线粒体自噬的前提条件之一[20]),说明急性酒精摄入引起肝脏线粒体自噬。急性酒精性肝损伤过程中,线粒体自噬的意义如何?以往研究认为,线粒体自噬可以清除受损的线粒体,保持线粒体的正常功能。而本研究发现,尽管急性酒精性肝损伤中线粒体自噬能力增强,但却出现了线粒体ROS生成增多、线粒体MDA含量增高以及血清ALT和AST升高的现象,这似乎与线粒体自噬的功能相互矛盾。但笔者认为,这一过程并不矛盾,因为尽管急性酒精性肝损伤过程中出现了线粒体自噬,清除掉部分受损的线粒体,但由于急性酒精摄入导致了大量的线粒体损伤,而线粒体自噬清除受损线粒体的能力是有限的,当超出其极限时,大量受损线粒体积累就不可避免了,受损的线粒体产生一系列的变化,如产生更多的ROS,降低线粒体ATP合成等,从而造成了肝线粒体的损伤,进而损伤肝细胞,导致急性酒精性肝损伤。为验证这一假设,本研究在大鼠中加入了HIF-1抑制剂YC-1。研究表明,急性酒精摄入会导致肝脏出现缺氧现象[7],而缺氧会导致肝脏HIF-1a表达升高。另有研究表明,在低氧环境下,可以通过HIF-1a诱导自噬蛋白BINP3表达升高[25],进而引起线粒体自噬。本研究的结果显示,加入HIF-1抑制剂YC-1的急性酒精性肝损伤大鼠肝脏BNIP3和NIX mRNA表达显著低于未加入抑制剂的急性酒精性肝损伤大鼠,而且加入抑制剂组血清ALT和AST以及线粒体ROS生成进一步增加,线粒体MDA含量进一步升高,而顺乌头酸酶活性进一步降低。这一方面说明,急性酒精性肝损伤引起的线粒体自噬是通过低氧诱导HIF-1表达途径;另一方面说明,急性酒精性肝损伤中线粒体自噬确实不足以清除受损的线粒体。
本研究还发现,HIF-1抑制剂YC-1并没有抑制HIF-1 mRNA的表达,而抑制其蛋白的表达,说明YC-1抑制剂作用于HIF-1的翻译过程。
4.2 耐力训练预防急性酒精性肝损伤的线粒体自噬机制
目前,关于耐力训练对急性酒精性肝损伤以及对线粒体自噬作用的研究鲜见报道。本研究发现,经过12周的游泳训练对急性酒精性肝损伤具有明显的预防作用,其具体表现为线粒体ROS生成减少、线粒体MDA含量降低、顺乌头酸酶活性和线粒体膜电位显著升高。这些确实说明,耐力训练具有较好的预防急性酒精性肝损伤的效果。有趣的是,本研究发现,经过12周耐力训练后,线粒体自噬蛋白BNIP3mRNA显著低于对照组,NIX mRNA与对照组未见显著性差异,而给予急性酒精摄入后,BNIP3和NIX表达又显著性升高,但显著性低于未训练急性酒精摄入组。从以上结果推测:线粒体自噬可能是一种应激保护线粒体的机制,但这一机制是否启动以及启动的程度取决于受损线粒体的程度,因此,耐力训练后受损线粒体显著减少,线粒体自噬功能相应降低,但当再给予急性酒精摄入时受损线粒体有出现增多,这一机制重新被启动放大,发挥保护线粒体的作用。在运动预防急性酒精性肝损伤过程中,抑制线粒体自噬的机制如何?运动对肌肉组织刺激激烈,但对肝脏直接刺激相对较小,因此,有氧运动可能通过间接的方式对急性酒精性肝损伤发挥预防作用。笔者前期工作证实,有氧运动能够预防非酒精性脂肪肝,改善肝脏线粒体功能,提高线粒体ATP合成能力,而线粒体ATP的合成需要氧气做基础[1],因此,笔者认为,运动调节肝脏线粒体自噬可能与改善肝脏氧气供应有关。许多研究也证实,有氧运动可以提高肺通气及气体交换机能[23],提高心脏的循环及泵血功能[4]以及促进促红细胞生成素形成、血红蛋白含量增加以及提高血氧含量[15],从而提高机体的供氧能力。当氧气供应相对充足时,肝脏HIF-1a表达显著降低,进而使线粒体自噬蛋白BNIP3和NIX表达降低,线粒体自噬功能减弱。本研究发现,经过12周耐力训练后再给予急性酒精摄入时,HIF-1amRNA和蛋白均显著升高,但显著低于未经过耐力训练给予急性酒精摄入大鼠,与之相对应,线粒体自噬蛋白BNIP3和NIX mRNA表达也表现出相同的变化规律,这有力地支持了笔者上面的假设。
5 结论
急性酒精摄入引起肝脏线粒体自噬加强,其自噬与HIF-1表达有关,而耐力训练通过增强肝脏氧气供应能力,进而引起HIF-1表达降低,导致线粒体自噬功能减弱。
[1]刘艳环,马国栋.耐力训练下调的HDMCP表达对非酒精性脂肪肝线粒体活性氧生成的影响[J].天津体育学院学报[J],2010,25(2):154-157.
[2]朱平生,庞亚丽,王宇亮,等.大鼠急性酒精性肝损伤模型的脂质过氧化损伤观察[J].中华中医药杂志,2006,21(6):376-377.
[3]BAND M,JOEL A,HERNANDEZ A,et al.2Hypoxia-induced BNIP3expression and mitophagy:in vivo comparison of the rat and the hypoxia-tolerant mole rat,Spalax ehrenbergi[J].FASEB J,2009,23(7):2327-2335.
[4]BURTSCHER M,GATTERER H,SZUBSKI C,et al.Effects of interval hypoxia on exercise tolerance:special focus on patients with CAD or COPD[J].Sleep Breath,2010,14(3):209-220.
[5]CARREIRA R S,LEE Y,GHOCHANI M,et al.Cyclophilin D is required for mitochondrial removal by autophagy in cardiac cells[J].Autophagy,2010,6(4):462-472.
[6]CRESCENZO R,LIONETTI L,MOLLICA M P,et al.Altered skeletal muscle subsarcolemmal mitochondrial compartment during catch-up fat after caloric restriction[J].Diabetes,2006,55(8):2286-2293.
[7]FRENCH S W.The role of hypoxia in the pathogenesis of alcoholic liver disease[J].Hepatol Res,2004,29(2):69-74.
[8]GOTTLIEB R A,GUSTAFSSON A B.Mitochondrial turnover in the heart[J].Biochim Biophys Acta,2011,1813(7):1295-1301.
[9]HAUSLADEN A,FRIDOVICH I.Measuring nitric oxide and superoxide:rate constants for aconitase reactivity[J].Methods Enzymol,1996,269:37-41.
[10]KESSOVA I G,CEDERBAUM A I.Mitochondrial alterations in livers of Sod1-/-mice fed alcohol[J].Free Radic Biol Med,2007,42(10):1470-1480.
[11]KIM I,RODRIGUEZ-ENRIQUEZ S,LEMASTERS J J.Selective degradation of mitochondria by mitophagy[J].Arch Biochem Biophys,2007,462(2):245-253.
[12]KISSOVA I,DEFFIEU M,MANON S,et al.Uth1p is involved in the autophagic degradation of mitochondria[J].J Biol Chem, 2004,279(37):39068-39074.
[13]LEMASTERS J J.Selective mitochondrial autophagy,or mitophagy,as a targeted defense against oxidative stress,mitochondrial dysfunction,and aging[J].Rejuvenation Res,2005,8(1):3-5.
[14]MANSOURI A,DEMEILLIERS C,AMSELLEM S,et al.A-cute ethanol administration oxidatively damages and depletes mitochondrial dna in mouse liver,brain,heart,and skeletal muscles:protective effects of antioxidants[J].J Pharmacol Exp Ther,2001,298(2):737-743.
[15]MARTINEZ-BELLO V E,SANCHIS-GOMAR F,NASCIMENTO A L,et al.Living at high altitude in combination with sea-level sprint training increases hematological parameters but does not improve performance in rats[J].Eur J Appl Physiol,2010,109(8):1125-1130.
[16]NOVAK I,KIRKIN V,MCEWAN D G,et al.Nix is a selective autophagy receptor for mitochondrial clearance[J].EMBO Rep,2010,11(1):45-51.
[17]NOWIKOVSKY K,REIPERT S,DEVENISH R J,et al.Mdm38protein depletion causes loss of mitochondrial K+/H+exchange activity,osmotic swelling and mitophagy[J].Cell Death Differ,2007,14(9):1647-1656.
[18]ONG S B,HAUSENLOY D J.Mitochondrial morphology and cardiovascular disease[J].Cardiovasc Res,2010,88(1):16-29.
[19]SCHWEERS R L,ZHANG J,RANDALL M S,et al.NIX is required for programmed mitochondrial clearance during reticulocyte maturation[J].Proc Natl Acad Sci U S A,2007,104(49):19500-19505.
[20]TOLKOVSKY A M.Mitophagy[J].Biochim Biophys Acta,2009,1793(9):1508-1515.
[21]TWIG G,ELORZA A,MOLINA A J,et al.Fission and selective fusion govern mitochondrial segregation and elimination by autophagy[J].EMBO J,2008,27(2):433-446.
[22]VIVES-BAUZA C,PRZEDBORSKI S.Mitophagy:the latest problem for Parkinson's disease[J].Trends Mol Med,2011,17(3):158-165.
[23]VOGTEL M,MICHELS A.Role of intermittent hypoxia in the treatment of bronchial asthma and chronic obstructive pulmonary disease[J].Curr Opin Allergy Clin Immunol,2010,10(3):206-213.
[24]WESTERMANN B.Mitochondrial fusion and fission in cell life and death[J].Nat Rev Mol Cell Biol,2010,11(12):872-884.
[25]ZHANG H,BOSCH-MARCE M,SHIMODA L A,et al.Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia[J].J Biol Chem,2008,283(16):10892-10903.
[26]ZHANG J,NEY P A.Role of BNIP3and NIX in cell death,autophagy,and mitophagy[J].Cell Death Differ,2009,16(7):939-946.
The Influence of Endurance Training on the Mitophagy and Its Mechanism in Alcohol-induced Acute Hepatic Injury in Rats
MA Guo-dong,LIU Yan-huan
Objective:To investigate the change of endurance training on mitophagy and its mechanism in alcohol-induced acute hepatic injury rats.Methods:It analyzed the expressions of BNIP3,NIX and HIF-1αmRNA and content of HIF-1αprotein,mitochondrial reactive oxygen species production,content of mitochondrial MDA,activity of aconitase,and mitochondrial potential in liver tissue and ALT and AST in serum in alcohol-induced acute hepatic injury rats after 12week unload swimming training.Results:The acute alcohol treatment induces mitochondrial ROS production,increases mitochondrial MDA content,decreases aconitase activity and mitochondrial potential,up-regulates expressions of BNIP3,NIX and HIF-1αmRNA and content of HIF-1αprotein in liver and increases ALT and AST in serum in alcohol-induced acute hepatic injury rats.The parameters of all above indicate the same change in alcohol-induced acute hepatic injury rats after endurance training but the extent is lower.When rats are injected YC-1(inhibitor of HIF-1),the expressions of BNIP3and NIX mRNA are lower than that of no injection of YC-1in trained and untrained rats,however,there is no change of the expression of HIF-1αmRNA but HIF-1αprotein increases significantly.Conclusion:Acute alcohol treatment enhances mitophagy,which related to HIF-1up-regulated expression,but endurance training can increase liver oxygen supply,and that decreases HIF-1expression,which results in the decrease of mitophagy in liver.
endurancetraining;alcohol-inducedacutehepaticinjury;mitophagy;rat;animalexperiment
1000-677X(2011)10-0085-06
2011-07-16;
2011-09-16
马国栋(1974-),男,山东临沂人,副教授,博士,研究方向为运动与健康促进,Tel:(0533)2786023,E-mail:mgdtj@sina.com;刘艳环(1971-),女,吉林白城人,讲师,硕士,研究方向为运动与健康促进,Tel:(0533)2786023,E-mail:mgdtj@126.com。
山东理工大学体育学院,山东淄博255049 School of Physical Education,Shandong University of Technology,Zibo 255049,China.
G804.3
A
