酸性染料比色法定量检测荷叶总生物碱
2011-12-27邓燕莉罗金波黄甜张玥肖文军
邓燕莉罗金波黄 甜张 玥肖文军,2
(1.湖南农业大学国家植物功能成分工程技术研究中心,湖南 长沙 410128;2.湖南农业大学植物资源工程系,湖南 长沙 410128)
酸性染料比色法定量检测荷叶总生物碱
邓燕莉1罗金波1黄 甜1张 玥1肖文军1,2
(1.湖南农业大学国家植物功能成分工程技术研究中心,湖南 长沙 410128;2.湖南农业大学植物资源工程系,湖南 长沙 410128)
采用均匀设计法,从荷叶生物碱的萃取振荡时间及萃取静置时间的筛选出发,通过对邻苯二甲酸氢钾缓冲液pH值、体积以及溴甲酚绿体积等因子的研究,发现荷叶总生物碱在酸性染料比色法中的最大吸收波长为416nm,萃取振荡时间为60s,萃取静置时间为150min;最佳测定条件为缓冲液pH值2.0,缓冲液体积0.5mL,溴甲酚绿溶液体积1.0mL。同时,得回归方程y=14.12x-0.013,R2=0.999 8(n=5),平均回收率达98.35%,RSD 为 2.11%。验证实验表明,该方法线性关系良好,重复性好,可推广应用。与当前检测方法相比相对简单、快捷、准确。
总生物碱;酸性染料比色法;荷叶;检测
荷叶是睡莲科莲属植物的叶[1]。近年来,对荷叶化学成分的分离工程和药理活性的研究[2]表明,荷叶主要生物活性物质为生物碱。研究[3-5]表明,荷叶生物碱类化合物主要是荷叶碱、O-去甲基荷叶碱、莲碱、去氢莲碱、去氢荷叶碱等,此类化合物具有显著的降脂减肥、抗病毒、抑菌、抗惊厥等药理作用。目前测定荷叶生物碱含量的方法[6]主要有薄层扫描法、高效液相色谱法和紫外分光光度法3种。薄层扫描法[7]和高效液相色谱法[8,9]虽然对荷叶生物碱测定的结果比较精确,但只能测定单一成分的含量,且所需仪器设备昂贵,操作繁琐,大多在科研单位实验室使用,不适宜推广;采用紫外分光光度法[10,11]测定荷叶中的生物碱含量,操作简单、快速、准确,而且所需仪器设备造价不高。
在紫外分光光度法基础上改进的酸性染料比色法近年来应用较多[12],常用其测定总生物碱的含量,灵敏度高,在测定小剂量或样品量较少时有优势,专属性较好;结果较为准确、重复性好、操作简便[13-16];其不足之处在于对试验条件要求较严格,试验操作和条件的稳定性对测定结果影响较大。本试验拟建立酸性染料比色法定量检测荷叶中总生物碱含量的方法,以期建立一种准确、快速检测荷叶总生物碱的含量检测方法。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 试验材料
荷叶:由湖南金农生物资源股份有限公司提供。用微型植物试样粉碎机粉碎后,再用聚乙烯和聚氯乙烯复合膜袋密闭包装,置于干燥器中贮藏,备用。
1.1.2 主要试剂
荷叶碱标准品:批号111566-200402,中国药品生物检定所;
氯仿、乙醇、溴甲酚绿、邻苯二甲酸氢钾:均为分析纯。
1.1.3 试验仪器
微型植物试样粉碎机:FZ102型,天津市泰斯特仪器有限公司;
电子天平:BSA-124S型,德国Sartorius赛多利斯集团;
恒温水浴锅:DHW-600型,北京国华医疗器械厂;
电子调温电热套:98-I-C型,天津市泰斯特仪器有限公司;
紫外可见分光光度计:UV-2550,日本岛津公司;
冷冻干燥机:AIPHR1-2LD,德国Christ公司;
超声波清洗器:KQ-3200型,上海昆山市超声仪器有限公司;
酸度计:PHS-25型,上海精密科学仪器有限公司。
1.2 试验所需溶液的配制
1.2.1 邻苯二甲酸氢钾缓冲液 称取邻苯二甲酸氢钾(110℃下干燥2h)5.10g,加适量的蒸馏水溶解,然后定容至500mL,调节溶液pH值为4.0。
1.2.2 溴甲酚 绿溶液 称取 溴甲酚 绿0.10g,加入7.15mL 0.02mol/L NaOH溶液溶解,蒸馏水定容至250mL。
1.3 试验方法
1.3.1 荷叶生物碱最大吸收波长的确定
(1)荷叶碱标准品的最大吸收波长:称取4.15mg荷叶碱标准品于10mL容量瓶中,用氯仿溶解定容,以氯仿为空白,用紫外分光光度计在190~800nm下扫描,测得荷叶碱的紫外最大吸收波长。
(2)荷叶生物碱经溴甲酚绿染色后的最大吸收波长:
①荷叶碱标准品染色后的最大吸收波长。精密称取4.15mg荷叶碱标准品于10mL容量瓶中,用氯仿定容,混匀,吸取1mL于10mL分液漏斗中,加入邻苯二甲酸氢钾缓冲液1mL,溴甲酚绿溶液1mL,振荡,加入5mL氯仿,振荡30s,静置30min。取下层氯仿液4mL,以标准品空白为对照,在紫外分光光度计的190~800nm下扫描,测得荷叶碱标准品经溴甲酚绿染色后的最大吸收波长。
②样品经溴甲酚绿染色后的最大吸收波长。称取荷叶2.0g,加入浓度为80%的乙醇80mL,于80℃ 的恒温水浴回流提取。趁热过滤,用80%乙醇定容至80mL,即为样品液。吸取1mL样品液于10mL分液漏斗中,挥去乙醇,加入邻苯二甲酸氢钾缓冲液1mL,溴甲酚绿溶液1mL,振荡,加入5mL氯仿,振荡30s,静置30min。取下层氯仿液4mL,以未加样品液的试剂空白为对照,在紫外分光光度计的190~800nm下扫描,测出样品液经溴甲酚绿染色后的最大吸收波长。
1.3.2 荷叶总生物碱萃取条件的优化
(1)萃取振荡时间筛选:参照1.3.1②方法,设计振荡时间为30,60,90s,在已确定的最大吸收波长下比色,筛选最佳萃取振荡时间。
(2)萃取静置时间筛选:参照1.3.1②方法,在已确定的振荡时间基础上,设计静置时间分别为30,60,90,120,150,180,210min,根据结果筛选出最佳静置时间。
1.3.3 荷叶总生物碱含量测定方法的建立
(1)均匀设计试验因素及水平的设定:根据预试验结果,采用均匀设计U10(108)表,研究邻苯二甲酸氢钾缓冲液pH值、体积及溴甲酚绿溶液体积3个主要因素的10个水平(见表1)对荷叶总生物碱含量测定的影响。
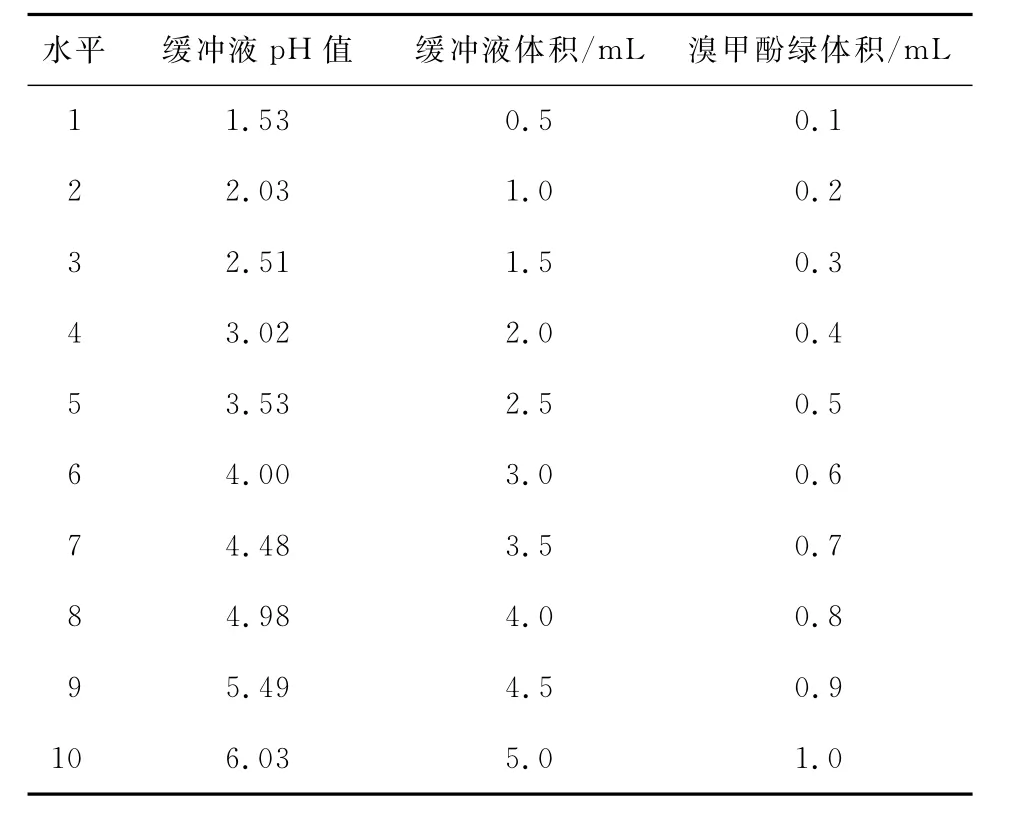
表1 均匀设计试验因素及水平表Table 1 The factors and levers of uniform design
(2)测定方法条件的优化:在试验得出的较优条件上,应用均匀设计软件对其进行优化,得到最佳荷叶总生物碱的含量测定条件。
(3)验证实验:参照1.3.1②的方法,以试验得出的最佳含量测定条件操作,对测定方法的重复性进行考察。
(4)线性关系的考察:参照1.3.1①的方法,分别精密吸取荷叶碱标准品溶液0.05,0.10,0.15,0.20,0.25mL于5mL容量瓶中,氯仿定容,以试验得出的最佳含量测定条件操作,以试剂空白为参比液,在最大吸收波长处测定吸光度,制作标准曲线。
(5)加样回收率的测定:称取已知生物碱含量(0.85%)的同批荷叶2.0g,共5份,分别精密加入荷叶碱标准品溶液(浓度为0.415mg/mL)各1mL,分别加入浓度为80%乙醇80mL,在80℃下的恒温水浴冷凝回流提取。趁热过滤,用80%乙醇定容至80mL,即为样品液。吸取1mL样品液按最佳含量测定条件操作,计算生物碱含量,分析加样回收率。
2 结果与分析
2.1 荷叶生物碱最大吸收波长的确定
荷叶碱标准品、经溴甲酚绿染色后荷叶碱标准品及染色后的样品液的全波长扫描图分别见图1~3。由图1~3可知,荷叶碱标准品的紫外最大吸收波长为273nm,而经溴甲酚绿染色后的荷叶碱标准品和样品均在416nm处有最大吸收波长,故本试验以416nm为含量测定的最大吸收波长。
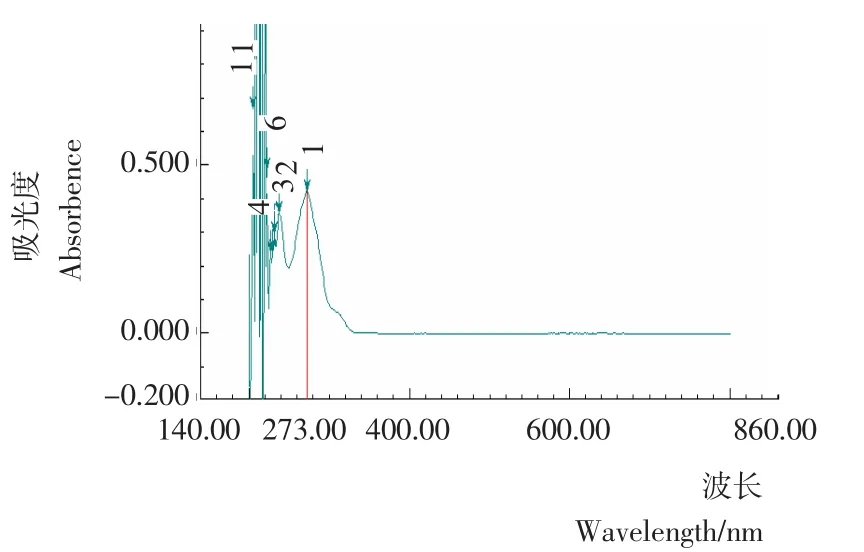
图1 荷叶碱标准品全波长光谱图Figure 1 The full spectrum of standard nuciferine
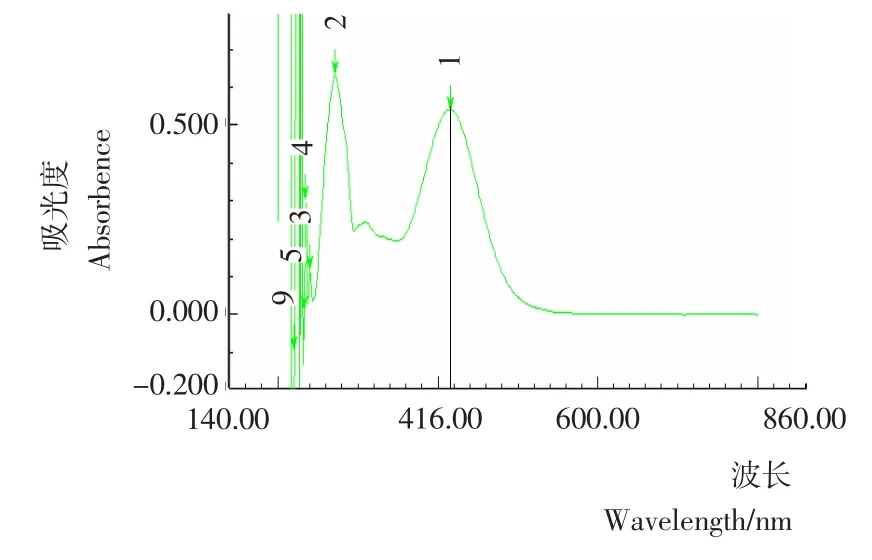
图2 染色后荷叶碱标准品全波长光谱图Figure 2 The full spectrum of tinct standard nuciferine
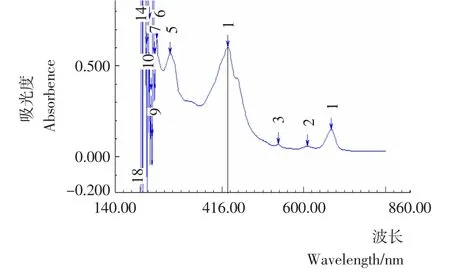
图3 染色后荷叶碱样品全波长光谱图Figure 3 The full spectrum of tinct nuciferine sample
2.2 荷叶总生物碱萃取条件的优化
2.2.1 萃取振荡时间筛选 不同振荡时间的萃取结果见表2。由表2可知,随着振荡时间的增加,萃取液的吸光度上升,但振荡60s的吸光度最稳定,RSD=1.86%(n=5)。所以试验选择萃取振荡的时间为60s。
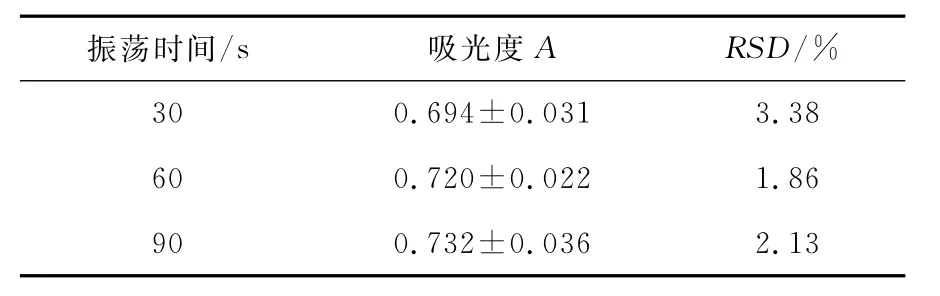
表2 振荡时间对萃取液吸光度及稳定性的影响Table 2 Effects of absorbence and stability on different surge time(n=5)
2.2.2 萃取静置时间筛选 静置时间对萃取液吸光度及稳定性的影响见表3。由表3可知,静置时间在120~210min范围内时荷叶生物碱与溴甲酚绿形成的有机络合物平均RSD为0.28%,稳定性较好,故选择静置时间为150min。
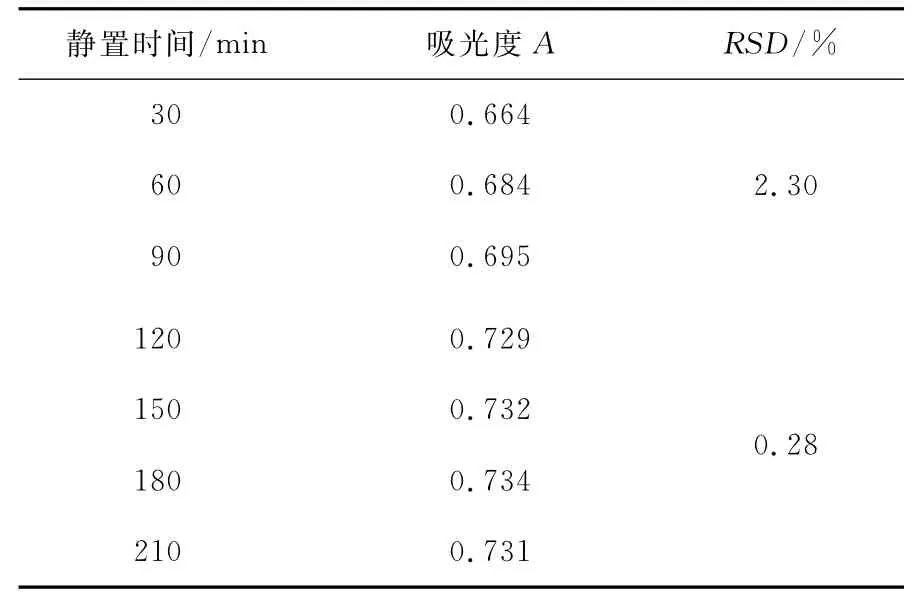
表3 静置时间对萃取液吸光度及稳定性的影响Table 3 Effects of absorbence and stability on different stillness time
2.3 酸性染料比色法定量检测荷叶生物碱的方法
2.3.1 均匀设计因素及水平的主次大小 酸性染料比色法定量检测荷叶生物碱均匀设计试验结果见表4。将试验结果采用均匀设计软件全回归分析法,拟建立回归方程,样本容量N=10,显著性水平α=0.05,得检验值Ft=24.23,临界值F(0.05,3,6)= 4.757,Ft>F(0.05,3,6),剩余标准差s=6.92,回归方程显著。

表4 酸性染料比色法定量检测荷叶生物碱均匀设计试验结果Table 4 Results of determination of total alkaloid in lotus leaf byacid dye colorimetry application uniform design experiment
由试验结果分析可知,在酸性染料比色法定量检测荷叶总生物碱中,影响荷叶生物碱含量测定主次因素的大小依次为缓冲液pH值>溴甲酚绿用量>缓冲液用量。
2.3.2 荷叶总生物碱含量测定方法的优化 根据试验结果,应用网格尝试法对试验进行优化,得缓冲液pH值为1.53,缓冲液体积为0.5mL,溴甲酚绿溶液体积为1.0mL。由于实验室常用的缓冲液pH值通常不小于2.0,所以本试验选定缓冲液的pH值为2.0。将已优化的条件:缓冲液pH值2.0,缓冲液体积0.5mL,溴甲酚绿溶液体积1.0mL进行微机分析,预报试验结果表明理论上的吸光度可达0.692±0.080 4,充分达到含量测定的响应要求。
2.3.3 含量测定优化方法的验证 按均匀设计试验得到的最佳含量测定条件进行验证实验。得到的实验平均吸光度值为0.702,RSD值为1.58%(n=5),处于2.3.2项中测定的置信区间[0.692±0.080 4]内,证明优选的含量测定条件是准确可信的。
2.3.4 线性关系的考察 不同浓度的荷叶碱标准品溶液在416nm处的吸光值标准曲线见图4,得回归方程y=14.12x-0.013,R2=0.999 8(n=5),表明荷叶碱在20~100μg/mL范围内线性关系良好。
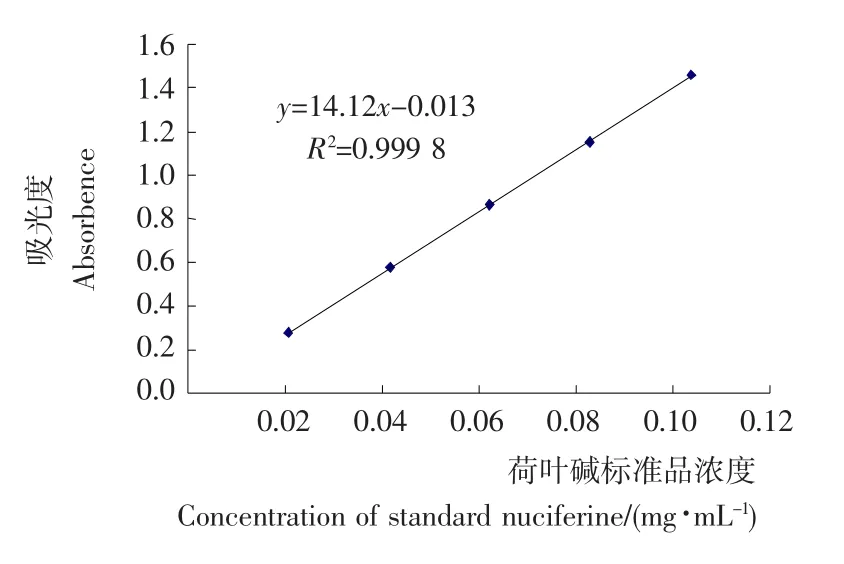
图4 荷叶碱标准品标准曲线Figure 4 The standard curve of standard nuciferine
2.3.5 加样回收率测定 样品的加样回收试验结果见表5,可见本优化工艺下的平均回收率达98.35%,RSD为2.11%,证明应用酸性染料比色法定量检测荷叶生物碱的方法科学可行。
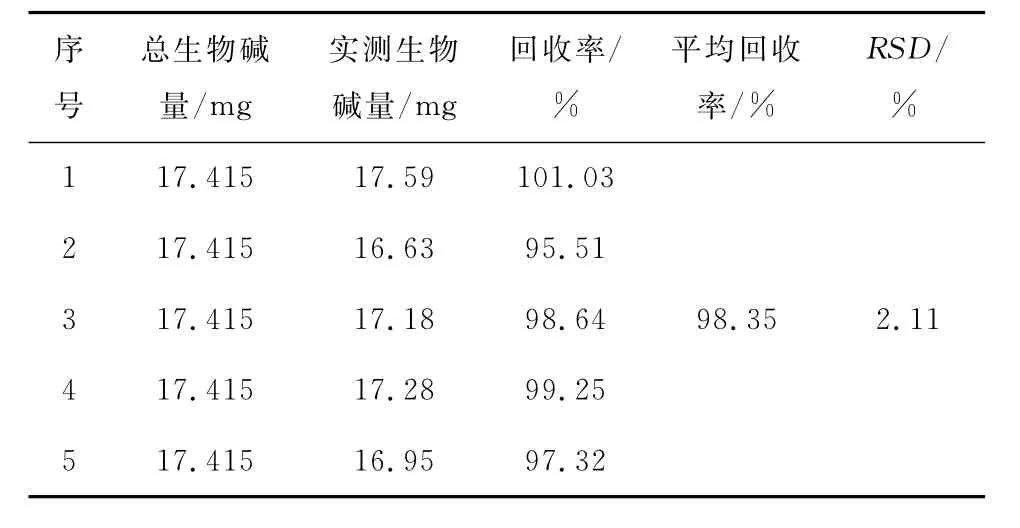
表5 加样回收率结果Table 5 The results of recovery with application of sample
3 结束语
在酸性染料比色法中,pH值是影响测定准确性的最重要因素。只有选择合适的pH值使生物碱能够与氢离子完全结合成阳离子,才能保证定量测定。本试验在选择pH值时,以荷叶碱标准品溶液在pH值为4.0的条件下进行测定,发现其在416nm处的吸光值低于0.2,灵敏度不高,这可能是由于pH值偏高,荷叶碱没有完全形成阳离子的缘故。
在比色过程中,应严禁水分混入有机溶剂中,因为:水相中有过量的有色染料,会影响测定结果;水的混入使有机溶剂混浊,影响比色,故必要时应加入脱水剂(如无水硫酸钠)或经滤纸过滤除去。本试验在测定荷叶生物碱时,为防止水分进入氯仿层,仅取分液漏斗下层5mL有机相中的4mL进行测定,有效的控制了水分对测定的影响。
本试验所设计的方法与目前测定荷叶生物碱含量的方法[6-9]相比,回归方程为y=14.12x-0.013,R2=0.999 8(n=5),平均回收率达98.35%,RSD为2.11%,表明荷叶生物碱在20~100μg/mL范围内线性关系良好,重复性好,稳定性好,具有严谨性,可推广应用。
1 金波.花卉宝典[M].北京:中国农业出版社,2005:36~37.
2 肖桂青,卢向阳,田云,等.荷叶中生物碱类成分的研究进展[J].化学与生物工程,2006,23(5):1~2.
3 钟先锋,黄桂东.荷叶成分及功能的研究进展[J].食品与机械,2006,22(4):138~144.
4 雷红松,肖文军,魏勇.荷叶生物碱的研究进展[J].吉首大学学报,2007,28(5):92~94.
5 刘淑萍,樊淑彦,侯海妮,等.荷叶化学成分及药理作用研究进展[J].河北医科大学学报,2004,25(4):254~256.
6 王伟,谭晓梅.荷叶总生物碱含量测定方法的研究[J].中药材,2004,27(1):50~51.
7 邬晓鸥,熊英.薄层扫描法测定荷叶中荷叶碱的含量[J].中国药师,2004,7(4):262~264.
8 柴金玲,李伟,谷学新.高效液相色谱法测定荷叶中荷叶碱的含量[J].药物分析杂志,2005,25(8):932~934.
9 陈波,罗旭彪,姚守拙,等.高效液相色谱—质谱联用法测定保健食品中荷叶碱的含量[J].中国食品卫生杂志,2005,17(5):420~421.
10 Yu Chao,Zhang Ming.Determination of the alkaloids in pinellia ternate(thunb.)breit from varied areas by UV absorption spectroscopy[J].National Cure and Medicine of Shizhen,2002,13(2):73~75.
11 韩枫,闫永波,赫玉霞,等.紫外分光光度法测定盐酸苯海拉明乳膏中盐酸苯海拉明的含量[J].中国医院药学杂志,2007,27(12):1 787~1 788.
12 刘喜纲,刘翠哲,常金花.应用酸性染料比色法测定总生物碱的含量[J].中国药房,2007,18(11):875~876.
13 萨仁格日乐,陈红梅.酸性染料比色法测定呼和嘎日迪-9总乌头碱含量[J].中国民族医药杂志,2007,27(12):55~56.
14 龙盛京,陈瑶,彭兴.酸性染料比色法测定两面针药材总生物碱的含量[J].食品科学,2007,28(11):443~445.
15 凌育赵,杨妙贤.酸性染料比色法测定虎舌红中总生物碱的含量[J].时珍国医国药,2007,18(7):1 597~1 598.
16 漆小梅,陈志果,陈柏年,等.酸性染料比色法测定槲寄生总生物碱的含量[J].山西医科大学学报,2006,37(4):384~385.
Definite determination of total alkaloids in lotus by acid dye colorimetry
DENG Yan-li1LUO Jin-bo1HUANG Tian1ZHANG Yue1XIAO Wen-jun1,2
(1.National Research Center of Engineering and Technology for Utilization of Botanical Functional Ingredients,Hunan Agricultural University,Changsha,Hunan410128,China;2.Plant Resource Engineering Department of Hunan Agriculture University,Changsha,Hunan410128,China)
Several factors were studied including extraction time and standing time,pH value and dosage of the potassium acid phthalate buffer solution,volume of bromcresol green and so on factors by using uniform design method.The result showed that the maximum absorptive wavelength of total alkaloids of Lotus leaf was 416nm by acid dye colorimetry,extracting time was 60s,standing time was 150min.And the optimum conditions of definite determination of total alkaloids in Lotus were:pH value of buffer solution 2.0,volume of buffer solution 0.5mL,dosage of bromcresol green 1.0mL.Simultaneously,the regression equationy= 14.12x-0.013,R2=0.999 8(n=5),average recovery rate 98.35%,RSD 2.11%.The method has good linear relationship,reproducibility,and popularization and application.And the method was much easier,faster and more accurate.
total alkaloids;acid dye colorimetry;lotus leaf;detection
10.3969 /j.issn.1003-5788.2011.04.025
国家科技部APEC基金项目(编号:200602);湖南省科技重点项目(编号:2005WK2002)
邓燕莉(1985-),女,湖南农业大学在读硕士研究生。E-mail:dengyanli2011@sina.com
肖文军
2011-04-10
