花药培养过程中的灭菌与消毒
2011-12-25王裔娜
王裔娜
(河南农业大学园艺学院,河南郑州 450002)
花药培养过程中的灭菌与消毒
王裔娜
(河南农业大学园艺学院,河南郑州 450002)
利用植物组织培养技术对花药进行组织培养,结合实验操作经验,总结了培养基、无菌室和超净工作台的灭菌方法,论述了工具器皿的消毒过程,分析了花药的预处理与消毒方法,给出了常用消毒剂的使用方法.
花药;培养;灭菌;消毒;温度
0 引言
植物组织培养是根据植物细胞具有全能性的理论,在无菌条件下,将离体的植物根尖、茎尖、组织、细胞、胚胎、原生质体、悬浮细胞等在人工配制的培养基上培养,给予适宜的培养条件,诱发其产生愈伤组织或潜伏芽或长成完整的植株的技术.植物组织培养也称离体培养或试管培养.
花是被子植物特有的有性生殖器官,在花中形成有性生殖过程中的雌、雄生殖细胞,以繁衍后代,延续种族,而花药则是雄蕊的重要组成部分.从结构上看,花药是由药壁、药隔、花粉囊和花粉粒组成.花药培养是指将完整的花药接种到培养基上,诱导形成单倍体再生植株的方法.花药是几乎所有植物器官中很好的无毒部分,因此是进行选育优良单倍体植株或获得纯系育种材料的最佳选择.
花药培养的主要目的是进行单倍体育种,缩短育种年限和提高育种效率及获得纯系育种材料.在育种领域中,花药培养育种已与常规杂交育种、远缘杂交育种、诱变育种以及转基因技术相结合,是生物技术在农作物育种中应用最广泛、最有成效的方法之一.但是在花药培养过程中,如果控制不好,污染是经常发生的.灭菌和消毒是一个关键环节,这个关键环节出现失误或者操作不当就会造成花药培养失败,前功尽弃.
1 花药培养基的灭菌
由于花药培养基在制备过程中带有各种杂菌,所以微生物污染开始就在培养基中存在.分装后的培养基应立即灭菌,至少应该在24 h之内完成灭菌工作,常规方法是采用高压蒸汽灭菌锅灭菌.
1.1 理论灭菌时间的确定
微生物的湿热灭菌过程,其本质上就是微生物细胞内蛋白质的变性过程,从这个意义上讲,灭菌过程应遵循单分子反应的速度理论[1],即满足方程

式中,N表示残存的活菌数,t表示灭菌时间,K表示灭菌速度常数,也称反应速度常数,此常数的大小与微生物的种类与加热温度有关,dN/dt表示活菌数瞬时变化速率,即死亡速率.该方程称为对数残存定律,表示微生物的死亡速率与任一瞬时残存的活菌数成正比.
将(1)式积分,转换得

其中,K表示灭菌速度常数,t表示理论灭菌时间,Nt是经时间t后残存的活菌数,N0是t=0时原有活菌数.
在计算理论灭菌时间时首先要注意K值与微生物种类、生理状态、外界环境等有关系,即K是微生物热阻的一种表示形式,微生物的热阻越大,K值越小.其次N0可以参考一般培养基中的活微生物数为(1-2)× 107个/mL,Nt通常取0.001个,即灭菌失败的概率为1/1 000.最后,理论灭菌时间只可以用于工程计算中,在实践过程中,因蒸汽的压力不稳定、蒸汽的流量大小等很多因素影响使得理论灭菌时间与实际灭菌时间有很大差别.可结合经验数值做适当调整.
1.2 灭菌温度的选择
在花药培养基灭菌过程中,除了杂菌死亡,还伴随着花药培养基成分的破坏.因此必须选择既能达到灭菌目的,又能使花药培养基的破坏降至最低的温度.
首先,由于微生物的受热死亡属于单分子反应,根据文献[2],其灭菌速度常数K与温度之间的关系可用阿累尼乌斯公式表示:

其中T表示绝对温度,A表示频率常数,也称阿累尼乌斯常数,E表示微生物死亡活化能,R是气体常数.E/R表示了微生物受热死亡时对温度敏感性的度量,它是加热灭菌操作中十分重要的参数.当E与R比值增大时,微生物死亡速率就会随温度的变化而敏感度增加;反之,敏感度降低.
其次,根据文献[3],当灭菌温度从T1上升到T2时,灭菌的反应速度常数K值和营养成分分解的反应速度常数K'分别从K1、K'1变化到K2、K'2.若用E和E'分别表示杀死微生物的活化能和营养成分的活化能,那么由阿累尼乌斯公式可得
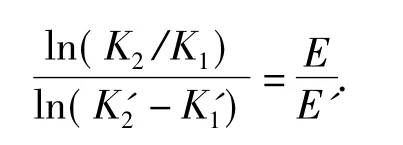
由于杀死微生物的活化能E大于营养成分的活化能E',所以随温度的升高,灭菌反应速度常数增加的倍数大于营养成分破坏反应速度常数增加的倍数.虽然随着灭菌温度上升,微生物死亡的速率会提高,培养基成分的破坏速率也会增加,但是微生物死亡的速率增加度会超过培养基成分的破坏速率增加度.因此,采用高温快速灭菌方法,不仅可杀死培养基中的全部有生命的有机体,而且可减少营养成分的破坏.
具体的方法是,把已装入花药培养基的培养容器直接装入内锅,上面盖几张报纸吸湿.接通电源升温后,首先要排净锅内冷空气,然后在121℃(1.06 kg/cm2或0.105 MPa)下灭菌15~20 min,可完全杀死物品内外的微生物、芽孢和孢子.
2 工具器皿的消毒
植物组织培养的主要过程都是在无菌条件下进行的,在培养过程中所用到的工具器皿,如花药培养基、花药培养瓶、操作工具器械等都必须防止和消除细菌、真菌、藻类及其他微生物的污染,均需消毒处理.
2.1 接种器械和玻璃器皿、塑料器皿的灭菌
对于无菌操作所用的接种器械包括解剖针、解剖刀、枪形镊和扁头小铲等,一般的消毒办法是把它们先在95%酒精中浸一下,然后再置火焰上灼烧片刻,待冷却后使用.这些器械不但在每次操作开始前消毒,在操作期间还要消毒几次.接种器皿在操作过程中,由于直接与外植体接触,所以必须经过严格灭菌后才能使用.玻璃培养容器常常与培养基一起灭菌.若培养基已先灭菌,而只需单独进行容器灭菌时,可采用高压蒸汽灭菌法,也可将它们置于烘箱中在160℃~180℃下干热处理3 h.有些类型的塑料器皿也可进行高温消毒.灭菌方法为:在121℃下反复进行高压蒸汽灭菌,每次灭菌的时间不应超过20 min,然后放在干燥箱内进行干燥.
2.2 蒸馏水和滤纸的灭菌
将不超过瓶2/3的蒸馏水或滤纸分别置于三角瓶中,用棉塞密封瓶口,排放在高压灭菌锅中,加温121℃,灭菌20 min.冷却后即为无菌水,放在超净工作台上备用.
2.3 组培苗和组培瓶的灭菌处理
花药组培瓶内组培苗的污染会导致植物组织培养的失败,凡出现污染的组培苗或外植体一般都不能再用.花药组培瓶内组培苗的污染一般有细菌污染和真菌污染,或者在同一瓶内同时存在细菌污染和真菌污染.通常细菌污染都在接种后2~3 d开始出现,真菌污染在接种后3~5 d出现.清除污染最好的方法是先将外植体连组培瓶进行高压蒸汽灭菌,然后把内部的外植体连同培养基扔掉,再把瓶子刷洗干净备用.
3 无菌操作区及操作人员的消毒与灭菌
3.1 无菌室的消毒和灭菌
组培实验操作必须在无菌操作室进行,紫外辐射是组织培养实验室常用的一种物理杀菌手段,因此,无菌室内一般装备有紫外消毒灯.无菌室的消毒要在接种前一天的晚上将紫外灯打开,消毒12 h后关闭,即可使用.
3.2 超净工作台的消毒和灭菌
超净工作台又称洁净工作台,是组织培养实验的关键设备.在超净工作台中进行操作是最容易感染细菌等污染物的时候,如有不慎就会导致实验失败,甚至造成一定的经济损失,因此对超净工作台的消毒和之后进行操作的过程中都要注意避免污染.组培操作前,用酒精棉球将工作台仔细擦拭两遍,尤其是洁净工作台的接口处一定要反复擦拭,操作人员的双手和两臂必须彻底洗净,而且千万不要让手和手臂越过敞着口的无菌容器的上方,防止细菌、手部死皮等污染物掉进容器里.所有敞口的无菌表面都尽可能放在超净台的远后方.打开台内紫外灯15~30 min,然后关掉紫外灯并打开超净工作台风机,20 min后即可进行实验操作.紫外辐射同样伤害皮肤,所以在没有采取保护措施的条件下,不要把手伸入开着紫外灯的超净台内.
在植物组培操作过程中,超净工作台的风机要始终打开,形成无尘无菌的工作环境.此外,在每次操作之前,要把实验材料和在操作中必须使用的各种器械、药品等先放入台内,不要中途拿进,同时,台面上放置的东西不宜太多,特别注意不要在迎面堆得太高,以致挡住气流.
3.3 接种工作者自身的消毒与灭菌
接种工作者自身的消毒与灭菌分为三个内容,首先是工作人员的工作服和工作帽的消毒,方法是经过紫外线照射25 min以上,这样才能达到无菌的程度;其次是实验前要用肥皂洗手,把手掌和手臂一起洗干净,穿好工作服戴好帽子;最后是进入超净工作台后要用70%~75%酒精擦拭双手.
需要注意的是,在灭菌过程中如果粗心大意,防护不当,有可能造成健康损伤.如次氯酸钠是一种常用的化学消毒剂,接触皮肤会造成伤害,若是在开着紫外灯的情况下使用次氯酸钠,由于这时次氯酸钠会释放出游离氯气,更会严重损害健康.
4 花药的预处理与消毒
从自然界和室内采集的植物器官和组织材料一般都带有各种微生物,这些污染源一旦进入培养瓶中,会造成培养基和培养材料污染.因此在花药组织培养中,无菌的外植体材料是取得植物组织培养成功的最基本的前提和根本保证,也是组织培养的一大障碍.因此在材料接种培养前必须消毒处理,消毒一方面要求把材料表面上的各种微生物杀灭,同时又不能损伤或只轻微损伤组织材料而不影响其生长.
4.1 花药的预处理
适当的预处理可以显著提高花药的愈伤组织诱导率.常用的预处理方法是低温冷藏,具体的处理温度和时间长度因物种而异.但低温预处理对小麦效果不稳定,有时还有负效果.
4.2 花药的消毒
通常用于组织培养的花药,按小孢子发育时期要求,实际上大多没有成熟,花药外面有萼片、花瓣或颖片、稃片保护着,基本上处于无菌状态.但是如果出现附着其上的微生物等污染情况,由于花药被包在花被里面,很难将其彻底消除,也不容易控制花药的消毒时间,为此,我们对此进行研究,取得了较好的效果.
4.2.1 花药消毒的步骤
①选好所需要的一种或几种消毒剂,如70%酒精、0.5%新洁尔灭、1%次氯酸钠等,放好待用;②去除花萼,滴入少许洗洁精,用自来水冲洗2~4 h;③在无菌条件下,用70%酒精表面消毒30 s后,再用不同消毒剂继续消毒;④用无菌水清洗4~5次;⑤无菌试纸吸干花蕾表面水分后,剥掉花瓣取下花药,立即接种于无菌培养基上;⑥在温度为25℃的培养箱中进行暗培养,每隔3~5 d观察记录一次,直到结果不再变化为止.
4.2.2 常用的消毒剂
理想的消毒剂的标准是应具有消毒效果好易被无菌水冲洗掉或能自行分解,对材料损伤小,对人体及其他生物无害,来源广泛,价格低廉.以下列举几种常用消毒剂[4].
①升汞.又称氯化汞,Hg2+可以与带负电荷的蛋白质结合,使蛋白质变性,从而杀死菌体.升汞的消毒效果极佳,但其渗透性过强,易在植物材料上残留,对环境危害大,对人畜的毒性极强.
②酒精.酒精是最常用的表面消毒剂,但是不同浓度的酒精杀菌效果差别很大,10%~20%的酒精无杀菌作用,70%~75%酒精杀菌效果最好,95%~100%的酒精会使菌体表面的蛋白质凝固,形成一层保护膜,阻止了酒精的继续渗入,杀菌效果大大降低.
酒精具有较强的穿透力,使菌体蛋白质变性,杀菌效果好.同时它还具有较强的湿润作用,可排除材料上的空气,利于其他消毒剂的渗入.但酒精对植物材料的杀伤作用也很大,浸泡时间不宜过长,并且酒精不能彻底消毒,一般不单独使用,多与其他消毒剂配合使用.
③次氯酸钠.次氯酸钠是一种较好的消毒剂,它可以释放出活性氯离子,从而杀死菌体.其消毒能力强,不易残留,对环境无害.但次氯酸钠溶液碱性很强,对植物材料也有一定的破坏作用.
④漂白粉.漂白粉的有效成分是Ca(ClO)2,消毒效果很好,对环境无害.它易吸潮散失有效氯而失效,故要密封保藏.
⑤过氧化氢.也称双氧水,消毒效果好,易清除,又不会损伤外植体,常用于叶片的消毒.
⑥新洁尔灭.这是一种广谱表面活性消毒剂,对绝大多数植物外植体伤害很小,杀菌效果好.
5 结论
灭菌与消毒是防止微生物污染的最基本的环节,是花药组织培养技术中一项重要的工作[5].花药组培过程中,针对不同的物品要采用不同的灭菌和消毒的方法.培养基用常压或高压蒸煮等湿热灭菌、器械采用灼烧灭菌、玻璃器皿及耐热用具采用干热灭菌、不耐热的物质采用过滤灭菌、植物材料表面用消毒剂灭菌、物体表面用药剂喷雾灭菌、接种室等空间采用紫外线或熏蒸灭菌.
[1]熊宗贵.发酵工艺原理[M].北京:中国医药科技出版社,2001:82-98.
[2]赵德胜,韩文清,张明斗.培养基灭菌温度与时间的选择[J].价值工程,2010(5):205-206.
[3]高平,刘书志.生物工程设备[M].北京:化学工业出版社,2006:180-220.
[4]陈建华,王玲,尹桂芳,等.影响魔芋花药培养褐变因素研究[J].西南农业学报,2010,23(2):458-461.
[5]庞海峰,王平,姜策.矮牵牛花药培养的研究[J].北方园艺,2007(5):196-197.
Disinfection and Sterilization in Anther Cultivation Progress
WANG Yi-na
(Institute of Horticulture,Henan Agricultural University,Zhengzhou 450002,China)
By application of plant tissue cultivation technology on cultivation of anther tissue,and combining operation experience,summarizes sterilization method of media,sterile room and ultra clean bench.The sterilization process of vessels and tools is discussed.Furthermore,analyzes method of anther pretreatment and its disinfection,and shows usage of common disinfectants.
anther;cultivation;sterilization;disinfection;temperature
Q944.6
A
1007-0834(2011)03-0047-04
10.3969/j.issn.1007-0834.2011.03.016
2011-04-25
王裔娜(1989—),女,河南郑州人,河南农业大学园艺学院.
