心得安对ICR小鼠吗啡诱导的条件化位置偏爱记忆获得和提取的影响
2011-12-25杨上川马原野胡新天
毛 羽, 杨上川, 刘 畅, 马原野, 胡新天
(1. 中国科学院昆明动物研究所, 云南 昆明 650223; 2. 中国科学院生物物理研究所 脑与认知国家重点实验室, 北京 100011; 3. 中国科学院研究生院, 北京 100049)
心得安对ICR小鼠吗啡诱导的条件化位置偏爱记忆获得和提取的影响
毛 羽1,3,#, 杨上川1,#, 刘 畅1,3, 马原野1,2,*, 胡新天1,2,*
(1.中国科学院昆明动物研究所,云南 昆明650223; 2.中国科学院生物物理研究所 脑与认知国家重点实验室,北京100011; 3.中国科学院研究生院,北京100049)
利用心得安阻断β-肾上腺素受体(β-受体), 从而干扰药物成瘾患者对药物环境线索记忆的某些环节(如再巩固等), 进而降低或抑制其对成瘾药物的渴求, 已成为未来治疗复吸的潜在途径。但目前, 心得安对吗啡相关环境线索记忆的获得及提取的影响尚不清楚。因此, 该实验检测了心得安对小鼠吗啡诱导的条件化位置偏爱(conditioned place preference, CPP) 环境线索记忆的获得和提取的影响。该研究首次发现在吗啡CPP记忆的获得期,心得安不影响CPP的表达和消退, 提示β-受体不参与吗啡诱导CPP学习记忆的获得; 而在吗啡CPP记忆的提取期, 心得安可延缓CPP的消退, 提示β-受体与吗啡诱导CPP学习记忆的提取相关。该结果表明,药物成瘾过程与β-受体相关, 为成瘾等精神疾病的治疗提供了新的理论依据。
β-肾上腺素受体; 记忆; 获得; 提取; 阿片类物质; 条件化位置偏爱
记忆的形成包括信息的获得(acquisition)、巩固(consolidation)、维持(retention)、提取(retrieval)、再巩固(reconsolidation)、执行(performance)和消退(extinction)(Abel & Lattal, 2001)。成瘾(或奖赏性)药物与环境线索的建立和保持是学习记忆的过程, 其联合可在脑内建立条件化联系。通过干扰记忆形成过程中的某些环节来影响记忆的建立(或强化消退)可减弱或消除吸毒者对药物的心理渴求及复吸的行为, 这是研究防治药物成瘾及其它精神障碍的新思路, 已成为近几年来的研究焦点(Bernardi et al, 2009; Fricks-Gleason & Marshall, 2011)。
条件化位置偏爱(conditioned place preference, CPP) 模型通过建立奖赏性药物(非条件刺激)联合中性环境线索(条件刺激)的条件化记忆, 在药物撤除后利用环境线索诱发动物对药物的强烈心理渴求和觅药行为(Childress et al, 1988)。基于该动物模型工具的有效性, CPP已被广泛地用于成瘾记忆研究(Huffman, 1989; Tzschentke, 1998)。
研究发现, 将非选择性去甲肾上腺素(norepinephrine, NE) β-受体(包括β1和β2)拮抗剂心得安(普萘洛尔, propranolol, PRO)用于听觉条件化恐惧记忆(conditioned fear memory)动物模型和创伤后应激障碍(posttraumatic stress disorder, PTSD)患者, 可干扰其恐惧记忆的再巩固, 即强化恐惧记忆的消退(Vaiva et al, 2003; Debiec & LeDoux, 2004; Mueller & Cahill, 2010)。此外, 可卡因(cocaine)、酒精(ethanol)及吗啡(morphine)诱导的CPP模型也表明, 心得安可通过干扰或阻断成瘾药物相关线索记忆的再巩固来减弱动物对药物的心理渴求和觅药行为(Bernardi et al, 2006; Robinson & Franklin, 2007; Fricks-Gleason & Marshall, 2008)。
由于现有的报道局限在心得安对阿片类物质(opioid)成瘾记忆再巩固的调节上, 至于心得安是否影响记忆的其它环节(如获得和提取等)并不清楚,而明确该问题对于成瘾记忆的研究十分关键。因此,该实验在小鼠CPP模型中, 通过检测CPP的表达和消退研究心得安对吗啡诱导的环境线索相关记忆的获得及提取的影响, 以探讨β-受体在建立成瘾药物相关记忆过程各环节中的作用, 为降低药物成瘾戒断者的复吸率提供理论依据。
1 材料和方法
1.1 实验动物
三十六只雄性ICR小鼠, 体重18~22 g(购自昆明医学院实验动物中心), 在标准条件下饲养。动物自由进食饮水、标准室温、12 h光照/黑暗交替(光照时间从8:00~20:00)。所有动物实验开始前在实验室适应至少一周。
1.2 药品
盐酸吗啡注射液 (10 mg/mL·瓶, 产品批号:070802)购于沈阳第一制药厂, 给药剂量为10 mg/kg体重(i. p.); 盐酸心得安 (用0.9%生理盐水配制至2 mg/mL) 购于Sigma公司, 给药剂量为10 mg/kg体重(i. p.)。
1.3 行为学方法
1.3.1 CPP行为箱 CPP行为箱由位于两端的尺寸大小相同的两个条件化箱(30 cm × 30 cm × 35 cm)和一个中间过渡箱(35 cm × 15 cm × 35 cm)构成。两个条件化箱触觉和视觉均不同, 分别为“黑白相间的纵条纹墙壁+粗糙的橡胶底面”和“黑白相间的横条纹墙壁+光滑的橡胶底面”; 过渡箱为连接两条件化箱的通道, 以灰色的内壁装饰。在两个条件化箱与过渡箱间具有可以灵活开启(关闭)的门。CPP箱被单独放置在安静的房间内, 其上方悬挂的摄像头与连接的电脑录像采集系统监控并记录动物的行为活动。
1.3.2 药物相关CPP模型 该CPP模型的建立分为3个连续的时期:条件化前期(pre-conditioning) (第1~3天)、条件化期 (conditioning)(第4~7天)和条件化后期(post-conditioning)(即检测期, 第8~13天)。
1) 条件化前期:小鼠每天在CPP行为箱内(箱门开启)自由活动15 min(900 s), 以充分熟悉和适应箱内环境, 第3天动物在箱内的行为被记录并进行数据分析。统计小鼠在两个条件化箱中分别停留的总时间(s), 选择小鼠停留时间相对较短的条件化箱为吗啡匹配箱, 另一个即为生理盐水匹配箱, 且分别以小鼠在各行为箱的停留时间作为对应箱的基础偏好值(baseline)。
2) 条件化期:每天早(8:00)晚(20:00)各进行一次条件化训练, 即关闭CPP行为箱门, 小鼠腹腔注射吗啡之后在吗啡匹配箱中停留30 min以建立吗啡条件化; 12 h后该小鼠腹腔注射同体积的生理盐水后放入生理盐水匹配箱中停留30 min建立生理盐水条件化。为了平衡时间节律的影响, 一半的小鼠于清晨建立吗啡条件化, 傍晚建立生理盐水条件化; 另一半则相反。
3) 条件化后期(即检测期):在此期间观察CPP的表达及消退。连续6 d, 小鼠每天在CPP行为箱中(箱门关闭)自由活动15 min(900 s), 其在两条件化箱中分别停留的时间(s)被记录, 且个体检测时间与其在条件化期建立吗啡条件化的时间相匹配。若小鼠在吗啡匹配箱中停留的时间显著高于该箱的基础偏好值, 则认为吗啡诱导的CPP建立。
1.4 实验设计
1.4.1 心得安对吗啡诱导的CPP记忆获得的影响条件化前期结束后, 小鼠被分成两组(每组≥8只),即心得安组和生理盐水组(对照组)。条件化期中间每天在吗啡条件化之前5 min小鼠腹腔注射心得安(10 mg/kg体重, i. p.), 在生理盐水条件化之前5 min对小鼠腹腔注射同体积的生理盐水(i. p.)。条件化期结束之后的第二天开始连续检测6 d。
1.4.2 心得安对吗啡诱导的CPP记忆提取的影响条件化训练结束后, 小鼠被分成两组(每组≥8只),即心得安组和生理盐水组(对照组)。在连续6 d的检测期间, 每天检测开始之前5 min小鼠腹腔注射心得安(10 mg/kg体重, i. p.)或同体积的生理盐水(i. p.)。
1.5 数据分析
所得数据均以CPP值的Mean ±SE表示, 两个组6 d的CPP值采用重复测量ANOVAs分析, 组内每两天的差异采用配对样本t-检验, 组间两两比较采用独立样本t-检验。所有统计工作均由SPSS l3.0统计软件包完成,P<0.05为显著性差异,P<0.01为极显著差异。
2 结 果
2.1 心得安对吗啡诱导CPP记忆的获得无显著影响
在每天建立吗啡环境线索条件化之前5 min,小鼠腹腔注射心得安或生理盐水。检测期发现:两组均能建立CPP(“天”的主效应:F(6,102)=9.382,P=0.000), 且两组间CPP的表达和消退无差异(“天”与“药物”之间无交互作用:F(6,102)=1.368,P=0.235) (图1)。
配对t-检验CPP表达情况:生理盐水组(对照组,n=10) CPP表达在检测期第1(P=0.001)、2(P=0.008)、3(P=0.006)、4(P=0.001)、5(P=0.022)天,达到显著或极显著水平, 第6天消退(图1), 即对照组CPP呈现正常的表达与消退; 心得安组(n=9) CPP表达在检测期第1(P=0.001)、2(P=0.017)、3(P=0.026)、6(P=0.014)天,达到显著或极显著水平,表明CPP基本在整个检测期间均表达(图1); 但心得安组CPP的表达和消退与对照组相比无显著差异。表明心得安对吗啡条件化记忆的获得没有影响,提示β-受体不参与吗啡相关记忆的获得。
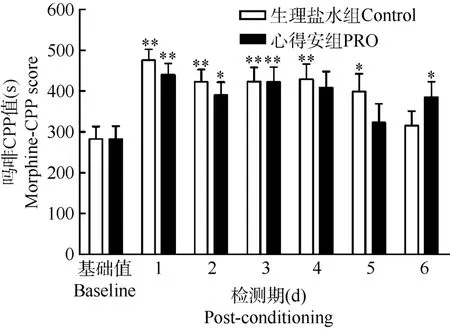
图1 心得安对吗啡诱导CPP记忆获得的效应Fig.1 Effects of PRO on the acquisition of morphineinduced CPP memories
2.2 心得安对吗啡诱导CPP记忆提取的影响
在吗啡条件化之后6 d的CPP检测期间, 于小鼠每天检测之前5min腹腔注射心得安或生理盐水。结果发现, 第1天两组CPP的表达无差异(“天”的主效应:F(6,90)=3.02,P=0.005); 但之后各天两组的CPP表达(消退)情况则具有显著差异(“天”和“组”之间有交互作用:F(6,90)=2.26,P=0.045; 组间效应为:F(1,15)=136.671,P=0.000)。
配对t-检验表明检测期第1天对照组的CPP值与基础值相比有显著差异(配对t-检验,P=0.015),存在CPP表达; 但检测期第2、3、4、5、6天均无显著差异, 即CPP从检测期第2天开始出现消退(图2)。该结果显示与CPP记忆获得期盐水对照组小鼠的成绩比较, 虽然CPP记忆提取期盐水组小鼠的CPP表达和消退均存在, 但CPP的表达天数减少,且消退出现时间提前而持久, 即整个记忆模式显示迅速消退的特点。
心得安组在第1(P=0.009)、2(P=0.028)、3(P= 0.013)、4(P=0.010)、6 (P=0.020)天的CPP值均显著高于基础偏好值, 即几乎整个检测期间都存在CPP的表达; 第1天的CPP值与对照组相比无显著差异;而在检测期第3(P=0.019)、6(P=0.018)天,显著高于对照组。即CPP记忆提取期心得安组小鼠CPP消退出现的时间(第5天)较对照组滞后(第2天), 消退受到了明显的抑制(图2)。该结果表明心得安影响吗啡CPP记忆的提取, 提示β-受体与吗啡CPP记忆提取密切相关。
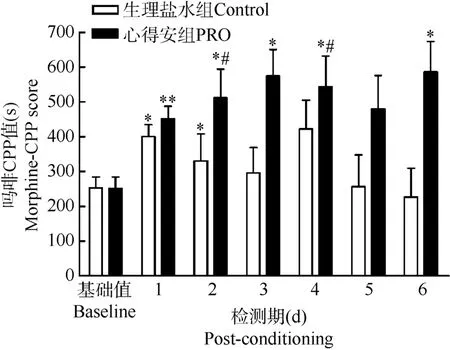
图2 记忆获得期的心得安抑制吗啡诱导的CPP的消退Fig.2 The inhibit effect of PRO during the memory retrieval on morphine-induced CPP
3 讨 论
条件化记忆的消退是一个反复暴露在非强化条件刺激下引起个体条件反应的幅度和频率降低的过程(Maren, 2001)。目前对消退机制有两种解释:一种认为消退并不意味着对原始条件刺激和非条件刺激联合的“反学习(unlearning)”, 它代表了一个新的学习过程或称为消退学习, 即通过建立新的条件化学习记忆来抑制原有记忆的诱发 (Myers & Davis, 2002; Delamater, 2004); 另一解释认为原有记忆本身也在消退(Mao et al, 2006)。
学习记忆在阿片类物质成瘾过程中发挥了重要的作用(White, 1996)。我们早期的工作也发现癫痫持续状态(status epilepticus)可损伤食物CPP的建立但不影响吗啡CPP的建立, 提示阿片类药物成瘾记忆与其它奖赏记忆的神经机制是不同的, 这类记忆在神经通路加工上可能比较特殊(Zhang et al, 2009)。在药物线索记忆的提取前(后)立即给予干涉,在随后的行为学检测中该记忆的表达将改变, 但这种记忆干扰的神经机制尚不十分清楚, 可能是干扰记忆的再巩固或者强化记忆的消退的结果(Fricks-Gleason & Marshall, 2008)。根据消退学习理论, 我们也不排除是通过加强新记忆的建立来抑制旧记忆的过程。有报道认为在可卡因诱导CPP模型中, 记忆提取后注射心得安将影响该记忆的再巩固而非强化其消退 (Fricks-Gleason & Marshall, 2008)。
在吗啡条件化期, 经过吗啡处理的动物被置于药物匹配箱中, 该时期为药物环境线索记忆获得的时间窗, 此学习训练需经历若干次(本研究为4次);检测期, 动物每天暴露在CPP箱子中的时期为该记忆提取的时间窗(本研究为6次)。在这两个时间窗,我们分别对动物进行心得安处理, 并检测各组动物CPP的表达和消退来考察心得安与以上两个记忆环节的关系。在对记忆获得的研究中, 我们发现, 心得安组CPP的表达和消退与对照组比较没有明显差异, 因此心得安不影响记忆的获得; 在记忆的提取方面, 心得安虽然不影响吗啡CPP的表达, 但会以延缓CPP消退出现时间的方式来抑制CPP的消退, 表明心得安影响记忆的提取, 同时提示在该记忆环节中β-受体的活动与吗啡CPP记忆的消退紧密相关。目前, 我们从CPP消退的改变上还不能推断吗啡CPP记忆发生改变的情况, 因为CPP消退的改变可由吗啡条件化记忆相关的多个环节共同参与导致, 例如记忆的再巩固被强化, 或记忆本身的消退被减弱等, 但也不排除两者的协同作用或其它可能的机制。
检测期间对照组小鼠在吗啡撤除初期会更多的趋向吗啡匹配箱, 即CPP表达。伴随检测次数增加, 反复暴露于吗啡缺失的环境线索(条件化刺激)中会导致CPP的消退(Davis et al, 2008; Fricks-Gleason & Marshall, 2008; Wang et al, 2010)。在本研究的记忆获得和提取实验中, 对照组小鼠吗啡CPP的建立及消退均出现, 说明对照组小鼠CPP模型成功建立。但与已有报道的差异在于动物CPP表达和消退的间隔频率、消退出现的时间点以及效应维持的时长等均不同。而且, 在记忆获得和提取实验中, 对照组小鼠CPP表达和消退的模式也不同(图1, 2)。我们推测CPP消退的差异可能与实验的操作程序有关。大量的研究表明,应激或糖皮质激素(Glucocorticoids, GCs)能够强化记忆的获得而干扰记忆的提取 (De Quervain et al,1998; Shors et al,1992)。因此, 本实验中在CPP记忆获得或提取之前注射心得安, 对小鼠进行抓握和注射等应激性刺激可能分别强化或抑制小鼠CPP的消退, 从而引起两个实验对照组小鼠CPP消退的差异。
有研究发现心得安能够干扰吗啡条件化记忆的再巩固,从而加快CPP的消退 (Fricks-Gleason & Marshall, 2008), 而本研究则表明,提取期心得安抑制CPP的消退。研究结果的差异可能是由于提取与再巩固分属两个不同的记忆环节, 均具有各自的生物学基础。此外, 通过之前研究表明,应激和GCs对记忆获得和提取影响的差异(De Quervain et al, 1998; Shors et al,1992), 推测在不同记忆时间窗的β-受体扮演的角色不同可能通过调节调节GCs水平发挥不同的作用, 具体的作用机制尚待深入探讨。
记忆的提取和再巩固环节在时间窗上相距较近(记忆提取之后便发生再巩固), 吗啡条件化记忆的提取期, 心得安抑制CPP的消退令再巩固理论(Bernardi et al, 2009; Robinson & Franklin, 2010)的应用变得更为谨慎。因此, 未来若采用心得安治疗药物成瘾患者, 需要谨慎地鉴别这两个记忆时间窗以避免由于不恰当的用药期(如提取期)而造成的不良后果。总之, 本研究为进一步完善药物成瘾的神经生物学理论机制及成瘾等精神疾病的新型治疗途径的开发提供了新的理论依据。
致谢:感谢孟志强、王建红对本项研究实验目的、设计思路提供建议和指导; 感谢陈艳梅、孙华英对数据分析、结果讨论以及文稿写作提供帮助和指正。
Abel T, Lattal KM. 2001. Molecular mechanisms of memory acquisition, consolidation and retrieval[J]. Curr Opin Neurobiol,11(2): 180-187.
Bernardi RE, Lattal KM, Berger SP. 2006. Postretrieval propranolol disrupts a cocaine conditioned place preference[J]. Neuroreport,17(13): 1443-1447.
Bernardi RE, Ryabinin AE, Paul Berger S, Matthew Lattal K. 2009. Post-retrieval disruption of a cocaine conditioned place preference by systemic and intrabasolateral amygdalaβ2- andα1- adrenergic antagonists[J]. Learn Mem ,16(12): 777-789.
Childress A, Ehrman R, Mclellan AT, O’Brien C. 1988. Conditioned craving and arousal in cocaine addiction: a preliminary report[J]. NIDA Res Monogr,81: 74-80.
Davis AR, Shields AD, Brigman JL, Maxine M, McElligott ZA, Holmes A, Winder DG. 2008. Yohimbine impairs extinction of cocaine-conditioned place preference in anα2- adrenergic receptor independent process[J]. Learn Mem, 15(9):667-676
De Quervain DJF, Roozendaal B, McGaugh JL. 1998. Stress and glucocorticoids impair retrieval of long-term spatial memory[J]. Nature,394(6695):787-790.
Debiec J, LeDoux J. 2004. Disruption of reconsolidation but not consolidation of auditory fear conditioning by noradrenergic blockade in the amygdala[J].Neuroscience,129(2): 267-272.
Delamater AR. 2004. Experimental extinction in Pavlovian conditioning: behavioural and neuroscience perspectives[J]. Q J Exp Psychol B,57(2): 97-132.
Fricks-Gleason AN, Marshall JF. 2008. Post-retrievalβ-adrenergic receptor blockade: Effects on extinction and reconsolidation of cocaine-cue memories[J]. Learn Mem,15(9): 643-648.
Fricks-Gleason AN, Marshall JF. 2011. Role of dopamine D1 receptors in the activation of nucleus accumbens extracellular signal-regulated kinase (ERK) by cocaine-paired contextual cues [J]. Neuropsychopharmacol,36(2): 434-444.
Hoffman DC. 1989. The use of place conditioning in studying the neuropharmacology of drug reinforcement [J]. Brain Res Bull,23(4-5):373-387.
Mao SC, Hsiao YH, Gean PW. 2006. Extinction training in conjunction with a partial agonist of the glycine site on the NMDA receptor erases memory trace[J]. J Neurosci,26(35): 8892-8899.
Maren S. 2001. Neurobiology of Pavlovian fear conditioning[J]. Annu Rev Neurosci,24(1): 897-931.
Mueller D, Cahill SP. 2010. Noradrenergic modulation of extinction learning and exposure therapy [J]. Behav Brain Res, 208(1): 1-11.
Myers KM, Davis M. 2002. Behavioral and neural analysis of extinction[J]. Neuron,36(4): 567-584.
Robinson MJF, Franklin KBJ. 2007. Central but not peripheralβ-adrenergic antagonism blocks reconsolidation for a morphine place preference[J]. Behav Brain Res,182(1): 129-134.
Robinson MJF, Franklin KBJ. 2010. Reconsolidation of a morphine place preference: impact of the strength and age of memory on disruption by propranolol and midazolam[J]. Behav Brain Res,213(2): 201-207.
Shors TJ, Weiss C, Thompson RF.1992. Stress-induced facilitation of classical conditioning [J].Science,257( 5069): 537-539
Tzschentke TM.1998. Measuring reward with the conditioned place preference paradigm: a comprehensive review of drug effects, recent progress and new issues[J]. Prog Neurobiol,56: 613- 672.
Vaiva G, Ducrocq F, Jezequel K, Averland B, Lestavel P, Brunet A, Marmar CR. 2003. Immediate treatment with propranolol decreases posttraumatic stress disorder two months after trauma [J]. Biol Psychiat,54(9): 947-949.
Wang R, Zhang Y, Qing H, Liu M, Yang P. 2010. The extinction of morphine-induced conditioned place preference by histone deacetylase inhibition[J]. Neurosci Lett,483(2): 137-142.
White NM. 1996. Addictive drugs as reinforcers: multiple partial actions on memory systems[J]. Addiction,91(7) 921-949.
Zhang J, Tan H, Niu HC, Wang JH, Tang XD, Sanford LD, Ma YY. 2009. Pentylenetetrazole-induced status epilepticus following training does not impair expression of morphine-induced conditioned place preference[J]. Addict Biol,14(2): 174-184.
Effects of propranolol on acquisition and retrieval of morphineinduced conditioned place preference memories in ICR mice
MAO Yu1,3,#, YANG Shang-Chuan1,#, LIU Chang1,3, MA Yuan-Ye1,2,*, HU Xin-Tian1,2,*
(1. Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China;
2. State Key Laboratory of Brain and Cognitive Sciences, Institute of Biophysics, Chinese Academy of Sciences, Beijing 100101, China;
3. Graduate University of Chinese Academy of Sciences, Beijing, 100049, China)
To interfere with the drug-cue memory processes of addicts such as reconsolidation by the administration of the β-adrenergic receptor (β-AR) of norepinephrine (NE) antagonist propranolol (PRO) has become a potential therapy in the future to decrease or inhibit relapse. However, the relationship between PRO and the acquisition or retrieval of morphine-cue memory is not clear. This study examined the effects of PRO on the acquisition and retrieval of memories in morphine-induced conditioned place preference (CPP) mice model. We found that during memory acquisition period, PRO had no effects on the expression and extinction of morphine-CPP, which suggests that the β-AR was irrelevant to the CPP memory acquisition. However, during memory retrieval period, although PRO did not affect the expression of CPP, but it delayed the occurrence of CPP extinction, which indicates that PRO has an inhibit effect on CPP memory extinction, and β-AR plays an important role in modulating the extinction of morphine-CPP. Our study further improved the relationship between drug addiction and β-AR, and proposed a new theory to help developing potential therapy to cure addiction and other neuropsychiatric disorders.
β-adrenergic receptor; Memory; Acquisition Retrieval; Opioid; Conditioned place preference
Q42; Q57; R964; R971.3
A
0254-5853-(2011)06-0670-05
10.3724/SP.J.1141.2011.06670
2011-05-03;接受日期:2011-10-31
*通讯作者(Corresponding authors),电话/传真:0871-5193083;E-mail:yuanma0716@vip.sina.com; xthu@mail.kiz.ac.cn
国家自然基金面上项目(30870825)
#并列第一作者
猜你喜欢
杂志排行
Zoological Research的其它文章
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 体细胞核移植生产绵羊转hALR基因囊胚
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)
