体细胞核移植生产绵羊转hALR基因囊胚
2011-12-25马玉珍周雪原刘东军旭日干
马玉珍, 任 宇, 周雪原 , 刘东军, 旭日干
(1. 内蒙古自治区人民医院, 呼和浩特 010017; 2. 内蒙古大学 哺乳动物繁殖生物学与生物技术教育部重点实验室, 呼和浩特 010017)
体细胞核移植生产绵羊转hALR基因囊胚
马玉珍1,2,*, 任 宇2, 周雪原2, 刘东军2, 旭日干2
(1.内蒙古自治区人民医院,呼和浩特010017; 2.内蒙古大学 哺乳动物繁殖生物学与生物技术教育部重点实验室,呼和浩特010017)
扩增人肝细胞再生增强因子(human augmenter of liver regeneration,ALR)基因, 利用质粒pIRES2-EGFP构建新霉素(Neo)、增强绿色荧光蛋白(enhanced green fluorescence protein, EGFP)双标记基因且EGFP和ALR基因为双顺反子的真核表达载体。LipofectAMINETM介导其转染体外培养的绵羊胎儿成纤维细胞(sheep fetal fibroblast cells, sFFCs); 经G418筛选转基因细胞; 激光共聚焦显微镜挑选绿色荧光单克隆细胞。PCR、RT-PCR和免疫组织化学方法进一步检测ALR基因及其表达; 稳定表达外源基因的sFFCs作供体, 移入去核的绵羊卵母细胞中, 进行体细胞核移植。通过激光共聚焦显微镜和ALR抗体检测EGFP、ALR基因在胚胎水平上的表达,其结果表明:由IRES连接的EGFP和ALR基因可在绵羊胎儿成纤维细胞内同时表达,由此细胞核移植产生的转基因胚胎在发育的各阶段均可见绿色荧光; 囊胚中所有细胞表达EGFP基因; 发绿色荧光的胚胎中ALR基因同时存在。因此,由IRES连接标记基因和目的基因, 以标记基因指示目的基因的表达, 可简化检测目的基因的繁琐手段; 用筛选的转基因早期胚胎进行移植, 可提高制备转基因动物的效率。
绵羊; 转基因; 体细胞; 核移植
1997年 Wilmut et al (1997)利用核移植技术,成功的克隆了绵羊(Ovis aries)Dolly, 促进了体细胞基因转移和克隆技术的结合, 利用这一技术1997年英国的PPL Therapeutics公司和罗斯林研究所的科学家率先培育出表达人凝血因子Ⅸ(FⅨ)的转基因克隆绵羊(Schnieke et al, 1997), 但是用该方法研制的转基因绵羊具有Neo抗性基因存在和表达, 以及目的基因FⅨ缺失或不表达等问题。鉴于由脊髓灰质炎病毒内部核糖体进入位点IRES(Internal ribosome entry site)连接的两个不同的基因可以共同转录、各自翻译。本实验构建了荧光蛋白、新霉素基因双标记选择载体, 并且利用IRES将增强绿色荧光蛋白基因(Enhanced green fluoresceng protein, EGFP)与目的基因人肝细胞再生增强因子hALR(human Augmenter of liver regeneration,ALR)连接, 构建成EGFP、ALR双顺反子真核表达载体;探讨EGFP和ALR基因在细胞水平上共表达的概率和可行性,并且将转基因细胞进行核移植, 实现在胚胎水平上通过绿色荧光筛选转基因阳性胚胎的目的。Kato et al (1999 )研究表明, 用表达EGFP的小鼠胚胎移植产生的后代中, 77%为EGFP阳性。因此,在细胞和胚胎水平上对转基因动物进行筛选,可减少移植的盲目性、节约代孕母畜、降低成本, 对于提高转基因动物效率具有非常重要的意义。
1材料与方法
1.1 材料
人血液来自内蒙古中心血站。质粒pIRES2-EGFP购自Clontech公司, 质粒提取纯化试剂盒购自Promega公司。RNA提取试剂盒、SuperSciptTMfirst-strand synthesis system、细胞培养液DMEM、G418、PBS粉、LipofectamineTM等购自Gibco BRL公司。 限制性内切酶和T4连接酶购自华美生物工程公司。鼠抗人ALR单克隆抗体IC3由解放军军事医学科学院放射二所惠赠。免疫组化试剂盒购自迈新生物技术公司。
1.2 方法
1.2.1 pIRES2-EGFP/ALR双顺反子真核表达载体的构建 根据GeneBank数据库ALR基因组序列设计引物(P1: 5′-AGAGACGTGGATGCGGACG-3′/P2: 5′-GACTGGCTGTGATGCACTTTAA-3′ ), 预期产物为1 786 bp。 利用淋巴细胞分离液梯度离心分离人血液白细胞, 提取总DNA为模板, PCR扩增ALR基因。反应体系(1×反应缓冲液、1 mmol/L dNTP、0.5 µmol/L上下游引物、1.5 mmol/L MgCl2、1 U Taq酶、100 ng DNA模板)总体积为25 µL。反应条件为:94℃预变性3 min后进入循环, 94 ℃ 30 s, 56 ℃ 40 s, 72 ℃ 2 min, 30个循环, 反应结束后72 ℃延伸7 min。扩增产物用1.0%琼脂糖凝胶电泳分析。用胶回收试剂盒回收目的片断, 连接于T载体, DNA测序确定目的基因ALR的序列, 测序正确的质粒经SalI 和EcoRI酶切回收ALR片段, 定向连入由相同酶切的pIRES2-EGFP质粒的多克隆位点中, PCR和酶切检测载体构建是否正确。AflⅡ酶切使质粒pAIE线性化, 试剂盒纯化回收线性化的质粒, 溶于灭菌超纯水中, 用于转基因。
1.2.2 绵羊胎儿成纤维细胞转基因及阳性克隆筛选
取冷冻保存第3代根据性别基因判断为雌性的绵羊胎儿成纤维细胞(Sheep fetal fibroblast cells, sFFCs), 复温培养。LipofectamineTM用于把pIRES2-EGFP/ALR转入sFFCs, 转基因步骤参见说明书。为了获得稳定的转染子, 转染后的sFFCs在含800 µg/mLG418的DMEM培养液持续筛选14 d。抗性克隆形成, 荧光显微镜下观察, 大部分克隆表达绿色荧光; 挑选3个绿色荧光克隆扩大培养; 一部分细胞用于转基因检测;一部分细胞经0.5% FCS的DMEM饥饿培养3~5 d, 用于核移植。
1.2.3 单克隆细胞中ALR基因的PCR检测 各组取约2~3×103细胞离心收集, 置于20 µL细胞裂解液中, 37 ℃消化3 h, 离心, 取5 µL上清液进行PCR反应, 反应体系中加入ALR基因引物, 反应条件同上, 以未转基因的sFFCs为阴性对照。
1.2.4 单克隆细胞中ALR基因的RT-PCR检测 根据ALR基因的cDNA序列设计引物(P3: 5′-CGCCGACCTCCGATTC-3′/P4: 5′-TGAGTGCCCTG CCCCTA-3′), 预期产物为522 bp。 约4×107个细胞用于提取RNA, 提取方法和cDNA第一链的合成按试剂盒说明操作。取2 µL cDNA为模板进行ALRcDNA 扩增,产物用1.0%琼脂糖凝胶电泳分析。
1.2.5 单克隆细胞中ALR基因的免疫组织化学检测
取单克隆细胞用胰蛋白酶消化后, 以1×105/孔接种于盖玻片上进行细胞爬片, 38 ℃, 5% CO2培养48 h后, SP法进行免疫组化染色, 一抗为鼠抗人ALR单克隆抗体IC3, 相差显微镜下观察、照相。
1.2.6 卵母细胞的体外成熟、克隆程序、重构胚的融合和激活及克隆胚胎的体外培养
将绵羊卵巢浸入盛有采卵液的玻璃培养皿中,用无菌手术刀片释放出卵泡液和卵丘−卵母细胞复合体(cumulus oocyte complexes, COCs)。显微镜下挑选形态良好、卵丘细胞完整、包裹致密、至少带有3层卵丘细胞的卵丘-卵母细胞复合体, 在38.5℃、5% CO2和饱和湿度的条件下成熟培养18 h后观察挑选排出第一极体且胞质匀称形态良好的去卵丘细胞的卵母细胞用于细胞核移植。将卵母细胞−核供体细胞复合体用成熟液洗3次, 在38.5 ℃、5% CO2和饱和湿度条件下恢复培养0.5~1 h后进行电融合操作。以190 V/mm, 两次直流脉冲、20 µs/次, 间隔100 ms电脉冲的融合条件进行融合。融合后的重构胚放入发育液中, 于5% CO2培养箱中恢复培养30 min后检查融合情况。将已经融合的重构胚置于含5 µmol/L IA23187的SOFaa中激活5 min, 再将其置于含2 mmol/L 6-DMAP的SOFaa培养液中, 在38.5 ℃、5% CO2和饱和湿度条件下培养4 h后用发育液洗重构胚5次后将其放入含500 µL发育液的四孔板中, 在38.5 ℃、5% CO2和饱和湿度条件下培养48 h后检查卵裂率, 挑取卵裂球均匀, 形态正常的胚胎用于胚胎移植。部分胚胎继续培养, 6 d之后观察囊胚发育情况(Kang et al, 2009)。
1.2.7 激光共聚焦显微镜观察转基因克隆胚胎及ALR蛋白免疫组化检测
分别于24、48和96 h统计卵裂率、8-细胞期胚胎和囊胚发育率,同时在激光共聚焦显微镜下观察胚胎中绿色荧光的表达,挑选荧光胚胎和克隆胚胎经过固定后, 用Hoechest33342和10 µg/mL PI进行核染色并于激光共聚焦显微镜下观察细胞数。免疫组化检测荧光克隆胚中ALR蛋白的表达, 将胚胎置于0.25%链霉蛋白酶中去除透明带, 其余步骤同转基因sFFCs免疫组化检测方法。
2 结 果
2.1 pIRES-EGFP/ALR表达载体的构建
PCR扩增出1.7 kb的DNA条带, 序列测定表明,与hALR已知序列符合率达99.6%以上, 含3个外显子和2个内含子且外显子及剪切位点没有碱基改变。图1所示为PCR和酶切检测空载体pIRES2-EGFP和构建的真核表达载体pIRES-EGFP/ALR, 结果表明,ALR基因定向插入pIRES2-EGFP载体中。
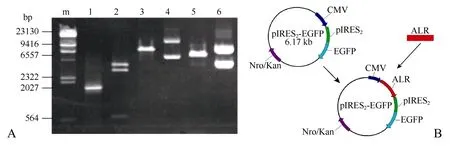
图1 pIRES-EGFP/ALR酶切检测及载体构建Fig.1 Restriction endonuclease digestion and the building of expression vector pIRES2-EGFP/ALR
2.2 pIRES-EGFP/ALR转染绵羊胎儿成纤维细胞及阳性克隆的筛选
脂质体LipofectamineTM介导 pIRES-EGFP/ALR载体转染sFFCs 8 h 后, 在激光共聚焦显微镜下可见荧光细胞, 细胞胞浆中出现弥散的微弱荧光,随后荧光细胞数目增多, 荧光明显增强。在转染48 h 时荧光细胞数目最多, 荧光最亮, 均匀分布于细胞胞浆和细胞核中, 核仁区无(图2A)。 经含800 µg/mL G418的DMEM培养液筛选2 d后大约60%的细胞死亡, 继续培养12 d, 形成多个单克隆细胞系,计数100个克隆, 其中67%克隆细胞发绿色荧光, 33%的克隆经G418筛选, 虽然能够存活,但是细胞没有绿色荧光(图2)。
2.3 PCR鉴定单克隆细胞中ALR基因的存在
从细胞系提取DNA进行PCR, 3个绿色荧光细胞单克隆全部显示1.7 kbALR条带, 与阳性对照PCR结果相同, 未转基因的sFFCs阴性细胞没有特异性条带, 初步证明ALR基因已整合到绵羊sFFCs中(图3)。
2.4 RT-PCR鉴定单克隆细胞中ALR基因的转录
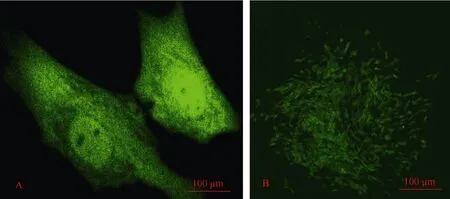
图2 激光共聚焦显微镜下观察pALR-IRES-EGFP转染的绵羊胎儿成纤维细胞(A×400, B×100)Fig. 2 sFFCs transfected with pALR-IRES-EGFP were observed under confocal laser microscope (A×400, B×100)
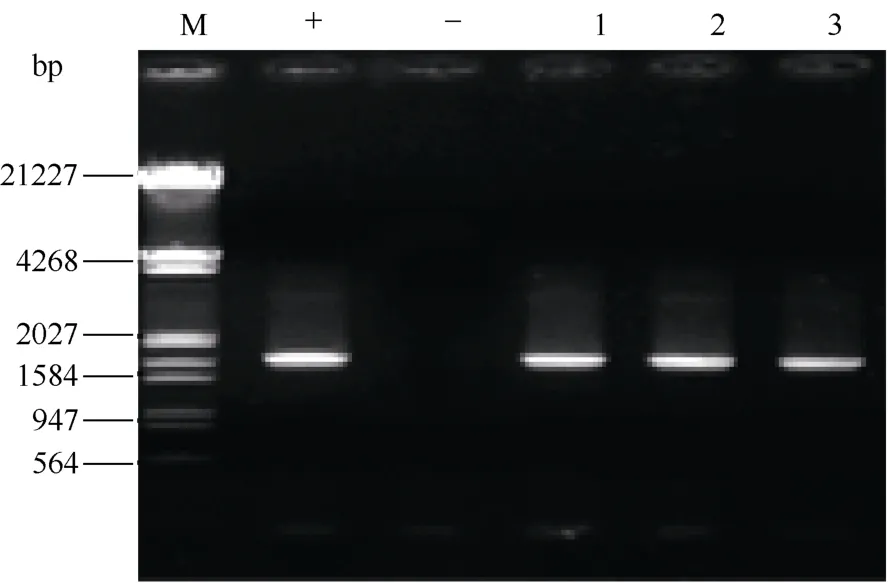
图3 PCR检测ALRFig.3 PCR results of ALR
3个荧光细胞单克隆进一步进行RT-PCR, 电泳检测可见522 bpALRcDNA条带, 未转基因的SFFC没有特异性条带(图4)。因为重组质粒中通过荧光观察已知EGFP基因表达, 说明EGFP和ALR基因已整合入SFFC基因组中并被转录, 且基因重组没有造成EGFP和ALR基因的缺失断裂或突变。
2.5 免疫组化鉴定ALR蛋白的表达
对荧光单克隆细胞进行ALR蛋白检测, 相差显微镜下sFFCs中有棕色颗粒分布于核内和胞浆(图5A), 对照组细胞未着色(图5B)。以上结果表明,在EGFP表达的阳性克隆中同时有ALR蛋白的形成, 体现了IRES的功能特征, 即由其连接的两个不同基因表达高度相关。实验中共得到14枚囊胚, 5枚胚胎进行ALR基因免疫组化检测, 均有ALR蛋白表达, 说明在胚胎水平上ALR基因表达。
2.6 转基因细胞克隆胚胎的体外检测
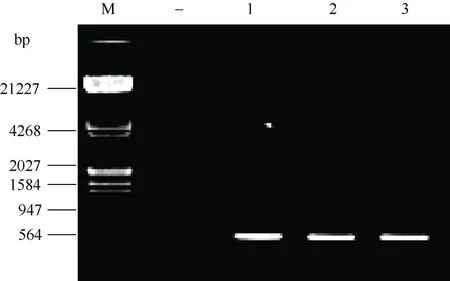
图4 RT-PCR检测ALR mRNAFig.4 RT-PCR results of ALR mRNA
绵羊卵子-卵丘复合体经22 h培养后, 发育状况良好, 卵丘细胞均匀扩散。去卵丘细胞后, 74.4%(160/215)的卵母细胞在相差显微镜下可见第一极体,挑取形态较好的146枚用于核移植。融合处理卵141枚, 融合成功卵数109枚, 融合率77.3%。48 h后75枚重构胚卵裂,卵裂率为68.8%, 8-细胞62枚, 8-细胞率为82.7%。 52枚具有荧光表达, 其中14枚发育至囊胚期, 囊胚发育率为26.9%。在激光共聚焦显微镜下观察, 供体细胞融合后的克隆胚胎在体外发育的各个时期都能表达EGFP基因, 在桑椹胚和囊胚的每个细胞都能表达绿色荧光, 说明克隆胚胎是纯合的, 不是嵌合体。图6A、B所示为发绿色荧光的转基因胚胎 (其中A、B为同一胚胎), 图6C显示8-细胞绿色荧光胚胎经ALR抗体免疫组化染色细胞胞浆及核内可见棕色颗粒。经RT-PCR检测ALR基因有表达, 说明在胚胎水平上EGFP和ALR基因同时表达。以正常未做转基因的成纤维细胞的克隆做对照, 转基因细胞和正常细胞两者所得到的克隆胚胎在发育各个时期并无显著差异, 且对照组重构胚在发育各个时期均无绿色荧光表达。两组间在细胞数上没有显著性差异(图6D、E)。
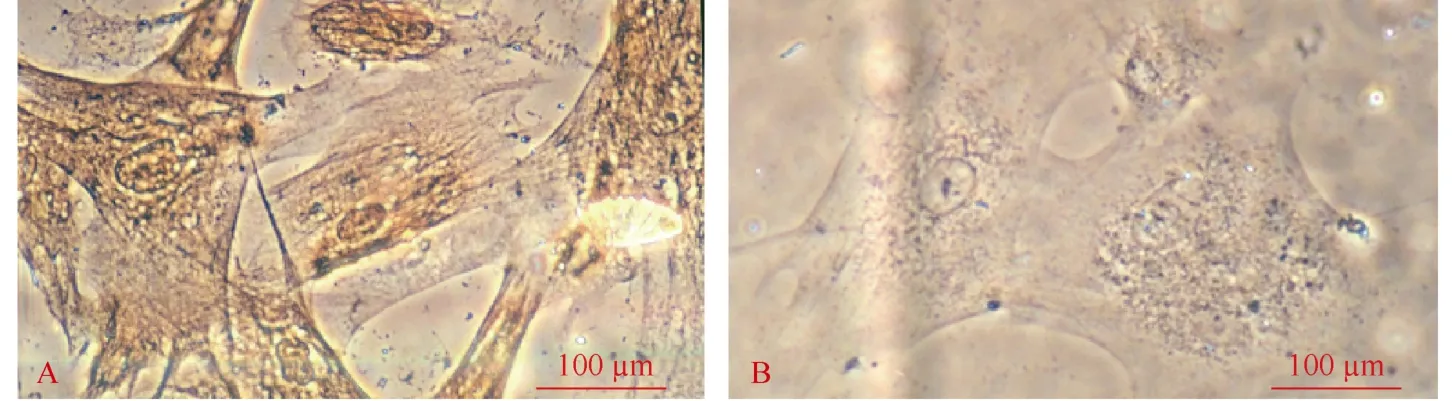
图5 相差显微镜下观察ALR蛋白在转基因细胞中的表达(×400)Fig.5 The expression of ALR protein in the SFFcells were observed by a contranst phase microscope (×400)
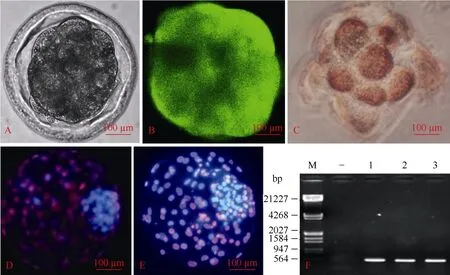
图6 转基因胚胎检测Fig.6 Detection of cloned embryos
3 讨 论
肝炎、肝硬化在我国发病率高、危害严重, 尤其是急性肝功能衰竭, 有起病急、预后差、病死率高的特点, 其预后主要取决于病损肝细胞的坏死程度和再生能力。利用肝细胞再生的特性, 缓解病毒对肝的损害是肝再生研究的热点之一。研究发现,肝细胞再生增强因子(ALR)能有效的促进肝细胞的再生。肝细胞表面存在ALR受体, 与ALR特异性结合, 促进肝细胞从G1期进入S期, 完成细胞的增殖。目前重组的ALR已经应用于临床治疗肝损伤相关疾病, 并取得了一定的治疗效果, 但是由原核编码的蛋白质不能进行翻译后修饰, 影响蛋白的作用效果.因此,用转基因动物真核细胞表达hALR, 能够促进蛋白翻译后的修饰, 在结构和生物活性上与天然的蛋白分子相同, 从而在临床中提高治疗效果。
在转基因动物的制备过程中, 转基因效率低、成本高仍然是限制转基因动物发展的瓶颈。用绿色荧光蛋白作为分子标记, 可以显著提高转基因效率。以EGFP基因作为标记基因, 用显微原核注射法产生的转基因小鼠中, 囊胚中全部细胞表达绿色荧光为转基因阳性胚胎, 部分细胞表达荧光是嵌合体胚胎, 其中转基因囊胚, 占21%, 嵌合胚, 占79% (Wang et al, 2000)。许多研究结果均表明, 通过显微注射产生的转基因囊胚阳性率平均为20%~30%。Takada et al (1997)将显微注射产生的阳性胚胎移植到小鼠体内, 产生的小鼠中, 只有70%为转基因小鼠。随着体细胞核移植技术的建立及在转基因动物中的应用, 使转基因的筛选提前到细胞水平, 用转基因细胞进行核移植使转基因动物生产效率得到进一步提高, Keiser et al (2001)利用体细胞核移植产生的转基因荧光小鼠中, 阳性率达92%。因此,用绿色荧光蛋白作为标记基因进行转基因胚胎的筛选, 移植后可大大提高制备转基因动物的效率,但是在转基因动物的检测中发现仍然存在着标记基因与目的基因不能同时表达的现象。 Trouet et al (1997) 利用内部核糖体进入位点 (Internal ribosome entry site, IRES) 连接标记基因和目的基因, 选择32枚荧光克隆和24枚非荧光克隆进行IRES上下游基因相关性分析, 结果表明, 由IRES连接的上下游基因同时表达。
IRES是从细小RNA病毒中发现的, 该病毒以新的5′-帽子非依赖的形式进行翻译, 其核糖体结合位点位于细小病毒RNA5′非编码区内部的一个区域 (Jackson et al, 1990)。这一区域包括450个核苷酸长度, 核糖体与其3′端结合后扫描RNA到达翻译起始点。由它连接的开放阅读框架可以同时翻译, IRES上游阅读框架的翻译采用常规的帽子结构扫描翻译起始模式。下游阅读框架的翻译由IRES引导翻译, IRES元件能够启动真核细胞的多顺反子转录单位的两个或多个蛋白同时分别表达, 而且蛋白之间互不影响彼此功能(Venkatesan & Dasgupta, 2001; Wang et al, 2000 )。
本实验利用IRES连接EGFP、ALR基因, 实现EGFP、ALR基因同时表达, 且以Neo、EGFP作为双标记基因进行双重筛选。转基因细胞首先经新霉素抗性基因筛选, 得到的单克隆细胞中67%的克隆表达绿色荧光, 33%的克隆不表达绿色荧光, 可能是旁观效应造成假阳性细胞的存活。再经过荧光显微镜挑选表达EGFP基因的荧光单克隆细胞, 经过RT-PCR和免疫组化实验证明EGFP、ALR基因同时表达。进一步利用荧光细胞进行绵羊体细胞核移植, 8-细胞胚胎发育率为82.7%, 其中表达绿色荧光的占83.9%, 随着克隆胚胎体外发育时间的延长, 绿色荧光蛋白在克隆胚胎中的表达也逐渐增强, 到桑椹胚时, 表达量达到最高, 荧光最亮, 这可能与绿色荧光蛋白的逐渐积累有关。实验中共得到14枚囊胚, 在激光共聚焦显微镜下观察, 囊胚中每个细胞表达绿色荧光。 其中3枚胚胎利用RT-PCR检测、5枚胚胎进行ALR基因免疫组化检测, 均有ALR蛋白表达, 说明在胚胎水平上EGFP、ALR基因同时表达。绿色荧光蛋白作为一种可见的基因转移标记已广泛用于转基因动物的研究与生产中, 但对于它是否会影响到胚胎的发育研究者们观点不一, Roh et al (2000)研究表明,绿色荧光蛋白不会影响到转基因胚胎的发育, Takada(1997)的实验还表明,不但GFP本身对胚的发育无害, 同时每天用470~490 nm光检查对胚的发育亦没有影响;而Arat et al (2002)的研究结果则相反(Zhang et al, 2005; Adams & Briegel, 2005; Denning et al, 2001)。本实验的结果显示绿色荧光蛋白对转基因克隆胚胎的早期发育没有明显影响, 在胚胎发育速度和内细胞团细胞数上均没有显著性差异。因此, 我们认为利用体细胞核移植是一条切实可行的制备转基因大家畜的途径。
Adams NR, Briegel JR. 2005. Multiple effects of an additional growth hormone gene in adult sheep[J]. J Animal Sci,83: 1868-1874.
Arat S, Gibbons J, Rzucidlo SJ, Respess DS, Tumlin M, Stice SL. 2002. In vitro development of bovine nuclear transfer embryos from transgenic clonal lines of adult and fetal fibroblast cells of the same genotype[J]. Biol Reprod,66(6): 1768-1774.
Denning C, Burl S, Ainslie A, Bracken J, Dinnyes A, Fletcher J, King T, Ritchie M, Ritchie WA, Rollo M, de Sousa P, Travers A, Wilmut I, Clark AJ. 2001. Deletion of theα(1, 3)galactosyl transferase ( GGTA1 )gene and the prion protein(PrP) gene in sheep[J]. Biotechnology,19: 559-562.
Jackson RJ, Howell MT, Kaminski A. 1990. The novel mechanism of initiation of picornavirus RNA translation[J]. Trends Biochem Sci,16(12): 477-483.
Kang L, Wang J, Zhang Y, Kou Z, Gao S. 2009. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos[J]. Cell Stem Cell5(2): 135-138.
Kato M, Yamanouchi K, Ikawa M, Okabe M, Naito K, Tojo H. 1999.Efficient selection of transgenic mouse embryos using EGFP as a marker gene[J]. Mol Rep Dev,54: 43-48.
Keiser JT, Jobst PM, Garst AS, Boone JT, Geyer CB, Phelps C, Ayares DL, Page RL. 2001. Preimplantation screening for transgenesis using an embryonic specific promoter and green fluorescent protein[J]. Cloning3(1):23-30
Roh S, Shim H, Hwang WS, Yoon JT. 2000. In vitro development of green fluorescent protein (GFP) transgenic bovine embryos after nuclear transfer using different cell cycles and passages of fetal fibroblasts[J]. Reprod Fertil Dev 12(1-2): 1-6.
Schnieke AE, Kind AJ, Ritchie WA, Mycock K, Scott AR, Ritchie M, Wilmut I, Colman A, Campbell KH. 1997. Human factor IX transgenic sheep produced by transfer of nuclei from transfected fetal fibroblasts[J]. Science278: 2130.
Takada T. 1997. Selective production of transgenic mice using green fluorescent protein as a marker[J]. Nat Biotechnol,15: 453-461.
Trouet D, Nilius B, Voets T, Droogmans G, Eggermont J. 1997. Use of a bicistronic GFP-expression vectorto characterize ion channels after transfection in mammalian cells[J]. P flugers Arch,434(5): 632-638.
Venkatesan A, Dasgupta A. 2001. Novel fluorescence based screen to identify small synthetic internal ribosome entry site elements[J]. Mol Cell Biol21(8): 2826-2837.
Wang X, Wan H, Korzh V, Gong Z. 2000. Use of an IRES bicistronic construct to trace expression of exogenously introduced mRNA in zebrafish embryos[J]. Biotechniques29(4): 814-816,818,820.
Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell KH. 1997. Viable offspring derived from fetal and adult mammalian cells[J]. Nature,385: 810-813.
Zhang R, Xu WZ, Kong P. Xu GT, Li N. 2005. The current status of research and development in transgenic animals[J]. Chn Biotechnol,25(8): 16-24.
Production of transgenic embryos through nuclear transfer using ovine fetal fibroblasts transferred with foreign genes
MA Yu-Zhen1,2,*, REN Yu2, ZHOU Xue-Yuan2, LIU Dong-Jun2, XU Ri-Gan2
(1. Inner Mongolia Hospital, Hohhot, 010017, China, 2. Key Laboratory of Ministry of Education of China for Mammal Reproduction Biology and Biotechnology of Inner Mongolia University, Huhhot 010021, China)
HumanALRgene sequence was amplified by PCR from human total DNA and inserted into pIRES2-EGFP vector. The bicistronic eukaryotic expression vector, pIRES-EGFP/ALR, expressing EGFP, NeorandALRgenes was constructed. Sheep fetal fibroblast cells (sEFCs) were transfected with pIRES-EGFP/ALRby the induction of lipofectAMINETM. The positive cell clones were selected with medium containing G418 (800 µg/mL). The fluorescence of transgenic cells was examined with a confocal laser scanning microscope. The expression ofALRgene was tested by PCR, RT-PCR and immuno-histochemical staining. The transgenic cells were used as donors for nuclear transfer to enucleated ovine oocytes. Transgenic embryos were tested by confocal laser scanning microscope and immuno-histochemical staining. Results showed that the EGFP andALRgenes linked with IRES were coexpressed simultaneously in sFFCs; the blastocysts formed by nuclear transfer using tranfected donor cells are all transgenic blastocysts. EGFP,ALRand Neorgene were all expressed in the transgenic embryos. In conclusion that a method to construct the positive embryos before pre-implantation which stably expressALRgene by the indication of EGFP expression has been successfully established. The application of this method can simplify the procedure of testing the targets and contribute to the efficiency increasing of transgenic domestic animal production.
Sheep; Transgenic; Somatic cells; Nuclear transfer
Q813; S826.2; Q291
A
0254-5853-(2011)06-0617-07
10.3724/SP.J.1141.2011.06617
2011-07-11;接受日期:2011-10-08
国家自然科学基金项目“间隙连接蛋白在绵羊胚胎发育过程中的功能研究”资助(30660123)
∗通讯作者(Corresponding author),Tel/Fax: +86-0471-6619236; E-mail: mayz@imnu.edu.cn
猜你喜欢
杂志排行
Zoological Research的其它文章
- A phylogeny of the Tylototriton asperrimus group (Caudata: Salamandridae) based on a mitochondrial study: suggestions for a taxonomic revision
- 体外培养猕猴穆勒细胞经诱导可表现出视网膜前体细胞特征
- 上海市南汇东滩围垦后海岸带湿地冬春季水鸟生境选择
- 杭州湾及钱塘江河口水鸟群落组成、季节动态及种间相关性分析
- 云南新平哀牢山西黑冠长臂猿分布与群体数量
- Histological and immunocytochemical study of deferens ducts in the Chinese rat snake (Zaocys dhumnades)
