注射用头孢呋辛钠他唑巴坦钠制剂安全性研究
2011-12-23邢桂兰谢学立
邢桂兰,谢学立,曾 渝,符 健
(海南医学院海南省药物安全性评价研究中心,海南海口 271101)
注射用头孢呋辛钠他唑巴坦钠制剂安全性研究
邢桂兰,谢学立,曾 渝,符 健
(海南医学院海南省药物安全性评价研究中心,海南海口 271101)
为考察注射用头孢呋辛钠他唑巴坦钠 (4∶1)制剂的安全性,分别进行豚鼠全身过敏性、家兔局部刺激性和家兔红细胞溶血性试验.结果显示,动物给药后未见明显溶血反应,家兔耳缘静脉和股四头肌未见明显刺激反应,豚鼠也无全身过敏反应.表明本品符合肌肉和静脉注射用药安全性要求.
头孢呋辛钠他唑巴坦钠;局部刺激性;过敏性;动物
头孢呋辛钠 (Cefuroxime)为第 2代合成头孢菌素类抗生素[1],对β-内酰胺酶稳定[2],对大多数革兰氏阳性菌、阴性菌和厌氧菌均有强的抗菌活性,如:流感嗜血杆菌、卡他莫拉氏菌、化脓链球菌、肺炎杆菌、淋病奈瑟球菌等[4]有较好疗效,临床应用于呼吸道、泌尿系、脑膜炎、肺炎[3]、眼科手术[4]等.由于临床广泛应用,出现了头孢呋辛钠耐药菌,如肺炎杆菌[5]、肺炎链球菌[6]、不产β-内酰胺酶的嗜血杆菌[7]、肠杆菌[8]和产β-内酰胺酶的大肠杆菌[9]等,并且其耐药性问题日趋严重.
细菌耐药性的最主要机制是细菌分泌β-内酰胺酶降解抗生素[10],解决这问题最成功的策略是使用β-内酰胺酶抑制剂[11].β-内酰胺酶抑制剂能抗多数革兰氏阳性菌、阴性菌,包括厌氧菌、假单胞菌[12]和不动细菌属[13]等,为当前抗生素领域发展的新趋势.临床上常使用他唑巴坦、舒巴坦和克拉维酸等β-内酰胺酶抑制剂,其中他唑巴坦优于后者[10].对细菌类感染常同时用 2种药的有:一种是使用抗生素抑制细菌细胞壁生长,另一种是抑制细菌产生β-内酰胺酶,阻止其酶解破坏抗生素[10].在美国使用β-内酰胺酶抑制剂的药物有:哌拉西林他唑巴坦、氨苄西林舒巴坦、氨苄西林克拉维酸和替卡西林克拉维酸等[11].
Jalil等人发现头孢呋辛钠结合克拉维酸能显著提高对产β-内酰胺酶金黄葡萄球菌的抗菌活性[14].本项目的前期研究表明,头孢呋辛钠与他唑巴坦钠组成复方制剂,对大多数耐药且产β-内酰胺酶的细菌具有很好的协同抗菌作用.为考察注射用头孢呋辛钠他唑巴坦钠 (4∶1)制剂安全性,笔者对该药进行了全身过敏性、局部刺激性和溶血性等方面的制剂安全性试验研究,为临床用药提供参考.
1 材料与方法
1.1 试验药物注射用头孢呋辛钠他唑巴坦钠,白色粉末,0.75 g·瓶-1,配比为m头孢呋辛钠:m他唑巴坦钠=4∶1,即含头孢呋辛钠 0.6 g,他唑巴坦钠 0.15 g,批号:2010630,由海口奇力制药股份有限公司提供.氯化钠注射液,海南东联长富有限公司生产,批号:1011051.使用前用氯化钠注射液溶解注射用头孢呋辛钠他唑巴坦钠,稀释成质量浓度为 0.18 g·mL-1.牛白蛋白,购自国药集团化学试剂有限公司,蛋白含量:≥98.0%(以牛白蛋白含量计).
1.2 试验动物新西兰家兔,雌雄不拘 (雌性无孕),体质量为 2.0~2.5 kg·只-1,由长沙市开福区东创实验动物科研服务部提供,质量合格证号:No.HNACSDC20100767.HD豚鼠,雌雄不拘 (雌性无孕),体质量 300~400 g,由广东省医学实验动物中心提供,质量合格证号:No.0079332.
1.3 试验方法[15,16]
1.3.1 溶血性试验 φ=2%的兔血细胞混悬液的制备:取家兔心脏采血 20 mL,用玻璃珠去除纤维蛋白,加氯化钠注射液,摇匀,离心,弃上清液,加氯化钠注射液洗涤沉淀至上清液无色为止,然后将红细胞稀释成φ=2%的混悬液.溶血性试验:取试管 7支,按表 1加入各种液体,37℃水浴,开始每隔 15 min观察 1次,1 h后,每隔 1 h观察 1次,观察 3 h.溶血判定标准:如溶液澄明红色为溶血;如溶液中有棕红色或红棕色絮状沉淀,表示有红细胞凝集作用;如红细胞全部下沉,上层液无色澄明,可判断为无溶血.
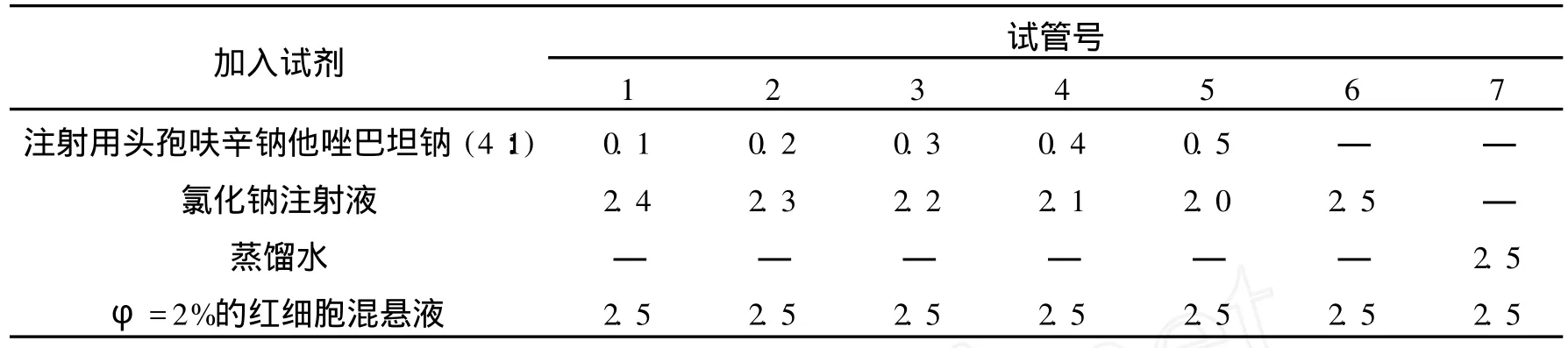
表1 溶血性试验加样表 mL
1.3.2 家兔耳缘血管刺激试验 取健康、耳缘无损伤的家兔 4只,每日每只家兔左侧耳缘静脉分别注射质量浓度为 0.18 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)5 mL,右侧注射等体积氯化钠注射液,连续 3次,给药前、后肉眼观察给药血管局部及周围组织的变化,包括注射局部血管及周围组织是否有充血、水肿和组织坏死等刺激性反应症状.末次给药后 96 h,处死动物,解剖取出注射部位的血管组织,福尔马林固定,脱水,常规石蜡包埋,切片,H.E染色,光镜下观察有无血管扩张、管壁破坏、内皮细胞肿胀、腔内血栓形成、组织变性或坏死等显著性刺激反应.
1.3.3 家兔股四头肌刺激试验 取健康家兔 4只,左侧股四头肌内分别注入质量浓度为 0.18 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)1 mL,右侧股四头肌内注入等体积注射用水作对照,给药后观察注射局部肌肉反应情况,如充血、红肿、变性、坏死等.48 h后,处死动物,解剖取出股四头肌,纵向切开,观察受试物的局部刺激反应,按表 2换算成相应的反应分值,分别计算出左右侧股四头肌反应分值的总和,并以注射部位为中心,取出肌肉,经常规福尔马林固定、石蜡切片、H.E染色后进行病理组织学检查.

表2 肌肉刺激反应评分标准
1.3.4 全身过敏试验 取健康豚鼠 24只,体质量 300~400 g,随机分为注射用头孢呋辛钠他唑巴坦钠(4∶1)高、低剂量组、阳性对照组和阴性对照组,每组各 6只,隔日每只腹腔分别注射质量浓度为 0.18 g·mL-1、0.09 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)和质量浓度为的 0.2 g·mL-1牛白蛋白和0.09 g·mL-1的氯化钠注射液,给药体积均为 0.5 mL·只-1,连续 3次.于末次用药后 14 d,分别一次静脉注射质量浓度为 0.18 g·mL-1、0.09 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)和质量浓度为 0.2 g·mL-1的牛白蛋白和 0.09 g·mL-1的氯化钠注射液进行激发,给药体积均为 1.0 mL·只-1,注射后 30 min内,观察动物有无抓鼻、竖毛、咳嗽、呼吸困难、颤抖、休克甚至死亡等过敏反应.
2 结果与分析
2.1 溶血性试验按表 1加样可见,37℃保温 4 h,在 1~6号管,上层液无色澄明,红细胞全部下沉,未见有溶血和凝集反应,阳性对照管 (7号管)完全溶血,产生红色透明溶液,表明质量浓度为 0.18 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)无明显溶血作用.
2.2 家兔耳缘血管刺激试验家兔耳缘静脉连续 3次滴注质量浓度为 0.18 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1),给药前后注射部位血管未见明显充血及水肿,血管边缘清晰.末次给药 96 h后,处死动物,病理组织检查,观察到注射部位耳缘静脉壁由内膜、中膜和外膜构成,内膜腔面被覆内皮细胞,中膜有多层平滑肌,外膜为结缔组织,未见明显病变.
2.3 家兔股四头肌刺激试验家兔左股四头肌注射质量浓度为 0.18 g·mL-1的注射用头孢呋辛钠他唑巴坦钠 (4∶1)1 mL,右侧股四头肌注射等体积的氯化钠注射液,给药后 48 h,处死动物,每块股四头肌均未见充血、水肿、变性或坏死等明显刺激反应;股四头肌反应分值均为 0.病理组织检查,发现各取材点横纹肌结构正常,横纹清晰,间质血管无明显扩张充血,未见明显病理改变.表明该受试品对家兔股四头肌无明显刺激作用.
2.4 全身过敏试验注射用头孢呋辛钠他唑巴坦钠高、低剂量组和阴性对照组在第 1、2、3次致敏和激发给药后即刻至 30 min内,均未观察到过敏反应症状,过敏反应均为阴性.阳性对照组在激发给药后,发生咳嗽、呼吸困难、步态不稳、颤抖、搔鼻、旋转等过敏反应症状,其中 1只死亡,致敏率为 100%.
3 小结
本研究通过动物全身过敏性、血管、肌肉刺激性和溶血性试验对注射用头孢呋辛钠他唑巴坦钠 (4∶1)进行了制剂安全性考察.实验结果表明:注射用头孢呋辛钠他唑巴坦钠 (4∶1)静脉和肌肉注射给药,不会引起血管变性和肌肉坏死等刺激反应,对豚鼠无全身过敏反应,家兔亦未发生红细胞凝集和溶血现象,提示该药临床肌肉和静脉注射给药安全.注射用头孢呋辛钠他唑巴坦钠(4∶1)属于化药 1.5类新药,该药的研发为解决临床上细菌感染性耐药提供更好的治疗药物,也为本品的继续研究开发提供了依据.
[1]L ILJA M,MÄKITIE A A,ANTT ILA V J,et al.Cefuroxime as a prophylactic preoperative antibiotic in septoplasty.A double blind randomized placebo controlled study[J].Rhinology,2011,49(1):58-63.
[2]HUGO J,IS MAEL L,ANGÉL ICA C,et al.Effect of severity disease on the phar macokinetics of cefuroxime in children with multiple organ system failure[J].Biol.Pharm.Bull,2008,31(2):316-320.
[3]BUL ITTA J B,LANDERSDORFER C B,K INZIGM,et al.New semiphysiological absorption model to assess the phar macodynamic profile of cefurox ime axetil using nonparametric and parametric population pharmacokinetics[J].AntimicrobialAgents and Chemotherapy,2009,53(8):3462-3471.
[4]KARADAG S,OZKAN B,KARABASV L,et al.Effectof cefurox ime andmoxifloxacin on Staphylococcus epider midis adherence to intraocular lenses[J].Can J Ophthalmol,2009,44:663-667.
[5]SCHUMACHER H,SCHE IBEL J,MOLLER J K.Cross-resistance patterns among clinical isolates of Klebsiella pneumoniae with decreased susceptibility to cefuroxime[J].J Ant imicrob Chemother,2000,46(2):215-221.
[6]FENOLL A,AGU ILAR L,ROBLEDO O,et al.Influence of the beta-lactam resistance phenotype on the cefuroxime versus cefditoren susceptibility of Streptococcus pneumoniae and Haemophilus influenzae recovered from children with acute otitis media[J].J Ant imicrob Chemother,2007,60(2):323-327.
[7]STRAKER K,WOOTTON M,S IMM A M,et al.Cefurox ime resistance in non-beta-lactamase Haemophilus influenzae is linked to mutations in ftsI[J].J Antimicrob Chemother,2003,51(3):523-530.
[8]CHABOKA,TÄRNBERGM,S MEDH K,et al.Prevalence of fecal carriage of antibiotic-resistant bacteria in patientswith acute surgical abdominal infections[J].Scand J Gastroenterol,2010,45(10):1203-1210.
[9]KÄLLMAN O,GISKE CG,SAMUELSEN O,et al.Interplay of efflux, impermeability,andAmpc activity contributes to cefuroxime resistance in clinical,non-ESBL-producing isolatesof Escherichia coli[J].Microb Drug Resist,2009,15(2):91-95.
[10]MATTHEW K,MON I CA A,JOHN D,et al.Different intermediate populations formed by tazobactam,sulbactam,and clavulanate reactingwith SHV-1β-lactamases:Raman crystallographic evidence[J].J Am Chem Soc,2009,131(6):2338-2347.
[11]DOR ITZA P,XIANG Z,REIKO S,CHR ISTOPHER R,et al.Tazobactam Inactivation of SHV-1 and the Inhibitor-resistant Ser130 3 Gly SHV-1-actamase[J].The Journal ofBiological Chemistry,2004,279(19):19494-19501.
[12]OZTOPRAK,N I HAL P,HANDE A R,et al.Piperacillin-tazobactam versus carbapenem therapy with and without amikacin as empirical treatment of febrile neutropenia in cancer patients:Results of an open randomized trial at a university hospital[J].Nefise.Jpn J Clin Oncol,2010,40(8):761-767.
[13]PAUL G,H ILMARW,DANUTA S,et al.In vitro activitiesof the beta-lactamase inhibitors clavulanic acid,sulbactam,and tazobactam alone or in combination with-lactams against epidemiologically characterized multidrug-resistantAcinetobacter baum anniistrains[J].AntimicrobialAgents and Chemotherapy,2004,48(5):1586-1592.
[14]JAL IL A,N IAZI ID,KHAN SU.Evaluation of restoration of sensitivities of resistant staphylococcus aureus isolates by using cefurox ime and clavulanic acid in combination[J].J AyubMed CollAbbottabad,2008,20(2):28-30.
[15]国家食品药品监督管理局.化学药物刺激性、过敏性和溶血性研究技术指导原则[S].北京:国家食品药品监督管理局,2005.
[16]陈奇.中药药理实验方法学[M].北京:人民卫生出版社,1993.
Safety Evaluation of Cefurox imetazobactam Sodium for I njection
X ING Gui-lan,XIE Xue-li,ZENG Yu,FU Jian
(Drug Safety Evaluation&Research Center of Hainan Province,HainanMedicalUninversity,Haikou,571101)
To evaluate the safety of combinations of cefuroximetazobactam sodium according to ratio 4∶1 for injection,the tests on guinea pig irritability,hemolysis,muscle and vascular st imulation of rabbitwere performed.The results showed that the Cefuroximetazobactam (4∶1)injection had no hypersensitive reaction on guinea pigs,no evidences of hemolyzation and aggregation on rabbit erythrocytein vitro,and no obvious stimulatory effects on muscles and marginal ear veins of rabbit.These results suggested that the Cefuroximetazobactam(4∶1)injection was safe for clinical application.
cefuroximetazobactam sodium injections;muscles and vascular stimulation;hypersensitivity;animal
R 978.1+1 < class="emphasis_bold">文献标志码:A
A
1004-1729(2011)02-0143-04
2011-02-23
海南省重点研究项目(090215)
邢桂兰 (1979-),女,海南文昌人,海南医学院海南省药物安全性评价研究中心研究实习员.
符健,教授,海南医学院海南省药物安全性评价研究中心主任,0898-66982118,fujianhnmc@163.com.
