广东省高州水库水华过程中蓝藻群落的动态特征*
2011-12-11郭跃华陈修康张建林韩博平
郭跃华,陈修康,张建林,韩博平,2,彭 亮,2**
(1:暨南大学水生生物研究所,广州510632)
(2:广东省水库蓝藻水华防治中心,广东省水利厅-暨南大学,广州510632)
广东省高州水库水华过程中蓝藻群落的动态特征*
郭跃华1,陈修康1,张建林1,韩博平1,2,彭 亮1,2**
(1:暨南大学水生生物研究所,广州510632)
(2:广东省水库蓝藻水华防治中心,广东省水利厅-暨南大学,广州510632)
2009年1-4月,高州水库发生了规模较大的粘质鱼腥藻(Anabaena mucosa)水华,最高藻细胞密度达3.4×107cells/L,并在2010年的同一时期再次出现,这也是粘质鱼腥藻首次在广东省水库水体形成水华.为了解该水库蓝藻水华发生的特点,本文于2009年8月到2010年7月对高州水库进行了逐月采样,分析了水华发生期间蓝藻群落结构特征及动态.蓝藻群落结构在枯水期与丰水期差异显著,蓝藻细胞丰度枯水期较高,蓝藻优势种为粘质鱼腥藻,并形成蓝藻水华,丰水期蓝藻细胞丰度较低.在枯水期降雨较少,水库水位与库容较低,水力滞留时间急剧增加,水体稳定,有利于藻类的大量繁殖与生物量积累.同时水体透明度下降,水温下降,更有益于对低温有较好适应能力的种类—粘质鱼腥藻成为优势种并形成水华.蓝藻生物量与水温有很强的负相关性,表明粘质鱼腥藻能够适应低温.在丰水期,表层水温增加,水体分层加剧,同时降雨大幅度提高,水位显著升高,水华微囊藻的优势度增加,取代了粘质鱼腥藻成为最主要的优势种,但由于总丰度下降,蓝藻水华消失.
蓝藻水华;粘质鱼腥藻;蓝藻群落;高州水库
蓝藻作为富营养水体的主要类群,对水体环境因子变化较为敏感.在不同类型的水体,起主导作用的环境因子在不同时期也有差别[1].营养盐水平是形成一定生物量的物质条件,当入库污染负荷达到必要的水平后,初始浮游植物群落结构与蓝藻种源、水温、光照、水文动力、水位、库容等成为影响水华发生与群落结构的主要因素.与温带水库相比较,热带水库存在较明显的地域环境差异:水温常年较高,深水水体易出现热分层,光照较强,有明显的丰水期、枯水期之分.水体分层直接或间接地影响到营养盐的分布和浮游植物的丰度、种类组成、垂直分布、生命周期等[2].光照强度能对浮游植物群落结构产生重要影响[3],强光对多数藻类生长有一定抑制作用,但不少的浮游蓝藻在生理上对强光有较好的耐受性[4].相对于其它藻类而言,蓝藻能吸收更宽波段的光,在弱光下亦能正常生长,并且部分蓝藻如微囊藻还具有伪空胞结构,能调节自身浮力,在水柱中垂直迁移[5],当水体藻类生物量增加影响水体的透明度时,更容易形成竞争优势[6].水体动力学特征在很大程度上也能够影响浮游植物群落组成和生物量[7].对于我国南亚热带的大型水库来说,枯水期水体动力学特征体现在:水库入水量和出水量均较小,库容水位变化不明显,水体稳定性较高,水体滞留时间较长,这些特征都利于蓝藻成为优势.在一个特定的水体中,浮游植物群落结构的演替与水华的发生是由多个环境因子在时间和空间上综合作用的结果,解析一次水华事件的发生时间与成因是一个十分复杂的问题[8].
2009年广东省茂名市饮用水源地高州水库发生了规模较大的粘质鱼腥藻(Anabaena mucosa)水华[9],由于该种形成的蓝藻水华在我国首次发生,其发生的主要特点与原因尚不清楚.为认识该种形成蓝藻水华的原因与特点,对高州水库石骨库区蓝藻和水质理化指标进行为期一年的调查,分析水库水质理化因子动态规律与蓝藻群落结构的变化特征,为水库蓝藻水华的预警与预防提供基础数据.
1 材料与方法
1.1 水库概况
高州水库位于广东省粤西地区鉴江流域,属于大型山谷型水库,库区位于高州市东北部,距市区25km,主要担负供水、发电、养殖、防洪等功能,是粤西地区重要的供水源地之一.该水库修建于1959年,2006年防洪加固后库容量11.5×108m3,流域面积1022km2,正常水位高程对应的水面面积为43.81km2,最高水位高程87.39m,最低为62.39m,平均80.75m.水库分为石骨库区、良德库区,一级支流分别为曹江和大井河.库区降雨主要集中在5-9月,有明显的丰水期与枯水期之分.
图1 高州水库石骨库区采样点分布图Fig.1 Sampling sites in Shigu zone of Gaozhou Reservoir
1.2 采样点设置
在水库石骨库区设置4个采样点(图 1).S1样点(22°2'8″N,111°1'3″E)位于取水口;S2 样点(22°2'53″N,111°4'12″E)位于河流入库口;S3样点(22°2'57″N,111°2'34″E)位于库中;S4 样点(22°3'6″N,111°1'7″E)位于主坝附近.
1.3 样品采集、处理与分析
现场用多参数水质监测仪(YSI85)测定水温、溶氧、电导率、矿化度等水质指标;用萨克斯盘测定透明度(SD);记录采样时间,样点名称,样品类别,同时记录样点周边大型水生植物分布情况、采样时的天气状况、近期的降雨情况和人类在水库的活动等.水文数据由水库管理局与广东省水文局茂名分局提供.
采集后的水样立即带回实验室,按照国家水质标准方法(GB3838-2002)测定营养盐:总氮(TN)、铵态氮(NH4-N)、硝态氮(NO3-N)、亚硝态氮(NO2-N)、总磷(TP)、正磷酸盐(PO4-P)的浓度;Chl.a浓度根据林少君等改进的方法测定[10].
浮游植物定性样品用25号浮游生物网(64μm)倒“S”型拖取;放入100ml的聚乙烯小瓶内加入适量的甲醛溶液固定;浮游植物定量样品在表层0.5m处取1L水样,用浓度5%的甲醛溶液固定[11]、静置沉淀、浓缩后在光学显微镜下进行鉴定和计数,生物量计算方法参考《淡水浮游生物研究方法》[12].数据处理采用SPSS 15.0分析软件.
2 结果与分析
2.1 水文水动力变量
高州水库的降雨量季节分布不均,枯水期降雨稀少,丰水期雨量充沛.其中7月份降雨量最大为427mm,12月份雨量最小为10.4mm,年平均降雨量为198mm(图2).水位季节波动较大,10月份水库最高水位为85.7m,为警戒泄洪水位.4月份最低为81.7m,与10月份相比落差为4m,年均水位83.7m(图3a).各月份水体滞留时间都大于200d,其中1月份水体滞留时间最长,为1637d,月平均滞留时间为682d(图 3a).

图2 调查期间高州水库降雨量Fig.2 Seasonal variations of Precipitation in Gaozhou Reservoir during the investigation period from August 2009 to July 2010
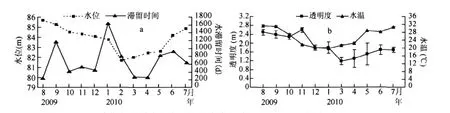
图3 调查期间高州水库水位与水体滞留时间(a)、透明度与水温(b)月变化Fig.3 Seasonal variations of water level elevation and water retention time(a),water temperature and transparency(b)in Gaozhou Reservoir during the investigation period from August 2009 to July 2010
2.2 水温与透明度
水体水温常年较高,季节变化明显,最低水温出现在1月份,为20.1℃,最高水温出现在8月,为32.3℃,周年平均水温为 25.9℃(图 3b).
水体透明度变动较大,透明度最高值为2.50m,出现在11月,最小值为1.18m,出现在次年3月.透明度的变化趋势与水位的变化趋势基本一致(图3b).
2.3 营养盐浓度
从各样点营养盐浓度变化情况来看,在丰水期(5-9月份)TN平均浓度为0.78mg/L,枯水期(10-4月份)为0.67mg/L,7月份平均浓度最高,为1.3mg/L,其它各月平均浓度都低于1mg/L;TP平均浓度丰水期为0.021mg/L,枯时期为0.014mg/L,平均浓度为 0.019mg/L(图4a);PO4-P 平均浓度丰水期为0.006mg/L,枯水期为0.003mg/L,6月份平均浓度最高,为0.007mg/L,10月份最低,为0.002mg/L;可溶性氮(DIN,包括NO3-N、NO2-N、NH4-N)在丰水期平均浓度为 0.32mg/L,枯水期为 0.34mg/L,7月份平均浓度最低,为0.12mg/L,5 月份平均浓度最高,为0.51mg/L(图 4b).
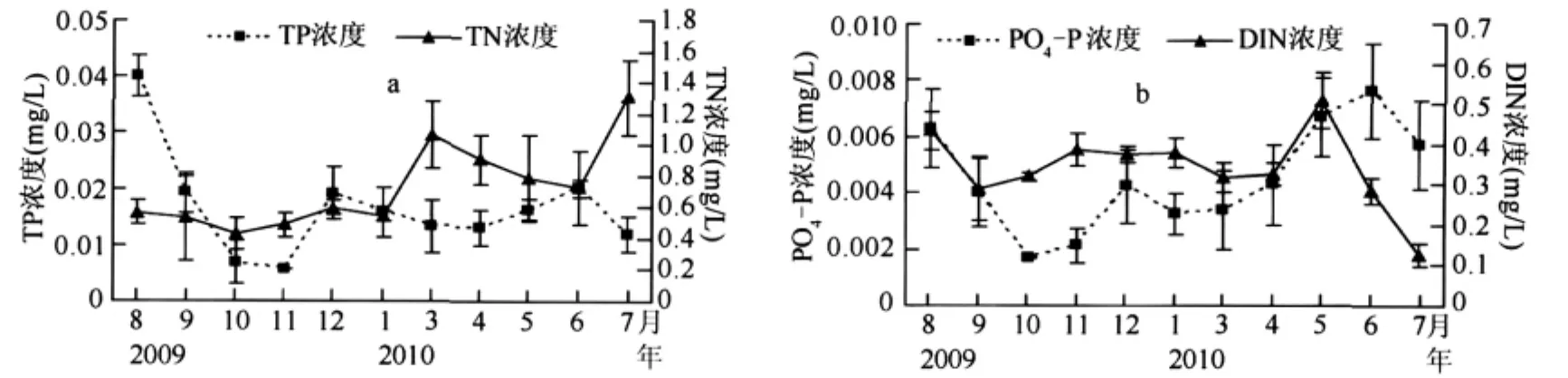
图4 高州水库TN、TP(a)、PO4-P、DIN(b)的月变化Fig.4 Seasonal variations of TN and TP(a),PO4-P and DIN(b)in Gaozhou Reservoir from August 2009 to July 2010
2.4 蓝藻群落的种类组成
对水库4个样点12次浮游植物调查取样,共发现浮游植物81属,分属8个门.其中蓝藻13属,分别为鱼腥藻属(Anabaena)、微囊藻属(Microcystis)、色球藻属(Chroococcus)、平裂藻属(Merismopedia)、颤藻属(Oscillatoria)、乌龙藻属(Woronichinia)、假鱼腥藻属(Pseudanabaena)、拟柱胞藻属(Cylindrospermopsis)、蓝纤维藻属(Dactylococcopsis)、粘球藻属(Gloeocapsa)、泽丝藻属(Limnothrix)、腔球藻属(Coelosphaerium)、束球藻属(Gomphosphaeria).在丰水期发现的蓝藻种类较多,主要种类有粘质鱼腥藻、水华微囊藻(Microcystis flosaquae)、银灰平裂藻(Merismopedia glauca)、微小色球藻(Chroococcus minutus)、针状蓝纤维藻(Dactylococcopsis acicularis);枯水期种类则较少,主要有粘质鱼腥藻和水华微囊藻.
2.5 蓝藻丰度与生物量
蓝藻丰度随季节变化差别显著,枯水期明显高于丰水期.枯水期蓝藻丰度最大值出现在2月份,为3.4×107cells/L,其它各月份丰度大小依次为3月>1月>4月>12月.与枯水期相比,丰水期蓝藻丰度较低.从蓝藻丰度组成比例上来看,丰水期到枯水期,微囊藻属丰度在蓝藻丰度中占有的比例呈递减趋势,鱼腥藻则呈递增趋势(图5).其它种类蓝藻丰度很低,变化规律不明显.在12月份到次年4月份蓝藻水华发生期间,第一优势种为粘质鱼腥藻,其丰度较高,2月份丰度达到最大值,次优势种水华微囊藻有相似的分布变化特点(图6a).
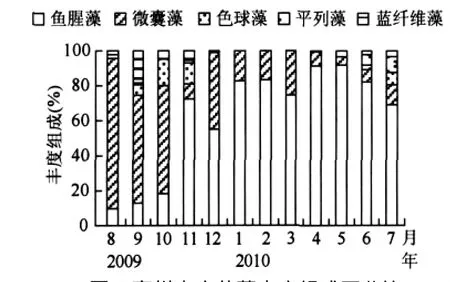
图5 高州水库蓝藻丰度组成百分比Fig.5 Composition of cyanobacteria abundance in Gaozhou Reservoir
蓝藻的生物量主要由优势种粘质鱼腥藻贡献.该种鱼腥藻单细胞原生质体较大,具有近似于2-3倍细胞直径厚度的胶质包被,群体结构呈直链状或螺旋状,由数十到数百个单细胞连接形成.蓝藻生物量最大值出现在2月,鱼腥藻的生物量贡献率近似为100%,绝对生物量达到485mg/L(图6b).微囊藻的生物量2月、3月、8月较高,分别为 0.080、0.055、0.059mg/L.其它蓝藻种类的生物量较低.
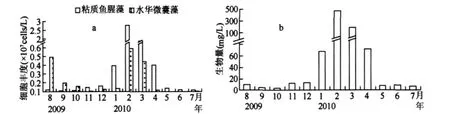
图6 高州水库优势种(粘质鱼腥藻与水华微囊藻)丰度(a)、生物量(b)Fig.6 Abundance(a)and biomass(b)of dominant species(Anabaena mucosa and Microcystis flos-aquae)in Gaozhou Reservoir
3 讨论
3.1 蓝藻群落的季节动态
浮游植物群落结构的变动与各种类对不同水体环境的适应能力密切相关.高州水库丰水期蓝藻优势种为水华微囊藻,枯水期为粘质鱼腥藻,并发生周期性的更替Dokulil等[13]研究表明丝状蓝藻种类对水流的平流冲刷较为敏感,容易在平流冲刷率较低的水体成为优势种.在枯水期,高州水库库区降雨稀少,入库流量较小,水体冲刷率较低,水体稳定性高,在此条件下丝状蓝藻粘质鱼腥藻易成为蓝藻优势种并形成水华.在丰水期,水温升高,水体热分层加剧,喜较高水温且具有相对较强浮力调节机制的微囊藻群体种类对水体热垂直分层具有较好的适应性,适合在光照强度较大、水温较高的环境下生长并取得竞争优势[13].高州水库水体具有类似的特点.因而这也是在丰水期微囊藻取代粘质鱼腥藻成为蓝藻优势种的原因之一.
3.2 营养盐对蓝藻动态的影响
氮、磷是水体营养盐的主要构成部分,也是浮游植物的生长和代谢的物质基础.Sas等对欧洲水体的研究指出,当水体中无机氮浓度超过100μg/L,可溶性磷浓度超过10μg/L时,浮游植物的生长将不受到限制[14].高州水库周年可溶性磷浓度均低于10μg/L,无机氮浓度均高于100μg/L,表明高州水库浮游植物的生长存在明显的磷限制.蓝藻对磷具有特殊的吸收与存储机能,还能分泌胞外碱性磷酸酶,分解有机磷为无机磷供自身生长需要[15].高州水库各样点TP平均浓度为19μg/L,TN平均浓度为721μg/L,具备蓝藻水华发生的营养基础.
3.3 水温与透明度对蓝藻动态的影响
水温是水体的重要环境因子之一,影响着水体浮游植物的丰度.蓝藻最适温度范围25-35℃,对高温的耐受性要强于其它藻类[16].王得玉等[17]在分析太湖蓝藻水华特点时发现蓝藻的最适生长温度为24-30℃,高于30℃会对蓝藻生长有明显的抑制作用.高州水库常年的平均水温都在20℃以上,1月份的平均水温最低,为20.1℃,11-4月份的平均水温为21.3℃,5-10月份的平均气温在28℃以上,全年Chl.a浓度与水温呈极显著负相关关系(R2=0.8139,P<0.01)(图7a).蓝藻水华发生在11-4月份,表明高州水库引发水华的蓝藻种类—粘质鱼腥藻对20-23℃之间水温适应性最强.粘质鱼腥藻比较能适应较低温的环境,胡韧等[9]研究也表明该种引发水华的最适应温度为20-24℃,与本文的结论较为相似.
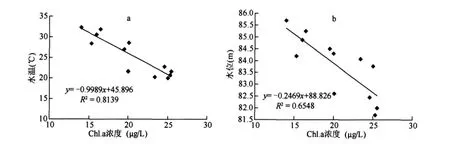
图7 高州水库水温(a)、水位(b)与Chl.a浓度的相关性Fig.7 Correlation between water temperature(a),water lever elevation(b)and chlorophlly-a
水体透明度表征水体透光度的大小,透明度的高低直接影响着浮游植物的光合作用,不同藻类对光照的适应程度不同,丝状蓝藻如假鱼腥藻(Pseudanabaena)和湖生蓝丝藻(Limnothrix),容易在透明度不高,光限制比较明显的水体中形成优势[18-19].而本研究发现,枯水期高州水库的透明度较低,浮游植物种类相对较少,丝状蓝藻粘质鱼腥藻能有效地利用弱光迅速生长并形成水华.
3.4 水位与降雨量对蓝藻动态的影响
水位是影响浮游植物群落结构的重要水文因子,能直接或间接的通过水体的理化性质影响浮游植物组成及多样性[20].林秋奇等[21]对流溪河水库的研究表明,水位的波动与浮游植物的多样性呈正相关.降雨量也是影响蓝藻水华发生的重要因素,降雨量偏少对蓝藻的生长发育有利[22].野外监测也发现多数小雨天气对蓝藻短期发展较有利,高强度降水对蓝藻短期发展有一定的抑制作用.高州水库全年叶绿素a含量与水位有较强的负相关关系(R2=0.6548,P<0.05)(图7b).在1-3月份水库水位较低,水体波动较小,浮游植物群落结构较为简单,小个体种类相对较少,此时蓝藻生物量与丰度都较高,主要优势种为粘质鱼腥藻.11月份到次年3月份降雨量较小,水体扰动小,南亚热地区具有足够的光强加速了蓝藻的短期迅速发展,这也是粘质鱼腥藻在较低水位、低降雨量时期成为优势种的原因之一.
3.5 水体滞留时间对蓝藻分布的影响
水体滞留时间是反映水体稳定性的一个重要的指标,间接的反应了水体物种受干扰的强度.微囊藻的悬浮机制与水体的稳定性密切相关[23].赵孟绪等[24]对汤溪水库蓝藻水华暴发的研究指出,在具备充分营养盐与适合水温条件下,水体稳定性是控制汤溪水库蓝藻水华发生时间的关键因子.胡韧等[25]对珠海竹仙洞水库研究指出,短水力滞留时间是控制浮游植物群落结构与数量的关键因子.高州水库库容较大,水体稳定性较好,水体滞留时间较长,平均滞留时间为682d,远远大于深水分层形成稳定分层的滞留时间(100d)[26-27].1月份,高州水库水体稳定性高,水力滞留时间长,蓝藻水华发生在水体持续稳定后的2月份.这时表层水温超过20℃,形成了稳定的水体分层.温跃层距表层10-12m处,水体混合层较深,有利于适应低光和低温的藻类形成优势,而粘质鱼腥藻正具备这样的适应性.在夏季丰水期,降雨大幅度提高,水体冲刷率较高,水位波动较大,水体不稳定,消弱了粘质鱼腥藻的优势度,并且表层水温增加,水体分层加剧,更适合喜高温的微囊藻生长,从而导致水华微囊藻的优势度增加,取代粘质鱼腥藻成为最主要的蓝藻优势种,但总丰度下降,蓝藻水华消失.
4 结论
(1)高州水库发生了规模较大的粘质鱼腥藻水华,以该种形成的蓝藻水华在我国首次发生.
(2)粘质鱼腥藻对20-23℃之间水温适应性最强,滞留时间长、稳定性高、水体冲刷率低的水体更有利于该种形成竞争优势.因此在高州水库的枯水期发生了以粘质鱼腥藻为优势种的蓝藻水华.
(3)高州水库丰水期与枯水期的水动力特征、水库水文、水温的差异以及丝状蓝藻与群体蓝藻对水体环境的适应能力的不同,导致蓝藻优势种群结构的变化。在枯水期以粘质鱼腥藻形成水华,在丰水期微囊藻取代鱼腥藻,丰度下降,水华消失.
致谢:鉴江流域管理局的领导在野外调查采样中给予了大力支持,在此衷心感谢!
[1]Chapman BR,Ferry BW,Ford TW.Phytoplankton communities in water bodies at Dungeness,U.K.:analysis of seasonal changes in response to envionmental factors.Hydrobiologia,1998,362:161-170.
[2]吕 晋,邬红娟,马学礼等.武汉市湖泊蓝藻分布影响因子分析.生态环境,2008,17(2):515-519.
[3]孔繁翔,高 光.大型浅水富营养化湖泊中蓝藻水华形成机理的思考.生态学报,2005,25(3):589-595.
[4]Paerl W,Fulton RS,Moisander PH et al.Harmful freshwater algal blooms,with an emphasis on cyanobacteria.science world,2001,1:76-113.
[5]Ressom R,Soong FS,Fitzgerald J et al.Health effects of toxic cyanodacteria(blue-green algae).Australian National Health and Medical Research Council,1994:1-108.
[6]何志辉.淡水生态学.北京:中国农业出版社,2000.
[7]Figueredo CC,Giani A.Seasonal variation in the diversity and species richness of phytoplankton in a tropical eutrophic reservoir.Hydrobiologia,2001,445:165-174.
[8]Reynolds CS.What factors influence the species composition of phytoplankton in lakes of different trophic status?Hydrobiologia,1998,369/370:11-26.
[9]胡 韧,雷腊梅,张成武.我国鱼腥藻的新记录种——粘质鱼腥藻.生态科学,2009,28(1):1-3.
[10]林少君,贺立静,黄沛生等.浮游植物中叶绿素a提取方法的比较与改进.生态科学,2005,24(1):9-11.
[11]金湘灿,屠清瑛.湖泊富营养化调查规范.北京:中国环境科学出版社,1990.
[12]章宗涉,黄祥飞.淡水浮游生物研究方法.北京:科学出版社,1991.
[13]Dokulil MT,Teubner K.Cynobacterial dominance in lakes.Hydrobiologia,2000,438:1-12.
[14]Oliver R,Ganf G.Freshwater Blooms.In:Whitton BA ,Potts M,ed.The Ecology of cyanobacteria.The Netherlands:Kluwer Academic Publishers,2002:149-194.
[15]Sommer U.Comparison between steady and non-sready state competition:experiments with natural phytoplankon.Limnology and Oceanography,1985,30:335-346.
[16]Nalewajko C,Murphy TP,Effects of temperature and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa,Japan:an experimental approach.Limnology,2001,2:45-48.
[17]王得玉,冯学智,周立国等.太湖蓝藻爆发与水温的关系的MODIS遥感.湖泊科学,2008,20(2):173-178.
[18]Reynolds CS,Huszar V,Kruk C et al.Towards a functional classification of the freshwater phytoplankton.Journal of Plankton Research,2002,24(5):417-428.
[19]Nixdorf B,Mischke U,Rucker J.Phytoplankton assemblages and steady state in deep and shallow eutrophic lakes-an approach to differentiate the habitat properties of Oscillatoriales.Hydrobiologia,2003,502:111-121.
[20]邬红娟,胡传林.黑龙滩水库夏季不同水位对鱼产量和浮游生物群落结构的影响.水生生物学报,1995,19(4):360-367.
[21]林秋奇,胡 韧,韩博平.流溪河水库水动力学对营养盐和浮游植物分布的影响.生态学报,2003,23(11):2278-2283.
[22]任 健,商兆堂,蒋名淑等.2007年太湖蓝藻爆发的气象条件分析.安徽农业科学,2008,36(27):11874-11877.
[23]Oliver RL.Floating and sinking in gas-vacuolate cyanobacteria.Journal of Phycology,1994,30:161-173.
[24]赵孟绪,韩博平.汤溪水库蓝藻水华发生的影响因子分析.生态学报,2005,25(7):1554-1561.
[25]胡 韧,熊江霞,韩博平.具有短水力滞留的小型富营养化水库浮游植物群落结构与动态.生态环境,2008,17(4):1319-1326.
[26]Straskraba M,Tundisi JG,Ducan A.State-of-the-art of reservoir limnology and water quality management.In:Straskraba M,Tundisi JG,Duncan A,ed.Comparative reservoir limnology and water quality management.Dordrecht,The Netherlands:Kluwer Academic Pubishers,1993:213-288.
[27]Han BP,Armengol J,Garcia JC et al.The thermal structure of Sau Reservoir(NE:Spain):a simulation approach.Ecological Modelling,2000,125:109-122.
Dynamics of cyanobacterial community during algae blooming in Gaozhou Reservoir of Guangdong Province,southern China
GUO Yuehua1,CHEN Xiukang1,ZHANG Jianlin1,HAN Boping1,2& PENG Liang1,2
(1:Institute of Hydrobiology,Jinan University,Guangzhou 510632,P.R.China)
(2:Control and Mitigation Center of Cyanobacteria Blooms of Guangdong Province,Water Resources Department of Guangdong Province and Jinan University,Guangzhou 510632,P.R.China)
A cyanobacterial bloom(dominated by Anabaena mucosa)in Gaozhou Reservoir was firstly reported from January to April in 2009,occurred again in 2010.Its maximum cell density reached 3.4 ×107cells/L.To understand the characteristics of the cyanobacterial blooms,the community structure and dynamics of cyanobacteria were investigated monthly from August 2009 to July 2010.There was a significant difference in species composition of cyanobacteria between dry season and flood season in the reservoir.Cell density in dry season was higher than that in flood season when Anabaena mucosa formed cyanobacterial bloom.This phenomenon may attribute to the beneficial conditions to algal growth and accumulation,e.g.low precipitation,low water level and low storage capacity,but hydraulic retention time prolonged and thermal stability increased.Moreover,the decreased water transparency and lowering temperature would contribute to Anabaena mucosa turning into the dominant species and to form cyanobacterial blooms.Strong negative correlation between water temperature and cyanobacterial biomass suggested that Anabaena mucosa was adaptable to low water temperature.In the flood season,increasing of precipitation resulted in high water level,and thermal stratification occurred in vertical column of the water.Microcystis flos-aquae was dominated in the algal community gradually instead of Anabaena mucosa because of the water stratification,but the bloom disappeared with a dramatic decrease of total cyanobacteral biomass.In conclusion,the cyanobacterial bloom in Gaozhou Reservoir was closely related to water temperature and precipitation.
Cyanobacterial bloom;Anabaena mucosa;cyanobacterial community;Gaozhou Reservoir
* 广东省水利厅科技计划项目和国家自然科学基金项目(U0733007)联合资助.2010-10-26收稿;2010-12-09收修改稿.郭跃华,男,1984 年生,硕士研究生;E-mail:guoyuehuagg@163.com.
** 通讯作者;E-mail:pengliang0920@163.com.
