不同类型表面活性剂与高铁肌红蛋白相互作用
2011-12-11张莹莹曹洪玉郑学仿
张莹莹 曹洪玉,2 唐 乾,2 郑学仿,2,*
(1大连大学生命科学与技术学院,辽宁大连116622;2大连大学,辽宁省生物有机化学重点实验室,辽宁大连116622)
不同类型表面活性剂与高铁肌红蛋白相互作用
张莹莹1曹洪玉1,2唐 乾1,2郑学仿1,2,*
(1大连大学生命科学与技术学院,辽宁大连116622;2大连大学,辽宁省生物有机化学重点实验室,辽宁大连116622)
通过UV-Vis吸收光谱、同步荧光光谱、圆二色(CD)光谱等方法对阴离子型表面活性剂——琥珀酸二辛酯磺酸钠(AOT)和十二烷基苯磺酸钠(SDBS)、阳离子型表面活性剂——十六烷基三甲基溴化铵(CTAB)和十二烷基三甲基溴化铵(DTAB)、两性离子型表面活性剂——3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(CHAPS)与马心高铁肌红蛋白(metMb)的不同作用机理进行了探讨.结果显示:阴、阳离子型表面活性剂可以与蛋白发生较强烈的作用,且相互作用与表面活性剂的浓度密切相关.AOT和SDBS浓度的升高使得metMb的Soret带发生红移且出现两个新的Q带,伴随着配体金属电荷转移(LMCT)带的消失,蛋白从水合的六配位高自旋复合物(6-cHs)转化成六配位低自旋高铁血红素复合物(6-cLs),低浓度的AOT和SDBS对Tyr和Trp微环境均有影响,能使metMb的二级结构发生变化;而CTAB和DTAB在低浓度时对metMb的血红素中心影响不大,但是对Trp和Tyr的微环境影响很大,高浓度时主要通过静电吸引作用以聚合体形式直接作用于血红素中心,使Soret带发生蓝移,metMb形成五配位高自旋(5-cHs)复合物,血红素从疏水腔中释放出来,metMb的α螺旋含量减少. DTAB由于自身结构的特点,与CTAB作用于蛋白的过程有些区别,形成了一个中间态,但最终也导致血红素的暴露.两性离子型表面活性剂在测定浓度范围内不与metMb发生作用,原因是CHAPS整体呈电中性,其与metMb的阴离子性或者阳离子性位点作用的能力很弱,同时也说明metMb表面带相反电荷的位点相距较远.结果充分证明表面活性剂与蛋白相互作用的方式与表面活性剂的种类、结构及其浓度有关.
阴离子型表面活性剂;阳离子型表面活性剂;两性表面活性剂;高铁肌红蛋白;光谱法
1 引言
表面活性剂与蛋白相互作用广泛应用于食品、化妆品和药物配方中.1,2人发和羊毛就是经常暴露于表面活性剂中的两种蛋白质底物,表面活性剂能与蛋白分子相互作用并能透过细胞膜,沾在皮肤上的表面活性剂有0.5%渗入血液,皮肤上若有伤口则渗透力提高10倍以上,因此表面活性剂可以通过多种渠道进入人体内,在体内积少成多,与其他化学物质结合,毒性会增加数倍,有诱发癌特性.有些表面活性剂血溶性很强,容易引起血红蛋白的变化,造成贫血症.肌红蛋白(Mb)在生物体内起着储存氧和促进氧在细胞中扩散的作用,Mb与其他小分子物质如细菌内毒素、3海藻糖4和羟基脲5等相互作用结果表明,一些生物小分子可以使得氧合型肌红蛋白(oxyMb)转变成高铁肌红蛋白(metMb)和hemichrome的形式,而血红素蛋白的hemichrome形式与一些异常疾病有关,6所以探讨表面活性剂对人体蛋白的影响对生命过程中表面活性剂在生物体内毒性作用研究具有重要意义.
近年来,关于蛋白质与表面活性剂的作用研究多集中在二者作用时形成复合物的结合方式、表面特性及表面活性剂引起的蛋白质结构变化.7-9不同类型表面活性剂在不同条件下可形成具有不同结构的分子有序组合体,蛋白质是具有二级和三级结构的两性聚电解质,随着外界条件的变化,分子的荷电性质发生很大变化,因此二者相互作用机理较为复杂.Guo等10比较研究了十二烷基硫酸钠(SDS)和CTAB与血红蛋白(Hb)相互作用,得出了不同的pH条件下,SDS和CTAB对Hb的作用强度和作用力不同.在模拟人体弱碱性缓冲环境体系中全面比较和探讨三种不同类型表面活性剂与metMb相互作用不同机理的研究尚无报道.为了能更详细解释表面活性剂与蛋白质相互作用的本质,本文选用UV-Vis吸收光谱、同步荧光光谱、CD光谱等技术分别研究了阴离子型表面活性剂AOT和SDBS、阳离子型表面活性剂CTAB和DTAB、两性离子型表面活性剂CHAPS与metMb相互作用过程中不同机理及metMb二级结构变化,并从分子水平上分析了表面活性剂存在时metMb的构象变化及配位反应机理.
2 实验部分
2.1 仪器与试剂
马心肌红蛋白样品(美国Sigma公司),UV-Vis吸收光谱特征峰表明其几乎全部为metMb,使用时用Na2HPO4-NaH2PO4缓冲溶液(0.05 mol·L-1,pH= 7.4)(PB缓冲液)配制成浓度为8.0×10-6mol·L-1的溶液(避光4°C保存并尽快用于实验);表面活性剂AOT(96%)、DTAB(~99%)、CHAPS(≥98%,TLC)均购自Sigma公司,SDBS(AR)购自天津市大茂化学试剂厂,CTAB(AR)购自天津市科密欧化学试剂开发中心,使用前用PB缓冲液配制成各自所需浓度,见实验结果分析部分.实验用水为超纯水.仪器主要有日本Jasco公司的V-560型UV-Vis分光光度计、FP-6500型荧光分光光度计、J-810型圆二色分光光度计;德国Julabo公司的F-12型制冷和加热循环器.
2.2 实验方法
2.2.1 UV-Vis吸收光谱
在比色皿中加入8.0×10-6mol·L-1的metMb溶液2 mL,用微量注射器逐次加入定量的AOT溶液(累积总体积小于50 μL),混匀并避光作用3 min,以缓冲液加入等量的AOT溶液作参比,按照以下条件分别记录AOT与metMb相互作用的紫外吸收光谱:狭缝宽度为2 nm,扫描波长范围220-700 nm,扫描速率400 nm·min-1,响应时间中等.其他四种表面活性剂与metMb作用的紫外吸收光谱检测方法同上.
2.2.2 同步荧光光谱
在比色池中加入8.0×10-6mol·L-1的metMb溶液2 mL,用微量注射器逐次加入定量的AOT溶液(累积总体积小于50 μL),混匀,避光作用,控制温度为(25.00±0.01)°C,静置3 min后,以Δλ=20 nm和Δλ=60 nm测定同步荧光光谱的变化情况.激发和发射狭缝分别为5 nm,扫描速率为500 nm·min-1,响应时间为0.5 s,检测器灵敏度为中等(CTAB和DTAB为低).其他四种表面活性剂与metMb作用的荧光光谱检测方法同上.
2.2.3 CD光谱
移取500 μL的8.0×10-6mol·L-1的metMb溶液于0.1 cm石英比色池中,用微量进样器依次加入定量的AOT溶液(累积总体积小于10 μL),进行相互作用的圆二色谱测定.狭缝宽度为1 nm,扫描波长范围为190-250 nm,扫描速度为50 nm·min-1,响应时间为2 s,累计次数为3次.CD光谱测定其他四种表面活性剂与metMb作用的方法同上.
3 结果与讨论
3.1 阴离子型表面活性剂
metMb的UV-Vis吸收光谱受血红素周围的微环境影响.图1A和1B分别为用0.034 mol·L-1的AOT、0.01 mol·L-1SDBS滴定浓度为8.0×10-6mol· L-1的metMb缓冲溶液体系测得的UV-Vis吸收光谱变化曲线.结果显示AOT和SDBS对metMb具有相同的影响,下面以AOT为例说明实验结论.可以看出,在天然状态条件下,metMb溶液在409 nm(Soret带),503 nm(Q带)和630 nm(LMCT带)处有特征吸收峰,这是血红素的中心铁原子与四个吡咯环的氮原子形成配位键,第五配位结合His-93残基、第六配位结合一个水分子形成的6-cHs结构aquometMb的特征谱带.11随着AOT浓度的增加,到达2×10-4mol·L-1后,metMb的Soret带吸光度值不断减小;同时,吸收谱带向长波长方向移动(409 nm红移到约414 nm处),且536和566 nm处有新的吸收峰出现,并逐渐增强,630 nm处的LMCT带消失.意味着表面活性剂浓度的增加,6-cHS结构的metMb在逐渐消耗.536和566 nm处的新峰与高铁细胞色素b5的很相似,12是6-cLS结构的特征峰,此时蛋白质和表面活性剂之间的疏水作用和氢键破坏了水分子配体和His-64之间的氢键,His-64咪唑环上的氮原子氢键能力的减弱,已配位的水分子不再稳定,使得铁原子第六配位水分子很容易解离出来,取而代之的是His-64.aquometMb逐渐减少,6-cLs结构的hemichrome在不断生成,即His-64的咪唑环向金属中心移动,形成了双His配位复合物.13
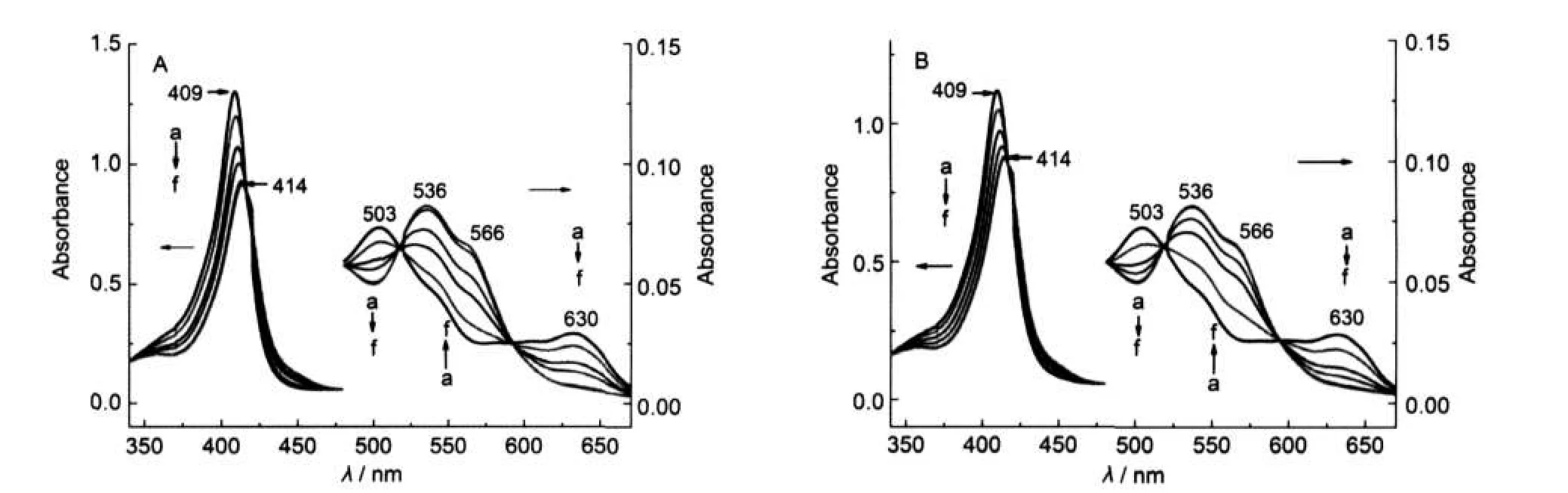
图1 AOT(A)及SDBS(B)对metMb溶液UV-Vis吸收光谱的影响Fig.1 Effects ofAOT(A)and SDBS(B)on UV-Vis absorbance spectra of metMb solutionCmetMb=8.0×10-6mol·L-1;(A)104CAOT/(mol·L-1):(a)0,(b)2.0,(c)2.4,(d)3.0,(e)3.4,(f)4.0; (B)104CSDBS/(mol·L-1):(a)0,(b)0.5,(c)0.7,(d)1.3,(e)1.5,(f)1.9
本课题组14研究发现,当咪唑与metMb分子进行配位反应时,由于这些亲核性较强的咪唑分子的引入,咪唑分子电荷通过Fe3+转移到卟啉环上,使得卟啉环上电子密度增大,a1u(π)轨道能量增加,与间的能量差减小,激发能降低,因此His-64咪唑环与血红素中心铁原子的配位可以造成Soret带的红移.另外,在谱图中416 nm产生了一个等吸光点,说明此时体系中metMb和所形成的复合物具有相同的吸光度值.metMb的等电点(pI)是6.99,PB缓冲液的pH是7.4,所以metMb整体呈现负电性,其与阴离子表面活性剂之间存在静电斥力,表面活性剂浓度升高时,疏水作用随后形成.15AOT/SDBS存在时,占主导作用的静电力使得血红素周围环境变化,破坏组氨酸咪唑环和水分子之间的氢键,从而诱导hemichrome的形成.
对于Mb的同步荧光光谱,Δλ=60 nm时主要是Trp残基的特征发射峰,Δλ=20 nm时则主要显示Tyr残基的荧光.16图2A是AOT与metMb作用时Δλ=60 nm的同步荧光光谱,可以看出,随着AOT浓度的增加,339 nm处荧光峰和351 nm处的肩峰荧光强度均规律性地增加,且339 nm处的荧光峰红移了3 nm.天然状态下,metMb血红素近端存在的Trp-7和Trp-14使得每个Trp的荧光部分猝灭,Trp到血红素的有效能量转移也被削弱,故metMb中的Trp在缓冲溶液中荧光强度很低.17AOT浓度逐渐升高时表面活性剂的疏水链渗入到疏水腔,Trp极性不断增强,并逐渐从疏水环境中暴露出来,heme周围环境的极性也有一定程度的增加,因此,Trp和血红素之间的荧光猝灭反应被减弱,metMb中的Trp荧光强度逐渐增强.图3A显示的是SDBS对metMb的Trp荧光强度影响,与AOT影响作用相同.造成图2A中351 nm处肩峰越来越明显的原因是双His配位体系的形成对metMb中Trp-7和Trp-14残基微环境极性的影响不同.14图2B和图3B所示的是Tyr的荧光强度变化,在天然态时,metMb的Tyr与Trp和血红素之间能量传递,有效地猝灭了Tyr自身的发射强度,而AOT/SDBS的加入使得Tyr的微环境发生变化,与Trp和heme的距离变远,所以荧光强度不断增强;18metMb发射峰越来越不明显,我们认为是蛋白表面Tyr-103的Ph-OH基团在阴离子型表面活性剂存在时,变成Ph-O-形式,它在大约307 nm处的峰越来越尖,重叠峰使得311 nm处的最大发射峰趋于平缓.图3B中约286 nm处的发射峰是SDBS浓度越来越高造成的(见图3B插图),其对311 nm处的发射峰也有一定的影响.
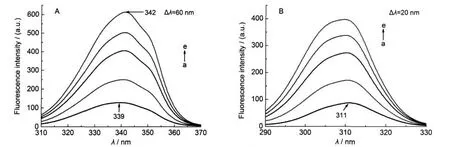
图2 AOT对metMb溶液同步荧光光谱的影响Fig.2 Effects ofAOT on synchronous fluorescence spectra of metMbCmetMb=8.0×10-6mol·L-1;104CAOT/(mol·L-1):(a)0,(b)2.4,(c)3.0,(d)3.7,(e)4.4
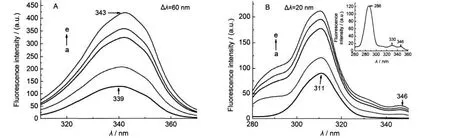
图3 SDBS对metMb溶液同步荧光光谱的影响Fig.3 Effects of SDBS on synchronous fluorescence spectra of metMbCmetMb=8.0×10-6mol·L-1;104CSDBS/(mol·L-1):(a)0,(b)0.6,(c)1.3,(d)1.5,(e)1.9
3.2 阳离子型表面活性剂
图4A是用5×10-2mol·L-1的CTAB滴定浓度为8×10-6mol·L-1的metMb的UV-Vis吸收光谱.可以看出,在CTAB浓度小于2×10-4mol·L-1时,并没有使metMb出现Soret带的红移现象,也没有出现规则的Q带新峰,相反,随着CTAB浓度的增加,Soret带没有伴随着吸收强度的降低而发生移动,与此同时,630 nm处LMCT带的吸收峰逐渐被掩盖.当CTAB浓度达到2.25×10-4mol·L-1后,Soret带蓝移至约400 nm,浓度继续增加,603 nm处heme单体的特征吸收峰出现,19意味着Fe-His-93位的键断裂,底物配位由羟基替代,5-cHs的血红素结构生成,也就是heme从metMb分子中脱离出来.与阴离子型表面活性剂相比,CTAB可以直接作用于metMb的血红素中心,并不与His-64作用或作用很小,没有形成6-cLs的hemichrome结构,而是使aquomet Mb中的血红素脱离出来.
同为阳离子型表面活性剂,DTAB与CTAB对metMb的UV-Vis吸收光谱影响作用具有一些共同特征:随着DTAB浓度的升高,出现了603 nm处的heme特征峰(见图4B),与metMb的作用也没有使蛋白形成6-cL结构.但由于metMb的等电点和卟啉环结构,以及DTAB自身结构特点等原因,反映其有自己的光谱特征,且DTAB的临界胶束浓度(cmc)值比CTAB的高,所以作用浓度也较CTAB大(所用DTAB的滴定浓度为1 mol·L-1).DTAB浓度小于5.5×10-4mol·L-1时,促使metMb的Soret带发生少许红移(约1.5 nm),630 nm的LMCT带被掩盖,且出现明显的527和563 nm的小峰,表明此时形成了一个中间态,具体是什么结构还有待进一步研究.继续增大DTAB的浓度,522和563 nm处的峰强度逐渐减小,在603 nm处heme单体特征峰也出现,表明heme从疏水腔解离出来.对于阳离子表面活性剂而言,浓度低于其临界胶束浓度时,其单体形式的分子对吸收光谱没有影响,浓度高时形成聚合体或胶束才能与蛋白发生作用.20另外,在实验所用的缓冲体系中,metMb卟啉环外露的羧酸根电离,蛋白整体呈负电性,其与阳离子型表面活性剂之间存在强烈的静电吸引作用,再加上随后的疏水作用,15所以DTAB和CTAB对metMb的作用比AOT和SDBS强,可以使metMb中心的heme从疏水腔中解离出来.

图4 CTAB(A)及DTAB(B)对metMb溶液UV-Vis吸收光谱的影响Fig.4 Effects of CTAB(A)and DTAB(B)on UV-Vis absorbance spectra of metMbCmetMb=8.0×10-6mol·L-1;(A)104CCTAB/(mol·L-1):(a)0,(b)1.25,(c)2.00,(d)2.25,(e)2.50,(f)3.00,(g)3.50,(h)10.00,(i)12.00; (B)104CDTAB/(mol·L-1):(a)0,(b)4.0,(c)4.5,(d)5.0,(e)5.5,(f)7.0,(g)10.0,(h)12.0,(i)14.0
图5A和5B分别是用5×10-2mol·L-1CTAB滴定8.0×10-6mol·L-1的metMb在Δλ=60 nm和Δλ=20 nm时的同步荧光光谱.由于CTAB对于metMb的同步荧光光谱影响较强,所以检测时用的灵敏度选择low.当CTAB浓度较低(小于1×10-4mol·L-1)时,对metMb的Tyr和Trp微环境就能产生较强影响,荧光强度显著增强,且伴随着最大发射峰的红移,Trp的荧光强度变化更强一些.Δλ=60 nm时也出现351 nm的肩峰,形成的配位体系同样对metMb中Trp-7和Trp-14残基微环境极性的影响不同.CTAB的浓度逐渐增大,形成越来越多的胶束,胶束的形成可以降低Trp和血红素之间的能量传递,表面疏水血红素被溶解在胶束的疏水腔中,使得血红素和Trp之间的距离越来越远,他们之间的能量传递也被削弱,根据Förster能量转移理论,Trp与血红素之间的距离增加将使得血红素的荧光被减弱,metMb的荧光强度增加也变得缓慢.10同理,DTAB也使得metMb中的Trp荧光强度越来越强(见图6A),由于DTAB的cmc值较高,所以对蛋白Trp微环境影响所需浓度比CTAB要高.图5B和图6B显示Tyr的微环境也受到影响,最大发射峰也发生红移,极性增强;随着CTAB和DTAB的升高,最大发射峰仍很明显,并没有变得越来越平缓,是因为阳离子型表面活性剂存在时,Tyr-103上的Ph-OH并没有变成Ph-O-形式.最大发射峰有少许红移,说明Trp暴露到更强的极性环境中.与AOT和SDBS相比,CTAB和DTAB对metMb芳香族氨基酸微环境的影响更强,浓度不断增高时可以使血红素逐渐暴露.
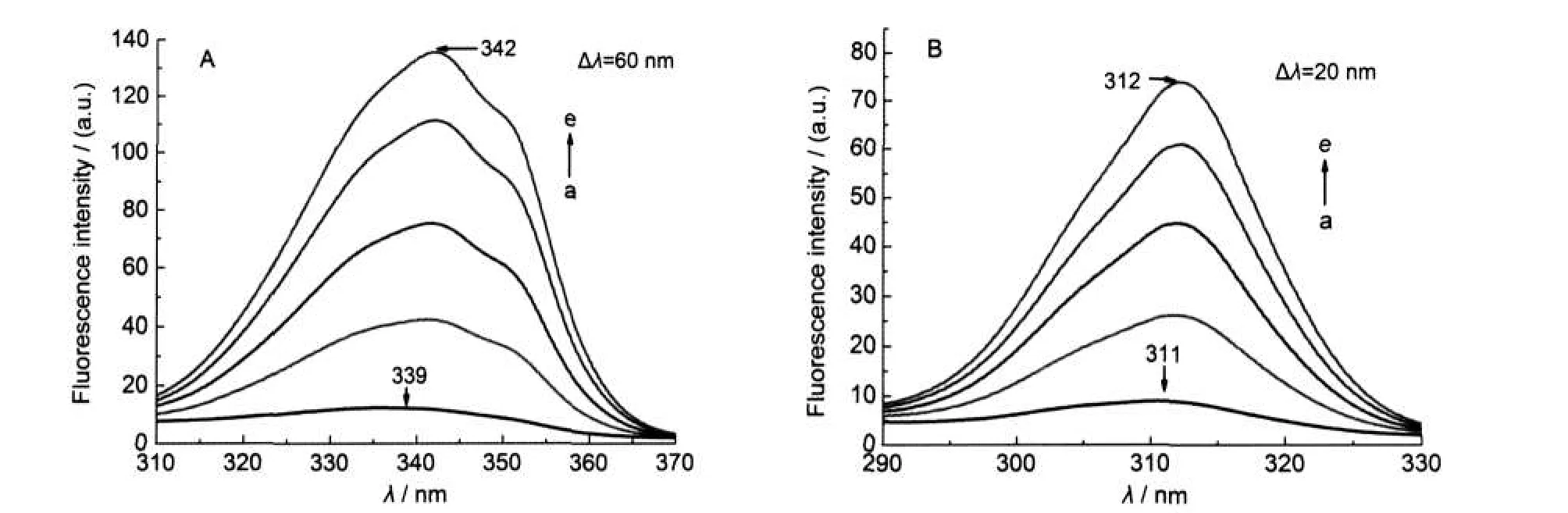
图5 CTAB对metMb溶液同步荧光光谱的影响Fig.5 Effects of CTAB on synchronous fluorescence spectra of metMbCmetMb=8.0×10-6mol·L-1;104CCTAB/(mol·L-1):(a)0,(b)1.0,(c)2.0,(d)5.0,(e)12.0
3.3 两性离子型表面活性剂
CHAPS是一种两性离子型表面活性剂,具有阴、阳两种离子性质,但在中性pH环境中呈非电离子性质.图7A显示了CHAPS对metMb UV-Vis吸收光谱的影响,可以看出CHAPS浓度达到6.1×10-3mol·L-1,检测结果显示其对metMb仍没有直接的作用,对Soret带、Q带及LMCT带均没有影响,不会形成hemichrome或者5-cLs的结构.此结果的主要原因是CHAPS在中性条件下成非电离子性质,整体呈电中性,降低了与蛋白质的阴离子性或者阳离子性位点作用的能力,同时也表明在中性pH条件下, metMb的阴离子位点和阳离子位点之间的距离相对较远.21如果这些位点相对近一些,CHAPS应该比阴离子型或阳离子型表面活性剂对蛋白有更强的作用,因为每个CHAPS分子都既含有阴离子结合位点也含有阳离子结合位点,可以同时与蛋白有两种离子作用.整体呈电中性,CHAPS的这种两性离子性质降低了作为任何一种电荷性质与metMb之间的作用.没有静电作用时,表面活性剂与蛋白之间的疏水作用很弱,且难形成.
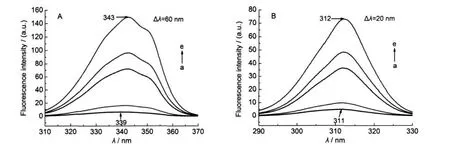
图6 DTAB对metMb溶液同步荧光光谱的影响Fig.6 Effects of DTAB on synchronous fluorescence spectra of metMbCmetMb=8.0×10-6mol·L-1;(A)103CDTAB/(mol·L-1):(a)0,(b)3.0,(c)4.0,(d)5.0,(e)12.0
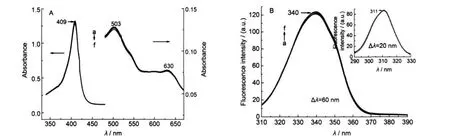
图7 CHAPS对metMb溶液UV-Vis吸收光谱(A)和同步荧光光谱(B)的影响Fig.7 Effects of CHAPS on UV-Vis absorbance(A)and synchronous fluorescence spectra(B)of metMbCmetMb=8.0×10-6mol·L-1;103CCHAPS/(mol·L-1):(a)0,(b)0.49,(c)1.5,(d)2.4,(e)4.3,(f)6.1
图7B为CHAPS对metMb同步荧光光谱图,同紫外结果一致,其浓度达到6.1×10-3mol·L-1,Δλ=60 nm和Δλ=20 nm(插图)时,metMb同步荧光光谱均没有发生变化,也就是血红素周围微环境和芳香族氨基酸Tyr和Trp的微环境均不受其影响,CHAPS与metMb基本没有发生作用或作用很小.
另外,非离子表面活性剂没有离子性质,也不会与蛋白质发生静电作用,与蛋白没有直接的相互作用所以也不会是蛋白结构发生变化.22
3.4 各类表面活性剂对蛋白质二级结构影响
UV-Vis吸收光谱主要集中于研究血红素口袋周围环境变化,同步荧光光谱研究的是芳香族氨基酸微环境的变化,为了更深一步了解表面活性剂与蛋白质之间的作用过程,我们用远紫外区圆二色谱(CD)技术检测了metMb的二级结构变化情况,并用杨氏方程算法23计算Mb中的α螺旋、β折叠等含量变化.图8A为metMb与AOT反应的远紫外CD谱图,在208和222 nm两个负槽,反映的是α螺旋的光谱特性.24可以很明显地看出,随着AOT浓度的升高,负槽的强度逐渐减弱,metMb的α螺旋含量从74%减少到63%,同时,β折叠含量增加了近14%.同紫外-可见图谱检测的结果相对应,AOT改变metMb蛋白的血红素中心配位的同时也改变蛋白的二级结构,但形状和肩峰的位置未发生明显改变,整个蛋白分子结构依然以α螺旋为主,说明蛋白在测定范围内没有变性,但是结构有较大变化(大于5%).这主要是由于AOT结合到metMb表面,使蛋白伸展并暴露出疏水残基,干扰蛋白的螺旋结构,更多的β折叠及无规则卷曲可溶性暴露结构出现,同属于阴离子型表面活性剂的SDBS对蛋白的二级结构影响规律也如此(图未给出).
图8B是CTAB滴定metMb得到的CD谱图,结果显示CTAB浓度为1×10-4mol·L-1时,metMb的二级结构已经发生很大变化,比阴离子型表面活性剂对蛋白的二级结构影响更强一些,α螺旋含量减少幅度也较大,继续增大CTAB浓度,血红素从疏水口袋逐渐暴露出来的同时,蛋白的整个二级结构也发生变化,整个过程中α螺旋含量减少了近20%,β折叠含量增加了34%,但蛋白骨架结构仍以α螺旋为主.DTAB浓度的升高也会使得蛋白的α螺旋含量减少,趋势与CTAB的相似(图未给出).
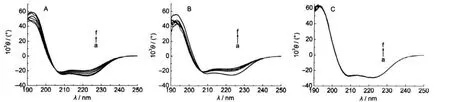
图8 metMb与AOT(A)、CTAB(B)及CHAPS(C)相互作用的CD谱图Fig.8 CD spectra of interactions of metMb withAOT(A)、CTAB(B)and CHAPS(C)CmetMb=8.0×10-6mol·L-1;(A)104CAOT/(mol·L-1):(a)0,(b)1.3,(c)5.4,(d)6.7,(e)8.1,(f)9.4; (B)104CCTAB/(mol·L-1):(a)0,(b)1.0,(c)2.0,(d)4.0,(e)8.0,(f)10.0;(C)103CCHAPS/(mol·L-1):(a)0,(b)0.49,(c)1.5,(d)2.4,(e)4.3,(f)6.1
图8C显示在测定的浓度范围内,加入CHAPS前后,此metMb的二级结构没有变化,以α螺旋结构为主,此结果同紫外、荧光光谱结果一致,充分说明CHAPS没有与metMb发生相互作用,对蛋白质的天然状态不产生影响.
4 结论
当溶液的pH值大于蛋白质的等电点时,蛋白质表面呈现负电性,所以其与不同类型的表面活性剂作用所呈现的性质不同.本文在模拟人体的弱碱性缓冲体系(pH 7.4)中比较研究了三类表面活性剂与metMb相互作用的不同机理.阴、阳离子型表面活性剂通过静电作用和疏水作用,主要是静电作用,与metMb都发生了直接相互作用,且改变metMb中心卟啉环的微环境.阳离子型表面活性剂的作用更强一些,这种改变依赖于表面活性剂的浓度,而两性离子表面活性剂CHAPS对蛋白质的结构基本不产生影响.阴、阳离子型表面活性剂也表现出不一样的特征,AOT和SDBS主要通过静电斥力将aquometMb转变成hemichrome结构,且对Trp和Tyr的微环境均有影响,同时影响metMb的二级结构,使其α螺旋含量逐渐减少,β折叠含量增加;阳离子表面活性剂CTAB和DTAB与metMb的作用更强一些,主要作用力为静电吸引作用,随着表面活性剂浓度的升高,并未出现AOT和SDBS与metMb相互作用过程中产生的6-cLs配位结构,而是直接作用于血红素中心,形成5-cLs结构,最终将血红素暴露出来,且CTAB和DTAB对metMb的Tyr和Trp微环境作用强度也比AOT和SDBS强,对metMb的二级结构也影响也很大.CHAPS在中性pH条件下整体呈电中性,结果显示其对metMb血红素微环境、芳香族氨基酸及二级结构基本没有影响,可以保护蛋白的天然状态.
(1) Orioni,B.;Roversi,M.;La Mesa,C.;Asaro,C.;Asaro,F.; Pellizer,G.;Errico,G.D.J.Phys.Chem.B 2006,110,12129.
(2) Stenstam,A.;Montalvo,G.;Grillo,I.;Gradzielski,M.J.Phys. Chem.B 2003,107,12331.
(3) Kaca,W.;Roth,R.I.;Vandegriff,K.D.;Chen,G.C.;Kuypers, F.A.;Winslow,R.M.;Levin,J.Biochemistry 1995,34,11176.
(4)Rupon,J.W.;Domingo,S.R.;Smith,S.V.;Gummadib,B.K.; Shields,H.;Ballas,S.K.;King,S.B.;Kim-Shapiro,D.B. Biophys.Chem.2000,84,1.
(5) Ray,A.;Friedman,B.A.;Friedman,J.M.J.Am.Chem.Soc. 2002,124,7270.
(6) Sadrzadeh,S.M.;Graf,E.;Panter,S.S.;Hallaway,P.E.;Eaton, J.W.J.Biol.Chem.1984,259,14354.
(7) Chakraborty,T.;Chakraborty,I.;Moulik,S.P.;Ghosh,S. Langmuir 2009,25,3062.
(8) Sau,A.K.;Currell,D.;Mazumdar,S.;Mitra,S.Biophys.Chem. 2002,98,267.
(9)Ajloo,D.;Moosavi-Movahedi,A.A.;Hakimelahi,G.H.; Saboury,A.A.;Gharibi,H.Colloid Surf.B:Biointerfaces 2002,26,185.
(10) Liu,W.J.;Guo,X.;Guo,R.Int.J.Biol.Macromol.2007,41, 548.
(11) Eaton,W.A.;Hochstrasser,R.M.J.Chem.Phys.1968,49,985.
(12) Strittmatter,P.;Velick,S.F.J.Biol.Chem.1956,221,253.
(13) Moreira,L.M.;Poli,A.L.;Costa-Filho,A.J.;Imasato,H. Biophys.Chem.2006,124,62.
(14) Zhou,H.W.;Cao,H.Y.;Tang,Q.;Li,J.J.;Zheng,X.F.Chin. J.Inorg.Chem.2011,27,445.[周华伟,曹洪玉,唐 乾,李进京,郑学仿.无机化学学报,2011,27,445.]
(15) Miller,R.;Alahverdjieva,V.S.;Fainerman,V.B.Soft Matter 2008,4,1141.
(16) Jian,J.;Du,J.Y.;Feng,Y.Y.;Yang,X.J.;Lu,T.H.Chin.J. Anal.Chem.2001,29,219.[剑 菊,杜江燕,冯玉英,杨秀娟,陆天虹.分析化学,2001,29,219.]
(17) Santiago,P.S.;Moreira,L.M.;Almeida,E.V.;Tabak,M. Biochim.Biophys.Acta 2007,1770,506.
(18) Tofani,L.;Feis,A.;Snoke,R.E.;Berti,D.;Baglioni,P.; Smulevich,G.Biophys.J.2004,87,1186.
(19) Boffi,A.;Das,T.K.;Longa,S.;Spagnuolo,C.;Rousseau,D.L. Biophys.J.1999,77,1143.
(20)Angersen,K.K.;Westh,P.;Otzen,D.E.Langmuir 2008,24, 399.
(21)Moreira,L.M.;Santiago,P.S.;Almeida,E.V.;Tabak,M. Colloid Surf.B:Biointerfaces 2008,61,153.
(22) Savelli,G.;Spreti,N.;Profio,P.D.Curr.Opin.Colloid Interface Sci.2000,5,111.
(23) Chen,Y.H.;Yang,J.T.;Chau,K.H.Biochemistry 1974,13, 3335.
(24) Taheri-Kafrani,A.;Asgari-Mobarakeh,E.;Bordbar,A.K.; Haertlé,T.Colloid Surf.B:Biointerfaces 2010,75,268.
July 29,2011;Revised:October 2,2011;Published on Web:October 13,2011.
Interactions between Different Classes of Surfactants and Metmyoglobin
ZHANG Ying-Ying1CAO Hong-Yu1,2TANG Qian1,2ZHENG Xue-Fang1,2,*
(1School of Life Science and Biotechnology,Dalian University,Dalian 116622,Liaoning Province,P.R.China;2Liaoning Key Laboratory of Bioorganic Chemistry,Dalian University,Dalian 116622,Liaoning Province,P.R.China)
Complexes of horse metmyoglobin(metMb)with the anionic surfactants sodium bis(2-ethylhexyl)sulfosuccinate(AOT)and sodium dodecyl benzene sulfonate(SDBS),the cationic surfactants dodecyl trimethylammonium bromide(CTAB)and dodecyltrimethyl ammonium bromide(DTAB),and the zwitterionic surfactant3-[(3-cholamidopropyl)dimethylammonio]propanesulfonate (CHAPS)were investigated by UV-Vis absorption,synchronous fluorescence emission,and circular dichroism(CD) spectroscopy.Experimental results show that the anionic and cationic surfactants can interact with metMb intensively depending on the surfactant concentration.The UV-Vis spectra indicate that AOT and SDBS interact with metMb at low concentrations.The addition of AOT(or SDBS)causes the formation of a six-coordinated low-spin heme(6-cLs)hemichrome as is evident from the red shift of the Soret band,the intensity decrease,concomitant appearance of two new Q bands,and the disappearance of ligandto-metal charge transfer(LMCT).The surfactants disturb the Tyr and Trp microenvironment and change the second structure parameter of metMb while the α-helix content decreases.However,the interaction between metMb and CTAB(or DTAB)is different.They cannot disturb heme at very low concentrations but can disturb the Tyr and Trp microenvironment.CTAB and DTAB aggregates can convert metMb to a five-coordinated low-spin heme as shown by the blue shift of the Soret band and cause the heme monomer to leave the hydrophobic cavity of metMb through electrostatic attraction mainly.DTAB/metMb complexes behave in a slightly different way to CTAB/metMb because of their special structure.In contrast,no interaction is evident between the zwitterionic surfactant over a large range of concentrations because of the neutral charge of CHAPS,which precludes an effective electrostatic attraction between the ionic sites of CHAPS and a protein.The significant distance between the ionic sites with opposite charges in metMb precludes a double ionic interaction for each CHAPS surfactant molecule despite the presence of two oppositely charged ionic sites in the CHAPS molecule.Therefore,proteins interact with surfactants in multifarious ways and this depends on the surfactant species,concentration,and structure.
Anionic surfactant;Cationic surfactant;Zwitterionic surfactant;Metmyoglobin; Spectrometry
10.3866/PKU.WHXB20112907
∗Corresponding author.Email:dlxfzheng@126.com;Tel:+86-411-87403720.
The project was supported by the National Natural Science Foundation of China(20871024),Project for Liaoning Innovation Teams in University, China(2006T002,2008T005,2009T003),Research Foundation of Education Bureau of Liaoning Province,China(2009A069,2009A071),and Project for Dalian Science and Technology,China(2008E11SF170).
国家自然科学基金(20871024),辽宁省高校创新团队(2006T002,2008T005,2009T003),辽宁省教育厅(2009A069,2009A071)和大连市科技计划(2008E11SF170)资助项目
O648;O629.73
