冷热激黄瓜的保鲜效果对比及生物传热分析
2011-12-06尹海蛟陈爱强
尹海蛟, 杨 昭,陈爱强,张 娜
(天津大学热能研究所,天津 300072)
果蔬的冷、热激处理是指对采后果蔬进行不致发生冷害或高温热损伤的短时温度逆境胁迫处理,具有无毒、无污染、无残留等优点,目前受到了国内外学者的广泛关注.大量的研究表明,果蔬冷激及热激处理均能不同程度地调节果蔬生理代谢,减轻果蔬冷害,延缓果蔬衰老并延长其货架期[1-6].Mccollum 等[1]指出热激处理能够减轻黄瓜的冷害,并降低呼吸速率.Wang[2]研究表明热激处理可以提高果蔬体内活性氧清除酶的活性,抑制活性氧的积累和膜脂过氧化.Lurie 等[3]发现热激处理时,果实的成熟基因mRNA 消失,而热激蛋白(heat shock proteins,HSPs)不断积累.与热激相比,果蔬冷激研究相对较少,20世纪70 年代末,Ogata 等[4]最早发现用0 ℃冰水短时间处理冷敏感果实有助于延缓果实后熟.Makoto 等[5]研究指出冷激处理能够显著延长西红柿的货架期,并有效抑制其颜色变化.熊兴淼等[6]发现冷激处理能够推迟桃果实的乙烯释放及呼吸高峰.
国内外有关果蔬采后温度处理技术的研究大多着眼于冷热激处理对果实保鲜效果的影响,而从热物理角度分析其作用机理的较为罕见,并且研究多采用冷激或热激处理中的一种,而同时对冷激与热激处理对果实保鲜效果影响的对比研究鲜见报道.笔者以黄瓜为试材,对冷热激处理黄瓜的保鲜效果进行对比试验,并从生物传热学角度分析冷热激黄瓜的组织传热规律及对温度变化的动态响应,旨在为黄瓜采后温度处理方法的选择及工艺参数的确定提供指导.
1 材料与方法
1.1 试验材料
以 “津优10”(Jinyou 10)黄瓜为试材.黄瓜产于天津蓟县,于2010 年9 月20 日清晨采收,采后立即运回实验室.选择大小均一、色泽饱满、无病虫害、无机械损伤、成熟度一致的黄瓜备用.
1.2 处理方法
将黄瓜随机分为7 组,每组约15 kg.第1 组为冷藏对照组(CK);第2 组在0,℃冰水混合物中冷激20,min(C1);第3 组在0,℃冰水混合物中冷激40,min(C2);第4 组在0,℃冰水混合物中冷激60,min(C3);第5 组在40,℃的热水中热激20,min(H1);第6 组在40,℃热水中热激40,min(H2);第7 组在40,℃热水中热激60,min(H3).处理完毕后,各组黄瓜均放置于温度为8,℃、相对湿度为90%、风速为1.2,m/s 的冷库内贮藏.
1.3 品质指标测定
1.3.1 失重率
以全重称量法测量失重率.
1.3.2 硬 度
使用GY-3 型果蔬硬度计测量黄瓜中段位置去皮后的硬度.硬度计探头直径为1,cm,压入深度为1,cm,下行速度为1.0,mm/s.每次测定3 个样品,取平均值.
1.3.3 色 差
采用WSC-S 型色差计(上海精密仪器有限公司)测量黄瓜表面颜色,并选择Hunter 表色空间(颜色指标包括亮度L、红绿度a 和黄蓝度b).颜色测量在各处理组中固定的3 根黄瓜中段位置标记部位处进行,并根据式(1)计算色差值ΔEab,其中下标0 代表贮藏开始时的量.

1.3.4 POD 活性
采用愈创木酚法测定过氧化物酶(peroxidase,POD)的活性[7].
1.3.5 腐烂指数
根据黄瓜的腐烂面积,对其腐烂程度进行分级(见表1),每次统计10 根黄瓜的腐烂情况.
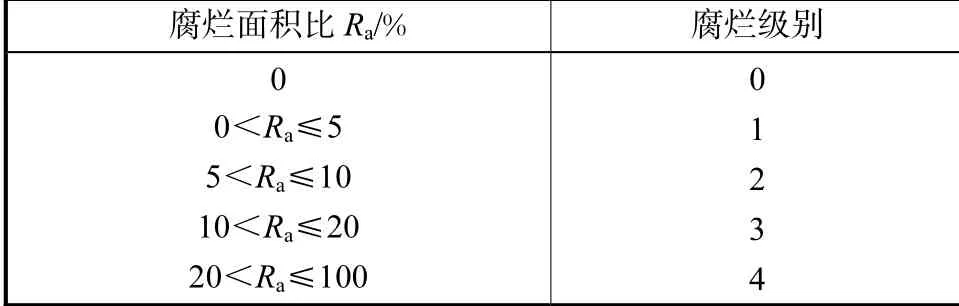
表1 腐烂分级与腐烂面积的关系Tab.1 Relationship between rot grade and rot area
腐烂指数的计算式[8]为

1.3.6 温 度
使用经标准温度计标定后的T 型热电偶(天津中环仪表厂)测量黄瓜温度.热电偶探针直径1,mm,测温精度±0.1,℃.
1.4 黄瓜温度的量化与表征
采用无因次过余温度θ对冷热激处理黄瓜的温度进行量化.无因次过余温度

式中:t为冷热激处理时的黄瓜温度,℃;tp为冷热激处理工艺温度,℃;t0为黄瓜的初始温度(20 ℃).
另外,以1/2、3/4 及7/8 处理时间对黄瓜的冷热激处理传热进程进行表征,其对应的无因次过余温度分别为θ=0.5、θ=0.25 及θ=0.125.
1.5 数据处理
应用SPSS 软件进行数据的单因素方差分析、Duncan 多重比较及聚类分析.
2 冷热激黄瓜的保鲜效果对比及分析
2.1 失重率
黄瓜组织细嫩,含水率高达85%~95%,冷藏时极易失水.由图1 可见,贮藏期内冷激组黄瓜的失重率明显低于对照组及各热激组.在各冷激组中以C2的失重率最小,贮藏第15 天时,其失重率为11.9%,分别为C1 及C3 失重率的85.6%及79.7%,是对照组(CK)的74.8%.热激处理组中,以H1 的失重率最小,并低于CK,但H1 的失重率依旧高于各冷激组;H2 及H3 的失重率显著高于CK 及各冷激组(显著性概率P<0.05),且以H3 的失重率最大,贮藏第15,天时,H3 组黄瓜明显萎蔫,失重率达19.6%,分别是CK 及C2 的1.23 及1.64 倍.
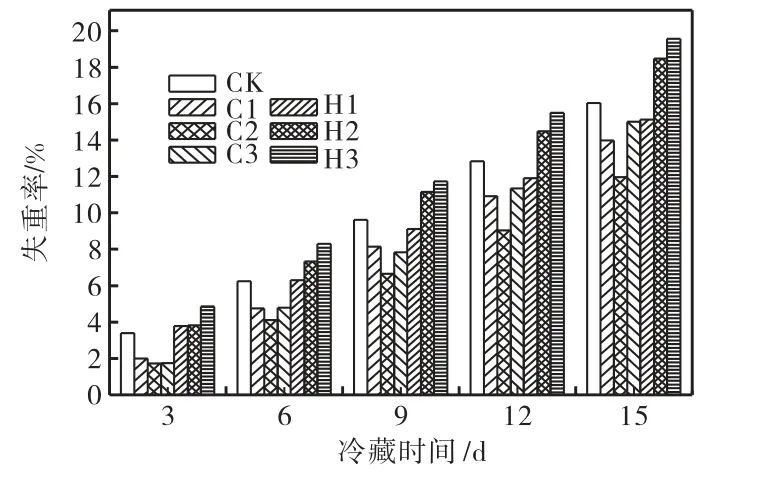
图1 各组黄瓜的失重率对比Fig.1 Comparison of weight loss rate of different treated groups of cucumber
2.2 硬 度
硬度是黄瓜的重要品质指标.由图2 可见,各试验组黄瓜的硬度在贮藏期内均有不同程度的下降,但是热激黄瓜的硬度下降较快,贮藏第3 天时,各热激组黄瓜的硬度明显低于冷激组及冷藏对照组(P<0.05);但随着贮藏期的增加,热激组黄瓜硬度的降低幅度有逐渐减小的趋势.贮藏第15 天时,H1、H2 及H3 的硬度分别下降了26.9%、27.4%及28.5%,CK 组的硬度下降了27.9%,黄瓜疲软严重.与各热激组及对照组相比,各冷激组黄瓜的硬度下降相对缓慢,贮藏第15 天时,冷激组C1、C2 及C3 的硬度分别下降了25.2%、24.6%及22.8%.
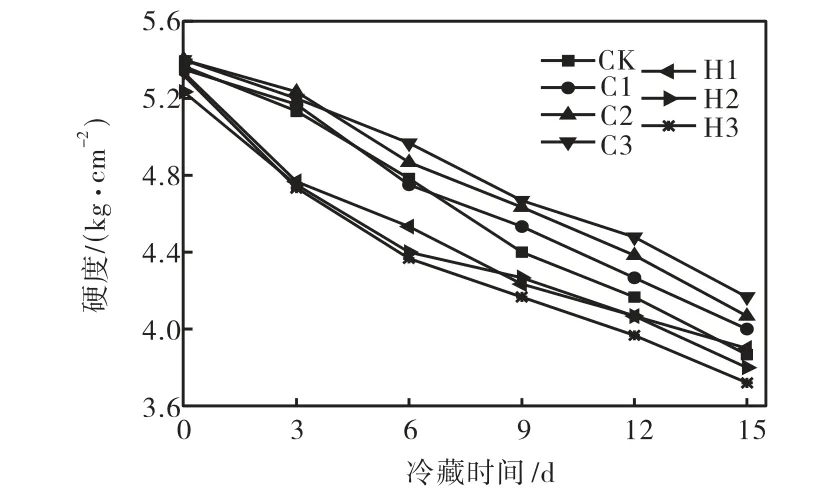
图2 各组黄瓜的硬度对比Fig.2 Comparison of firmness of different treated groups of cucumber
2.3 色 差
黄瓜的颜色直接影响着人们的消费心理,同时也是品质衰变的重要评价指标[9].由图3 可见,贮藏第3 天时,各处理组黄瓜的色差均不同程度地高于对照组CK.贮藏3,d 后,冷激组及热激H1 组的黄瓜色差虽有增加,但增速较慢;对照组CK、热激组H2 及H3 黄瓜的色差增加较快;贮藏第15 天时,H2、H3 组与各冷激组黄瓜的色差具有显著差异(P<0.05).在整个贮藏过程中,H3 组黄瓜的色差值始终显著(P<0.05)高于其他各组,其在视觉上表现出明显变暗,并失去原有的特征性绿色.乔勇进等[10]指出热激处理能够促进黄瓜体内叶绿素的代谢分解并破坏反应物的供求平衡关系,从而加速黄瓜的颜色变化.
2.4 POD活性
POD 是植物体内一类重要的膜脂保护酶,能够及时清除细胞内的O2-和H2O2,对组织和细胞具有保护作用[11-12].由表2 可见,贮藏初期,对照组和冷激处理组黄瓜的POD 活性均有一显著的应激升高,并在贮藏第3 天达到峰值;之后开始呈现不同程度的降低.冷激处理能够显著抑制POD 活性的下降,贮藏期内C1 及C2 组的POD 活性显著高于对照组.H3 组的POD 活性降低较快,贮藏第15 天时,与对照组CK 的差异显著(P<0.05).

表2 冷热激处理对黄瓜POD活性的影响Tab.2 Effects of cold and heat shock treatment on POD activities of cucumber
2.5 腐烂指数
黄瓜腐烂主要与其采后生理衰变及微生物浸染两方面有关[13].本试验发现黄瓜腐烂最先在其顶部发生,并随贮藏时间的增长不断向其他部位扩展.由图4 可见,冷激处理较热激处理能够显著降低贮藏黄瓜的腐烂,贮藏前12,d 冷激组黄瓜均未有腐烂发生,C2 组黄瓜出现腐烂的时间最晚.贮藏第21 天时,C1、C2 及C3 的腐烂指数分别为对照组CK 的77.8%、22.2%及66.7%.热激组中H3 出现腐烂的时间最早,并且腐烂指数较大,贮藏第18 天时,H3 组黄瓜已全部腐烂.H1 组腐烂指数显著低于对照组CK(P<0.05),但H2 组与对照组CK 的腐烂指数无显著差异(P>0.05).

图4 冷热激处理对黄瓜腐烂指数的影响Fig.4 Effects of cold and heat shock treatment on rot index of cucumber
3 黄瓜保鲜效果的聚类分析
为了量化比较各试验组黄瓜的保鲜效果差异,以贮藏第15 天时黄瓜的理化指标(失重率、硬度、颜色、POD 活性及腐烂指数)为度量值,采用分层聚类的统计学方法对各黄瓜组的保鲜效果进行分类.其中,样本间距离采用欧氏距离(Euclide distance),样本聚类方法采用离差平方和法(Ward’s method)[14].
聚类分析结果如图5 所示,根据黄瓜的保鲜效果,各试验组被分为两类:第1 类包括C1、C2 及H1处理组,上述3 个处理组黄瓜贮藏过程中均表现出较理想的保鲜效果,其中以C2 组的保鲜效果最好,C1与H1 的保鲜效果相当;第2 类包括CK、H2、C3 及H3,此类黄瓜的综合保鲜效果相对较差,并以H3 组的综合保鲜效果最差,H2 与对照组CK 的效果接近.
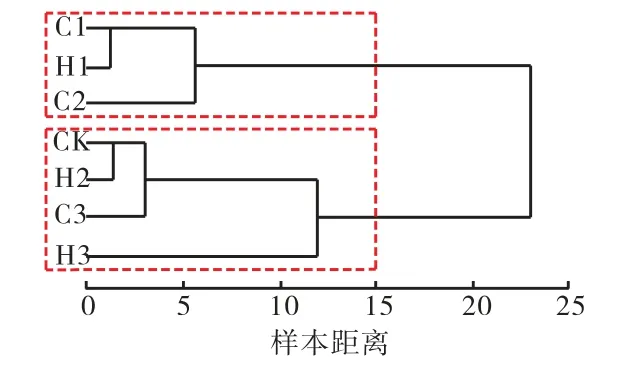
图5 各组黄瓜保鲜效果的聚类分析结果Fig.5 Cluster analysis results of freshness of different treated groups of cucumber
4 黄瓜冷热激处理的生物传热分析
4.1 实际温度变化对比与分析
黄瓜的冷热激处理均属于第3 类边界条件下的换热过程,但2 种处理方式下黄瓜的热量转移方式不同:冷激处理时,热量由黄瓜传递至冷激介质,结果表现为黄瓜温度的降低;热激处理时,热量由热激介质传递至黄瓜,结果表现为黄瓜温度的升高.由图6可见(R为黄瓜半径,R=1.9 cm),黄瓜冷、热激处理时,黄瓜表层温度变化快于深层组织,且表层温度变化较剧烈.冷热激处理开始后的2~3,min 内,黄瓜中心温度几乎没有变化,这说明黄瓜作为一种具有生命特征的生物体,其对外界温度变化的响应具有生物学的时滞效应.时滞过后,冷热激黄瓜均表现出较快的温度变化及较大的温度梯度;处理16,min 后,冷热激黄瓜的温度变化变得十分缓慢;处理45,min 后,黄瓜内外温度梯度消失,黄瓜温度基本上与处理介质温度相等.

图6 冷热激处理黄瓜的温度变化Fig.6 Temperature changes of cold and heat shock treated cucumber
4.2 无因次过余温度变化对比与分析
由图7 可见,在黄瓜初始温度相同(20,℃)、初始传热温差相等(20,℃)的条件下,冷激与热激处理黄瓜的无因次过余温度变化大体一致.这说明虽然冷激与热激处理是黄瓜能量传出与传入的正逆过程,但是黄瓜温度变化的动态特征却基本一致.7/8 处理时间(θ=0.125)以后,黄瓜的温度变化越来越慢;处理45,min 后,黄瓜与处理介质温度基本平衡.根据过余温度的动态变化特征,将7/8 处理时间(约16,min)及45,min 作为分界阈值,分别将黄瓜的冷热激处理过程划分为“发生区”、“过渡区” 及“平衡区” 3 个阶段.发生区内黄瓜温度变化剧烈,且内外温度梯度较大;过渡区内黄瓜内外仍存在一定的温差,但是传热速率已有所降低;平衡区内黄瓜与处理介质间传热温差消失,传热过程基本结束.根据上文的聚类分析结果,综合保鲜效果较好的几个处理组(H1、C1 及C2)均位于过渡区内,而处于平衡区的C3 及H3 的综合保鲜效果相对较差.
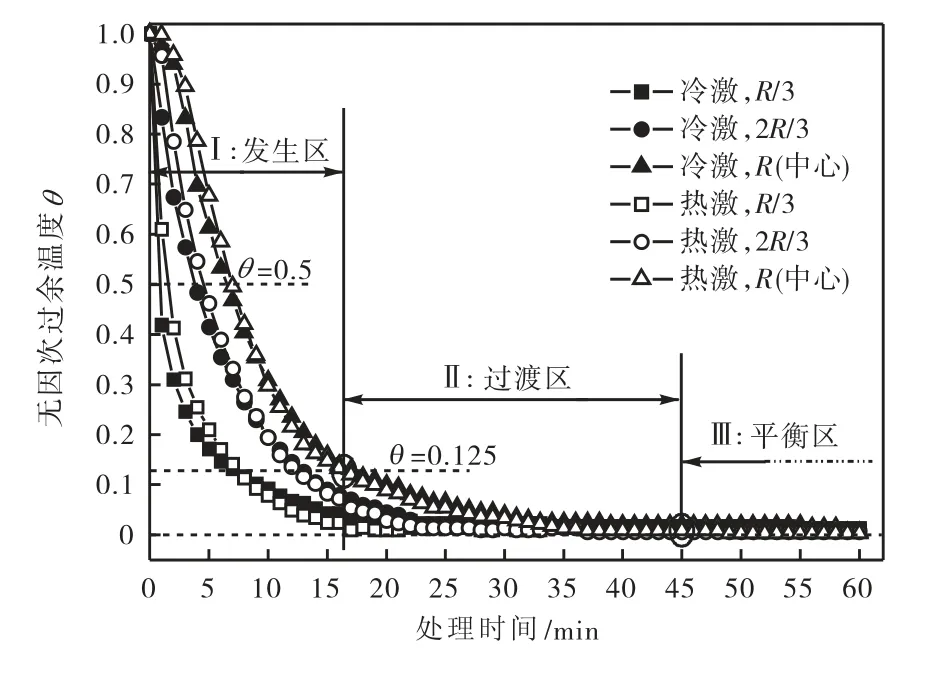
图7 冷热激黄瓜的无因次过余温度变化Fig.7 Dimensionless temperature changes of cold and heat shock treated cucumber
4.3 传热速率对比及分析
由图8 可见,冷、热激处理黄瓜中心位置的传热速率大小及动态变化特征基本吻合.由于黄瓜的生物时滞效应,外界温度变化传入到黄瓜中心位置需要一定的时间,因此,发生区内开始阶段的黄瓜的传热速率急剧上升.但随着黄瓜温度的变化,黄瓜与处理介质间的传热温差逐渐降低,使得传热速率增加到一个峰值后(约为2.5,℃/min)开始下降.位于发生区内的这种剧烈温度变化及组织间较大的温度梯度可能是黄瓜对冷热激处理产生生物学应激效应的根本原因.因此,黄瓜理想的冷热激处理时间应保证大于发生区时段(即大于7/8 处理时间),以保证黄瓜完全吸收冷热处理时的温度“激” 化效果.
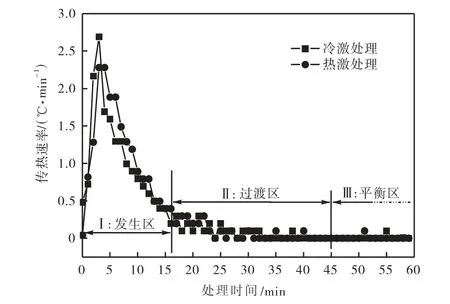
图8 冷热激黄瓜中心位置的传热速率变化Fig.8 Heat transfer rate changes in central position of cold and heat shock treated cucumber
5 结 语
能量过程是生命系统中的基本过程,黄瓜冷激与热激处理的实质是热量快速转移的过程,冷激处理时黄瓜释放热量,热激处理时黄瓜吸收热量.根据冷热激黄瓜的温度变化特征,将处理过程划分为发生区(0~16,min)、过渡区(16~45,min)及平衡区(45,min以后),冷、热激作用主要在发生区内完成,表现为黄瓜温度的剧烈变化及组织间较大的温度梯度.过渡区内黄瓜已经充分累积了发生区的激化效应,并对黄瓜的生物节律产生了影响.平衡区内黄瓜与处理介质间已无能量交换,黄瓜温度基本稳定.试验发现处理时间位于过渡区的冷热激黄瓜组C1(0,℃冷激20,min) 、C2(0,℃冷 激40,min) 及H1(40,℃热 激20,min)均取得了较好的保鲜效果,但是位于过渡区的H2(40,℃热激40,min)保鲜效果相对较差,说明冷激与热激这2种不同的温度处理方式对黄瓜生物学的影响具有一定差异.长时间的冷热激处理C3(0,℃冷激60,min)与H3(40,℃热激60,min)的保鲜效果相对较差,这可能与黄瓜处于温度逆境的时间过长有关.
总体来看,冷激处理较热激处理更有利于黄瓜的采后保鲜.在各冷激组中,以0,℃冰水混合物冷激处理40,min 黄瓜的保鲜效果最佳.该处理方式能够有效降低黄瓜贮藏期间的失重,维持较好的颜色与硬度,并明显延缓黄瓜的采后衰老与腐烂.
[1]Mccollum T,Doostdar H,Mayer R. Immersion of cucumber fruit in heated water alters chilling-induced physiological changes[J].Postharvest Biology and Technology,1995,6(1):55-64.
[2]Wang C Y. Effect of temperature preconditioning on catalase,peroxidase and superoxide dismutase in chilled zucchini squash[J].Postharvest Biology and Technology,1995,5(1/2):67-76.
[3]Lurie S,Handros A,Fallik E. Reversible inhibition of tomato fruit gene expression at high temperature[J].Plant Physiology,1996,110(4):1207-1214.
[4]Ogata K,Sakamoto T. Cold-shock effect on keeping quality of Japanese apricot fruit and tomato fruit[J].St Inst Hort Kyoto University,1979(9):146-150.
[5]Makoto I,Philip G. Cold-shock treatment of mature green tomatoes to delay color development and increase shelflife during room temperature storage[J].Proc Fla State Hort Soc,1986,99:143-145.
[6]熊兴淼,饶景萍,戴思琴,等. 冷激处理对油桃贮藏品质和抗氧化酶活性的影响[J]. 西北植物学报,2006,26(3):473-477.Xiong Xingmiao,Rao Jingping,Dai Siqin,et al. Effect of cold shock treatment on the quality and anti-oxidative enzyme activities of nectarine fruits during storage[J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(3):473-477(in Chinese).
[7]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2007.Cao Jiankang,Jiang Weibo,Zhao Yumei.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M]. Beijing:China Light Industry Press,2007(in Chinese).
[8]David E W,Barbara J S,Joey P Q,et al. Fungicide management strategies for control of strawberry fruit rot diseases in Louisiana and Mississippi[J].Crop Protection,2007,26(9):1449-1458.
[9]Efinia K D,Stella P,Petros S T. Kinetic study of the effect of the osmotic dehydration pre-treatment to the shelf life of frozen cucumber[J].Innovative Food Science and Emerging Technologies,2008,9(4):542-549.
[10]乔勇进,冯双庆,赵玉梅. 热处理对黄瓜贮藏冷害及生理生化的影响[J]. 中国农业大学学报,2003,8(1):71-74.Qiao Yongjin,Feng Shuangqing,Zhao Yumei. Effect of heat treatment on chilling injury and physiological responses of cucumber during low temperature storage[J].Journal of China Agricultural University,2003,8(1):71-74(in Chinese).
[11]Zhang Z,Kohei N,Shigenori M. Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures[J].Postharvest Biology and Technology,2009,54(2):101-105.
[12]Gustavo A M,Pedro M C. Effect of heat treatments on gene expression and enzyme activities associated to cell wall degradation in strawberry fruit[J].Postharvest Biology and Technology,2008,49(1):38-45.
[13]Hironobu T,Nobuyuki K,Gyeong P H,et al. Lowtemperature storage of cucumbers induces changes in the organic acid content and in synthase activity[J].Postharvest Biology and Technology,2010,58(2):129-134.
[14]薛 毅,陈立萍. 统计建模与R 软件[M]. 北京:清华大学出版社,2006.Xue Yi,Chen Liping.Statistic Modeling and R Software[M]. Beijing:Tsinghua University Press,2006(in Chinese).
