脉冲辐解研究吩噻嗪与CCl3OO•、•OH的反应
2011-11-30唐睿智李海霞刘艳成王文锋
唐睿智 张 鹏 李海霞 刘艳成 王文锋
脉冲辐解研究吩噻嗪与CCl3OO•、•OH的反应
唐睿智1,2张 鹏1,2李海霞1,2刘艳成1,2王文锋1,*
采用纳秒级脉冲辐解技术研究了吩噻嗪与CCl3OO•、•OH的反应,提出了相应的反应机理,得到了相关的反应速率常数.研究结果表明:吩噻嗪与CCl3OO•、•OH反应得到的瞬态产物的最大吸收峰都位于380 nm左右,该吸收峰归属于CCl3OO•、•OH夺取吩噻嗪氮原子上的氢而产生的吩噻嗪氮自由基.吩噻嗪与CCl3OO•、•OH反应的速率常数分别为1.1×109和4.0×109L·mol-1·s-1.这些结果将为进一步研究吩噻嗪的抗氧化活性提供理论基础.
抗氧化剂;吩噻嗪;三氯甲基过氧自由基;羟基自由基;脉冲辐解
1 引言
活性氧自由基(ROS)是生物体细胞在新陈代谢的过程中或者受到电离辐射等外因产生的.Harman1提出的自由基衰老理论指出生物体的衰老是由于ROS对细胞成分的有害进攻引起的.在生物体中四氯化碳(CCl4)是肝脏的选择性毒剂,它可以通过细胞色素P450的脱卤还原作用生成三氯甲基自由基(CCl3•),在有氧条件下,CCl3•可以与氧气迅速结合生成三氯甲基过氧自由基(CCl3OO•).CCl3OO•可以与DNA、蛋白质和脂类等生物分子发生反应而对细胞造成损伤.2此外,由于CCl3OO•和脂质过氧自由基的性质是相似的,而且可以方便地在水/醇体系中产生,所以CCl3OO•经常用作过氧自由基的研究模型.3羟基自由基(•OH)是生物体细胞受电离辐射和化学损伤过程产生的一种有害的强氧化性物种,4它也可以与DNA、蛋白质等生物分子反应而产生碱基自由基导致DNA的断裂和蛋白质的交联聚合.5-7因此,寻找有效的外源性抗氧化剂,对于保护细胞免受ROS损伤具有十分重要的意义.
目前研究的大多数抗氧化剂为含有O-H键的酚类化合物,酚羟基清除自由基的机理已通过化学动力学方法研究得较多,8-10而有关含N-H键三环胺类芳香化合物抗氧化剂的研究起步较晚.自从发现偶氮二异丁腈(AIBN)产生的自由基直接与二苯胺的作用机理及反应动力学过程以来,11含N-H键的三环胺类芳香化合物作为抗氧化剂捕获自由基的性质逐渐引起了科研工作者的关注.吩噻嗪(图1)及其衍生物通常具有抗精神病和抗朊病毒的性质而在医学上具有广泛的应用.12除了其药物性质,吩噻嗪的抗氧化活性也引起研究者广泛的关注.吩噻嗪及其衍生物广泛应用于阻聚剂、润滑剂、橡胶和生物材料等的抗氧化保护.13-16在老鼠脑内吩噻嗪可以阻止亚油酸甲酯的自动氧化以及延缓脂质过氧化反应的发生.17Pedulli等18从化学热力学和化学动力学的角度对吩噻嗪等含有N-H键三环胺类芳香化合物捕获自由基的机理进行了详细的研究,发现吩噻嗪等含有N-H键三环胺类芳香化合物对烷基、烷氧自由基以及超氧自由基具有很高的反应活性.Liu等19-21研究发现吩噻嗪等三环胺类芳香化合物可以通过程序电子转移机理(SPLET)捕获二苯代苦味肼基自由基(DPPH)和氢原子迁移(HAT)机理捕获2,2-连氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(ABTS+•),在化学模拟生物体系中,三环胺类芳香化合物对2,2-偶氮(2-甲基丙基脒)·二盐酸盐(AAPH)引发的DNA氧化损伤具有保护作用,并且能够与6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、维生素E(VE)、抗坏血酸(VC)、抗坏血酸-6-十二酸酯(VC-12)协同保护红细胞.

图1 吩噻嗪化学结构Fig.1 Structure of phenothiazine
为了进一步研究吩噻嗪清除生物体内有害自由基的机理,本文采用脉冲辐解技术研究了吩噻嗪与CCl3OO•和•OH两种自由基反应的微观动力学过程,为深入研究吩噻嗪抗氧化活性提供理论参考.
2 材料与方法
吩噻嗪、四氯化碳、异丙醇购于中国医药上海化学试剂公司,均为分析纯试剂,吩噻嗪用甲醇重结晶后使用.本实验所用的水溶液均用Millipore纯水配制,O2和N2O均为99.99%的高纯气体.
脉冲辐解所用加速器为10 MeV的电子直线加速器(中国科学院上海应用物理研究所研制),电子脉冲宽度为8 ns.时间分辨吸收光谱终端使用300 W氙灯作为分析光源,分析光与电子束成垂直方向透过石英样品池(10 mm×10 mm)并经单色仪分光后使用R955光电倍增管检测,电信号经反馈补偿后由LeCroy WM8600A数字示波器转换成数字信号,并记录储存于计算机中,以自编软件进行动力学数据处理,实验装置及实验方法详见文献.22实验用N2O饱和的0.01 mol·L-1硫氰酸钾(KSCN)水溶液作为脉冲电子剂量剂,取(SCN)-•2在480 nm处取摩尔消光系数ε480nm=7600 L·mol-1·cm-1,测得单脉冲电子剂量为10 Gy.
3 结果与讨论
3.1 吩噻嗪与CCl3OO•的反应
氧气饱和的1×10-2mol·L-1的四氯化碳的异丙醇/水(体积比1:1)混合溶液经脉冲辐解后可以可得到CCl3OO•,其反应机理如下:23


图2 氧气饱和的2×10-4mol·L-1吩噻嗪与1×10-2mol·L-1的四氯化碳的异丙醇/水(体积比1:1)混合溶液脉冲辐解后分别在0.5 μs(▲)和5 μs(●)观察到的瞬态吸收谱Fig.2 Transient absorption spectra recorded at 0.5 μs (▲)and 5 μs(●)after pulse radiolysis of O2-saturated 2×10-4mol·L-1phenothiazine and 1×10-2mol·L-1CCl4of isopropanol/H2O(V/V,1:1)solution
图2为氧气饱和的2×10-4mol·L-1吩噻嗪与1× 10-2mol·L-1的四氯化碳的异丙醇/水(体积比1:1)混合溶液脉冲辐解后得到瞬态吸收谱图,在380 nm处产生一个强的吸收峰,约在5 μs达到峰值.由于此反应体系中异丙醇的浓度远大于吩噻嗪,脉冲辐解产生的•OH和•H通过反应(2)和(3)与异丙醇反应生成(CH3)2C•OH.通过反应(4)、(5)和(6),体系中得到的活性物种主要为CCl3OO•.CCl3OO•自由基的吸收在290 nm左右,24,25并且在反应开始1 μs内很快生成,所以产物不可能是CCl3OO•自由基,此过程可能是吩噻嗪与CCl3OO•反应生成的瞬态产物的形成过程.
吩噻嗪的N-H离解能(331.5 kJ·mol-1)与传统的酚类抗氧化剂维生素E的O-H的离解能(327.3 kJ·mol-1)18相近,容易失去氢原子.此外,吩噻嗪属于二级胺,N原子采用sp3的杂化轨道和C原子的sp2杂化轨道、H原子的s轨道重叠,形成棱锥体的结构,导致了两个苯环并不在同一平面,一旦失去H原子形式自由基,整个分子共平面,N原子上单电子的p轨道与两个苯环形成共轭大π键,共轭体系有利于稳定N原子上的单电子自由基.因此CCl3OO•自由基可以夺取吩噻嗪氮原子上的氢原子形成比较稳定吩噻嗪氮自由基.Smith和McGimpsey26利用激光光解得到的吩噻嗪氮自由基的吸收峰的位置位于380 nm左右.本文的结果与其得到的吸收峰的位置是相一致的,因此可以推断在380 nm处的吸收峰归属于吩噻嗪氮自由基.
图3是380 nm处的瞬态吸收随时间的变化曲线,分析380 nm动力学生成曲线表明:吩噻嗪氮自由基的生成为准一级动力学过程.改变溶液中吩噻嗪的浓度,测得一系列380 nm处的表观速率常数(kobs),以表观速率常数对相应吩噻嗪的浓度作图得到一条直线,直线斜率即为吩噻嗪与CCl3OO•反应的绝对速率常数.如图3(插图)所示,所得反应速率常数为1.1×109L·mol-1·s-1.
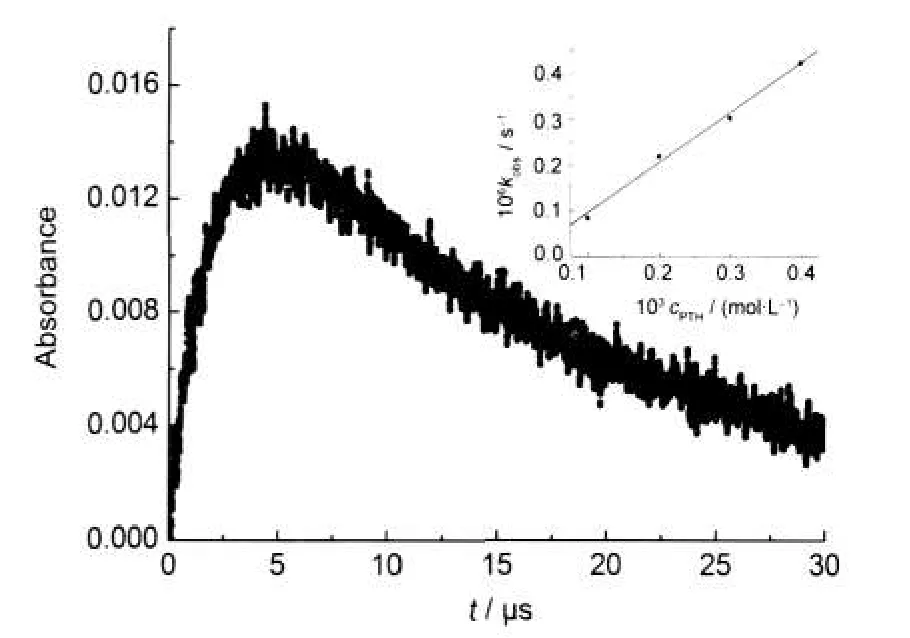
图3 脉冲辐解氧气饱和的2×10-4mol·L-1吩噻嗪与1×10-2 mol·L-1的四氯化碳的异丙醇/水(体积比1:1)混合溶液在380 nm处得到的动力学曲线Fig.3 Kinetic profile at 380 nm after pulse radiolysis of O2-saturated 2×10-4mol·L-1phenothiazine and 1×10-2mol·L-1CCl4of isopropanol/H2O(V/V,1:1)solutionInset:dependence of kobsat 380 nm on the concentration of phenothiazine(PTH)
3.2 吩噻嗪与•OH的反应
图4是N2O饱和的5×10-5mol·L-1吩噻嗪水溶液在脉冲辐解后5 μs得到的瞬态吸收谱图.N2O可以将体系产生的转换为•OH,体系中主要活性物种为•OH,其反应机理如下:


图4 N2O饱和的5×10-5mol·L-1吩噻嗪溶液在脉冲辐解5 μs观察到的瞬态吸收谱Fig.4 Transient absorption spectra recorded at 5 μs after pulse radiolysis of N2O-saturated 5×10-5mol·L-1 phenothiazine aqueous solution

图5 脉冲辐解5×10-5mol·L-1吩噻嗪溶液在380 nm处得到的动力学曲线Fig.5 Kinetic profile observed at 380 nm after pulse radiolysis of N2O-saturated 5×10-5mol·L-1phenothiazineaqueous solutionInset:dependence of kobsat 380 nm on the concentration of phenothiazine
与吩噻嗪和CCl3OO•反应生成的吩噻嗪氮自由基的特征吸收相似,在350-430 nm之间出现一个宽的吸收带,最大吸收峰位于380 nm.因此可以推断380 nm处的吸收峰为•OH与吩噻嗪反应得到的瞬态产物.与吩噻嗪和CCl3OO•反应的历程相似,•OH夺取吩噻嗪氮原子上的氢形成吩噻嗪氮自由基.通过分析380 nm处瞬态吸收的动力学增长曲线(图5)可知其生成同样遵循准一级动力学过程,改变吩噻嗪的浓度可以测得吩噻嗪与•OH反应的速率常数为4.0×109L·mol-1·s-1.
4 结论
实验结果表明,通过脉冲辐解产生的CCl3OO•和•OH能够夺取吩噻嗪氮上的氢原子产生吩噻嗪氮自由基.反应机理分别如下:

三环胺类芳香化合物的抗氧化活性与它们分子中N-H键的解离能及其结构相关,其他几种常见的三环胺类芳香化合物比如吩恶嗪、吩硒嗪和咔唑的N-H键的离解能分别310.2、336.1和344.4 kJ·mol-1.由于这些三环胺类芳香化合物的N-H键离解能以及化学结构与吩噻嗪相似,因此结合本文研究的吩噻嗪与CCl3OO•、•OH的实验结论,可以推测与其它含有O-H键的酚类化合物一样,含N-H键三环胺类芳香化合物同样具有作为抗氧化剂的潜能.
(1) Harman,D.J.Gerontol.1956,11,298.
(2)Connor,H.D.;Thurman,R.G.;Galizi,M.D.;Mason,R.P. J.Biol.Chem.1986,261(10),4542.
(3) Pan,J.X.;Wang,W.F.;Lin,W.Z.;Yao,S.D.Free Radic.Res. 1999,30,241.
(4) Zheng,R.L.;Shi,Y.M.;Jia,Z.J.;Zhao,C.Y.;Zhang,Q.Z.; Tan,X.R.Chem.Soc.Rev.2010,39,2827.
(5) Byczkowski,J.Z.;Gesser,T.Int.J.Biochem.1988,6,569.
(6)Wiseman,H.;Halliwell,B.Biochem.J.1996,313,17.
(7)Wang,W.F.;Luo,J.;Yao,S.D.;Lian,Z.R.;Zuo,Z.H.;Zhang, J.S.;Lin,N.Y.Radiat.Phys.Chem.1995,46,41.
(8) Foti,M.C.J.Pham.Pharmacol.2007,59,1673.
(9) Cécile,C.O.;Philippe,H.;Jean,P.;Christian,R.J.Am.Chem. Soc.2002,124,14027.
(10) Luca,V.;Ingold,K.U.;Lusztyk,J.J.Am.Chem.Soc.1996, 118,3545.
(11)Adamic,K.;Dunn,M.;Ingold,K.U.Can.J.Chem.1969,47, 287.
(12) Korth,C.;May,B.H.;Cohen,F.E.;Prusiner,S.B.Proc.Natl. Acad.Sci.U.S.A.2001,98,9836.
(13) Guo,X.;Liu,Y.;Guo,R.Acta Phys.-Chim.Sin.2001,17,982. [郭 霞,刘 燕,郭 荣.物理化学学报,2001,17,982.]
(14)Murphy,C.M.;Ravner,H.;Smith,N.L.Ind.Eng.Chem.1950, 42,2479.
(15)Fukuzumi,K.;Ikeda,N.;Egawa,M.J.Am.Oil Chem.Soc. 1976,53,623.
(16)Yamamura,T.;Suzuchi,K.;Yamaguchi,T.;Nishiyama,T. B.Chem.Soc.Jpn.1997,70,413.
(17) Cini,M.;Fariello,R.G.;Bianchetti,A.;Moretti,A.Neurochem. Res.1994,19,283.
(18) Lucarini,M.;Pedrielli,P.;Pedulli,G.F.;Valgimigli,L.; Gigmes,D.;Tordo,P.J.Am.Chem.Soc.1999,121,11546.
(19) Tang,Y.Z.;Liu,Z.Q.Bioorg.Med.Chem.2007,15,1903.
(20) Li,G.X.;Tang,Y.Z.;Liu,Z.Q.J.Biochem.Mol.Toxil.2009, 23,280.
(21) Liu,Z.Q.;Tang,Y.Z.;Wu,D.J.Phys.Org.Chem.2009,20, 1009.
(22)Zhang,P.;Yao,S.D.;Li,H.X.;Song,X.Y.;Wang,W.F.Radiat. Phys.Chem.2011,80,548.
(23) Hill,T.J.;Land,E.J.;McGarvey,D.J.;Wolfgang,S.;Tinkler,J. H.;Truscott,T.G.J.Am.Chem.Soc.1995,117,8322.
(24) Shen,X.H.;Lind,J.;Eriksen,T.E.J.Phys.Chem.1989,93, 553.
(25)Pan,D.X.;Yu,Y.;Dong,W.B.;Zheng,L.;Lu,X.;Yao,S.D.; Hou,H.Q.Acta Phys.-Chim.Sin.2004,20,1099.[潘丹霞,于 勇,董文博,郑 璐,卢 霄,姚思德,侯惠奇.物理化学学报,2004,20,1099.]
(26)Smith,G.A.;McGimpsey,W.G.J.Phys.Chem.1994,98,2923.
April 26,2011;Revised:June 8,2011;Published on Web:June 22,2011.
Pulse Radiolysis Study of the Reactions between Phenothiazine and CCl3OO•,•OH
TANG Rui-Zhi1,2ZHANG Peng1,2LI Hai-Xia1,2LIU Yan-Cheng1,2WANG Wen-Feng1,*
(1Shanghai Institute of Applied Physics,Chinese Academy of Sciences,Shanghai 201800;2Graduate University of Chinese Academy of Sciences,Beijing 100049)
The kinetics and mechanisms of the reactions between phenothiazine and CCl3OO●,●OH were evaluated and the related rate constants were determined using nanosecond pulse radiolysis technique. The experimental results indicate that the maximum absorption of the transient product from the reaction between phenothiazine and CCl3OO●,●OH was located at 380 nm,which is attributed to CCl3OO●and●OH abstracting hydrogen from phenothiazine to generate a phenothiazine radical.The rate constants of the reactions between phenothiazine and CCl3OO●,●OH were determined to be 1.1×109,4.0×109L·mol-1·s-1, respectively.These results provide a theoretical foundation for the further study of the antioxidant activity of phenothiazine.
Antioxidant;Phenothiazine;Trichloromethylperoxyl radical;Hydroxide radical; Pulse radiolysis
(1中国科学院上海应用物理研究所,上海201800;2中国科学院研究生院,北京100049)
O644
*Corresponding author.Email:wangwenfeng@sinap.ac.cn;Tel:+86-21-39194602.
The project was supported by the National Natural Science Foundation of China(10675158).
国家自然科学基金(10675158)资助项目
