纳豆芽孢杆菌蛋白酶的制备及性质研究*
2011-11-28潘进权邓社兴梁亚眉
潘进权,邓社兴,梁亚眉
(湛江师范学院生命科学与技术学院,广东 湛江,524048)
纳豆芽孢杆菌蛋白酶的制备及性质研究*
潘进权,邓社兴,梁亚眉
(湛江师范学院生命科学与技术学院,广东 湛江,524048)
纳豆芽孢杆菌是纳豆发酵生产的主要菌种,对其胞外蛋白酶催化特性的研究有助于了解纳豆的发酵生产过程,并有利于从中发掘有开发应用潜力的蛋白酶。实验从不同纳豆产品中分离筛选得到1株高产蛋白酶的纳豆芽孢杆菌,对其胞外蛋白酶的催化特性及活性影响因子进行了分析。结果显示,纳豆芽孢杆菌蛋白酶是一典型的金属蛋白酶,EDTA几乎可完全抑制其活性,Ca2+是其活性中心的辅基;该蛋白酶在60℃、pH 7.0有最大催化活性,在pH 6~9和低于45℃条件下具有很好的稳定性;50℃时,该蛋白酶会缓慢失活,其热失活规律符合一级指数衰减模型:a=0.124+0.887e(-0.45t);该蛋白酶对大豆蛋白有很强的水解能力,其水解效率与Alcalase蛋白酶相当,可以实现底物蛋白的深度水解,具有一定的开发应用价值。
纳豆芽孢杆菌,蛋白酶,制备,性质
纳豆是传统的大豆发酵食品,具有很好的保健及食疗价值,这主要与该产品中纳豆芽孢杆菌的益生作用、大豆异黄酮、活性多肽及纳豆激酶等有密切的关系[1-2]。在纳豆的发酵生产中纳豆芽孢杆菌可以分泌多种胞外酶,包括淀粉酶、脂肪酶、纳豆激酶及蛋白酶等[3]。这些酶的共同作用赋予了纳豆产品特有的风味,以及产品的保健价值。因此对这些酶的研究将有助于了解纳豆的发酵工艺过程,对发酵生产给予理论指导,同时也可从中发掘一些有应用价值的新酶。虽然纳豆的发酵生产有悠久的历史,但是对该菌种胞外酶系的研究却相对较少,主要的研究工作集中于该菌种益生作用的探讨[4],纳豆激酶[7-9]的研究与开发等。然而,对该菌种胞外蛋白酶的研究却相对较少,仅有少数学者对该菌种的发酵产酶特性进行过探讨[5-6],而对于其胞外蛋白酶的组分构成及其催化特性却鲜见报道。为了探讨纳豆芽孢杆菌胞外蛋白酶在纳豆发酵生产中的作用,课题组对纳豆芽孢杆菌胞外蛋白酶的催化特性进行了探讨。
1 材料与方法
1.1 试验材料
1.1.1 菌种及试剂
纳豆芽孢杆菌(Bacillus natto sp.),实验室分离保藏菌种;苯甲基磺酰氟 PMSF、EDTA、E -64、Pepstatin,Amersco公司;大豆分离蛋白(蛋白含量90%),莱州福客生物技术有限公司;木瓜蛋白酶,Merck公司;Alcalase碱性蛋白酶及protamex复合蛋白酶,Novo Nordisk公司;实验中所用其他试剂均为分析纯。
1.1.2 斜面活化培养基
5 g/L葡萄糖,5 g/L牛肉膏,10 g/L蛋白胨,5 g/L NaCl,15 g/L 琼脂,pH 7.0。
1.1.3 液体种子培养基
葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏 5 g/L,NaCl 5 g/L,Tween 80 1 mL/L,pH 7.0。
1.1.4 发酵培养基
可溶性淀粉 35.8 g/L,黄豆粉 24.9 g/L,麸皮 20 g/L,K2HPO42.34 g/L,CaCl22 g/L,Tween 80 2 g/L,pH 8.0~8.5。
1.2 试验方法
1.2.1 种子活化
菌株经试管斜面活化后,接种1环于装有50 mL种子培养基的250 mL三角瓶中,在37℃,200r/min的摇床上培养24h。
1.2.2 液态发酵
每个250 mL三角瓶中装入50 mL发酵培养基,灭菌冷却后接种2 mL活化的液体种子,置于全温摇床中于37℃,发酵70h。
1.2.3 蛋白酶的制备
液态发酵结束后,将发酵液10 000 r/min、4℃冷冻离心20 min,取上清液用截留分子量30 000 u的超滤膜包进行超滤浓缩并除去发酵液中的小分子物质,所得浓缩液即为粗酶液。
1.2.4 蛋白酶活性的测定
采用 Folin酚法[10]:1.5 mL离心管中加入0.3 mL适当稀释的酶液及0.3 mL 1.5%酪蛋白(溶于0.05 mol/L pH 7.5的磷酸盐缓冲液),40℃反应10 min,加0.6 mL 0.4 moL/L的三氯乙酸终止反应,静置15 min后14 000×g离心10 min,取上清液0.6 mL,加入3 mL 0.4 mol/L Na2CO3溶液及0.6 mL福林酚试剂,于40℃显色20 min,于680 nm测定其吸光值,根据标准曲线计算酶活单位。
酶活定义:实验条件下,每分钟水解酪蛋白生成1 μg当量酪氨酸所需酶量为1个活力单位。
1.2.5 纳豆杆菌蛋白酶的催化性质
1.2.5.1 pH值对蛋白酶活性及稳定性的影响
按照酶活测定方法于不同pH(pH3.0~11.0)缓冲条件下测定蛋白酶的活性,考察pH对纳豆杆菌蛋白酶活性的影响。根据实验结果绘制pH-活力曲线,并由此确定蛋白酶的最适作用pH范围。
用不同pH的缓冲液分别调节酶液的pH到pH 3.0~11.0,于室温(25℃)放置约1h,测定放置前后酶活,计算酶活残留率。以酶活残留率对pH值作图,绘制蛋白酶的pH稳定曲线。
1.2.5.2 温度对蛋白酶活性及稳定性的影响
按照酶活测定方法分别于不同的温度(30~70℃)下测定纳豆杆菌蛋白酶的活性,考察温度对蛋白酶活性的影响。根据实验结果绘制温度-活力曲线,并由此确定酶的最适作用温度。
在酶的稳定pH条件下,将酶液分别于不同温度(30~70℃)下保温30 min,测定保温前后蛋白酶活性的变化,考察温度对蛋白酶稳定性的影响。以酶活残留率对温度作图,绘制蛋白酶的热稳定性曲线。
1.2.5.3 抑制剂对蛋白酶活性的影响
在酶的稳定pH条件下,将酶液与不同类型的抑制剂混和,然后在室温中放置约30 min,测定加入抑制剂保温后蛋白酶的活性。考察抑制剂对蛋白酶活性的影响。
1.2.5.4 金属离子对蛋白酶活性的影响
在酶的稳定pH条件下,将酶液与不同的金属离子溶液混和,于室温中放置30 min后测定酶活,比较各种金属离子对蛋白酶活性的影响。
1.2.5.5 活性中心金属离子的确定
(1)脱辅基酶蛋白的制备[11]:在原酶液中加入终浓度10 mmol/L EDTA,置于截留分子质量为8 000 u的透析袋中,在0.02 mol/L pH7.5 Tris-HCl缓冲液(含10 mmol/L EDTA)中4℃透析12 h。然后用0.02 mol/L pH7.5 Tris-HCl缓冲液(不含任何金属离子)于4℃透析24 h,期间要多次更新缓冲液。由此即可得到脱金属离子辅基酶蛋白溶液。
(2)金属离子类型的确定:在脱辅基酶蛋白溶液中加入终浓度为1 mmol/L的不同金属离子,放置30 min后测定加入金属离子前后酶液活性的变化。
1.2.5.6 热失活动力学
将适当稀释的酶液置于50℃的水浴中保温,每间隔一定时间取样测定蛋白酶的活性,观察保温过程中蛋白酶活性的变化。定义初始的蛋白酶相对活力为1,对所得实验数据进行非线性模型拟合。
1.2.6 纳豆杆菌蛋白酶对大豆蛋白的水解
用蒸馏水配制浓度5g/100 mL的大豆蛋白,并调至pH 8.0,置于沸水浴中热处理15 min。冷却后按照酶与底物比2 000 u/g分别加入纳豆杆菌蛋白酶、木瓜蛋白酶、Alcalase碱性蛋白酶及Protamex复合蛋白酶,置于50℃下保温酶解5h。酶解结束后调节水解液至pH 5.0并煮沸灭酶5 min,于5 000 r/min离心10 min,所得上清即为蛋白水解液。测定蛋白水解液的水解度值,比较各蛋白酶对大豆蛋白水解效率的差异。
1.2.7 蛋白水解液水解度的测定
大豆蛋白水解度值采用氨基酸态氮含量来表示,用茚三酮显色的方法来测定[12]:取适当稀释后的蛋白水解液0.40 mL于试管中并加入1.60 mL蒸馏水和1.00 mL茚三酮显色剂混匀后置于沸水浴中加热15min。冷却后加入5.00 mL40%乙醇溶液混匀,放置l5min,同时作试剂空白。以试剂空白为参比于570nm测定样品显色液的吸光度值。根据标准曲线(以甘氨酸为标准物)计算蛋白水解液中氨基酸态氮的含量(mg/mL)。由此计算出样品的水解度为:
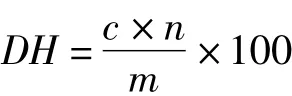
式中:DH为样品的水解度值,mg/100g;C为在标准曲线上查得的测试样中氨基酸态氮的浓度,mg/mL;n为蛋白水解液的稀释倍数;m为水解前样品中蛋白的浓度,g/mL。
2 结果与讨论
2.1 温度对蛋白酶活性及稳定性的影响
温度对纳豆杆菌蛋白酶活性及稳定性的影响如图1所示。该蛋白酶在60℃有最大催化活性,高于65℃活性会迅速下降。此外,该蛋白酶在相对较低的温度下也有较强活性,如30℃时,该蛋白酶的活性是最大催化活性的63%。稳定性实验结果表明:纳豆杆菌蛋白酶具有相对较好的热稳定性,在低于45℃时保温30 min,该蛋白酶的活性基本上无损失,在50℃保温30 min后,酶活残留率依然可高达90%左右;若保温温度超过55℃,则该蛋白酶会迅速失活;例如,60℃保温30 min后,该蛋白酶酶活仅有50%的残留。
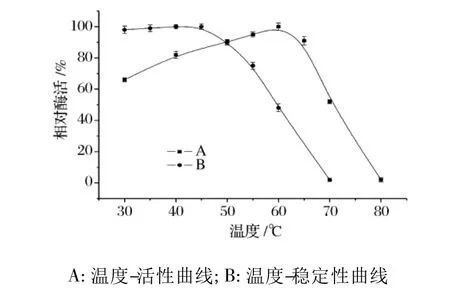
图1 温度对纳豆杆菌蛋白酶活性及稳定性影响
2.2 pH值对蛋白酶活性及稳定性的影响
pH值对纳豆杆菌蛋白酶活性及稳定性的影响如图2所示。纳豆杆菌蛋白酶的pH-活性曲线相对较窄,pH对其活性的影响非常显著。该蛋白酶在pH7.0左右有最大催化活性;而在pH5.0时,蛋白酶的活性仅为最大活性的30%左右;当pH低于4.0则基本上没有活性。稳定性实验结果表明,该酶在中性及碱性(pH 6.0~9.0)的条件下有相对较好的稳定性;在酸性(pH<5.0)条件下非常不稳定,会迅速失活;如在pH 4.0保温仅30 min,酶活损失达80%。
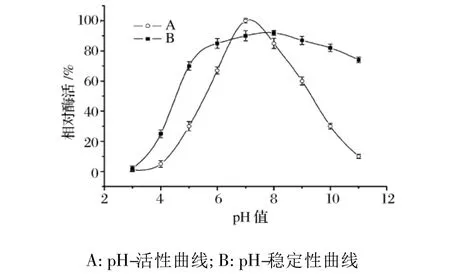
图2 pH对纳豆杆菌蛋白酶活性及稳定性的影响
2.3 抑制剂对蛋白酶活性的影响
探讨了各种抑制剂及化学物质对纳豆杆菌蛋白酶活性的影响,结果如表1所示。
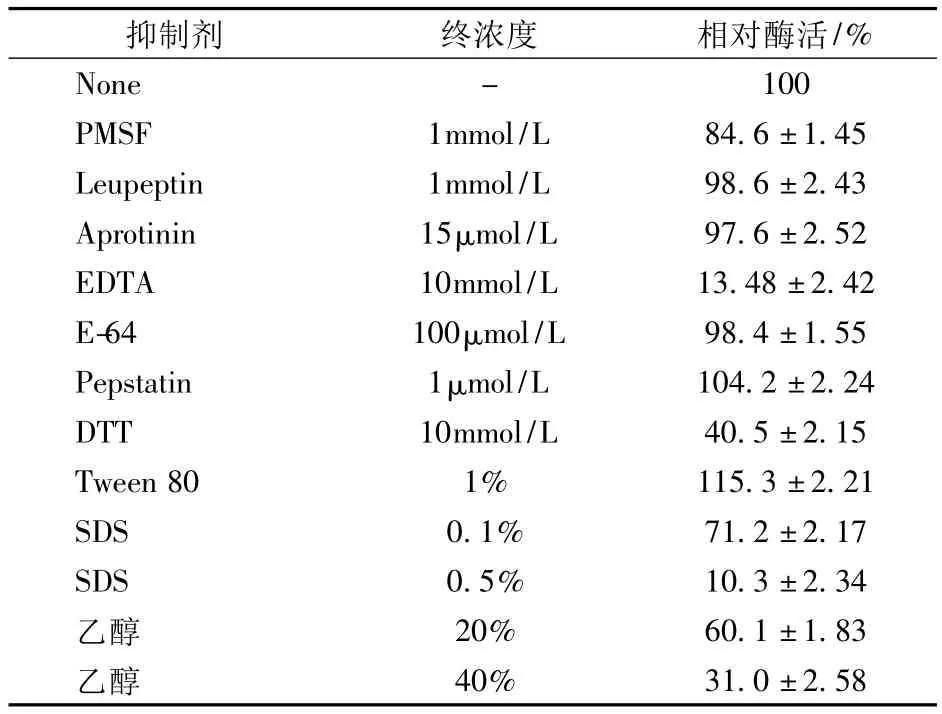
表1 抑制剂对蛋白酶活性的影响
在选用的几种常用蛋白酶抑制剂中,仅EDTA几乎可以完全抑制该蛋白酶的活性,初步表明纳豆杆菌分泌的蛋白酶是一类金属蛋白酶,这与文献报道结果有所不同[13]。另外,还原剂DTT对该蛋白酶活性也有60%的抑制作用,初步说明二硫键对于该金属蛋白酶的活性有非常重要的作用。除此外,PMSF对该蛋白酶也有弱的抑制作用,说明丝氨酸残基对于该蛋白酶活性也有一定的贡献。实验结果还显示,该蛋白酶对离子型表面活性剂SDS非常敏感,0.5%的SDS几乎可以完全抑制其活性,而非离子型表面活性剂Tween 80却对该酶有一定的激活作用。另外,该蛋白酶对乙醇也非常敏感,浓度20%的乙醇对该蛋白酶就表现出较强抑制作用,可抑制约40%的活性。
2.4 金属离子对蛋白酶活性的影响
考察了常见金属离子对纳豆杆菌蛋白酶活性的影响,结果如表2所示。在所试验的几种金属离子中,Cu2+对该蛋白酶有非常强的抑制作用,终浓度5 mmol/L Cu2+可以抑制其66%的活性;Fe2+对该蛋白酶也显示出一定的抑制作用,终浓度5 mmol/L时可以抑制其活性的32%左右;另外,Mn2+对该蛋白酶也有极弱的抑制作用。除此之外,其他金属离子对该蛋白酶活性的影响不明显。
2.5 活性中心金属离子类型的确定
抑制剂实验结果显示,纳豆杆菌蛋白酶是一种典型的金属蛋白酶。为了考察其活性中心金属离子类型,探讨了各种金属离子对脱辅基酶蛋白活性的影响,结果如表3所示。
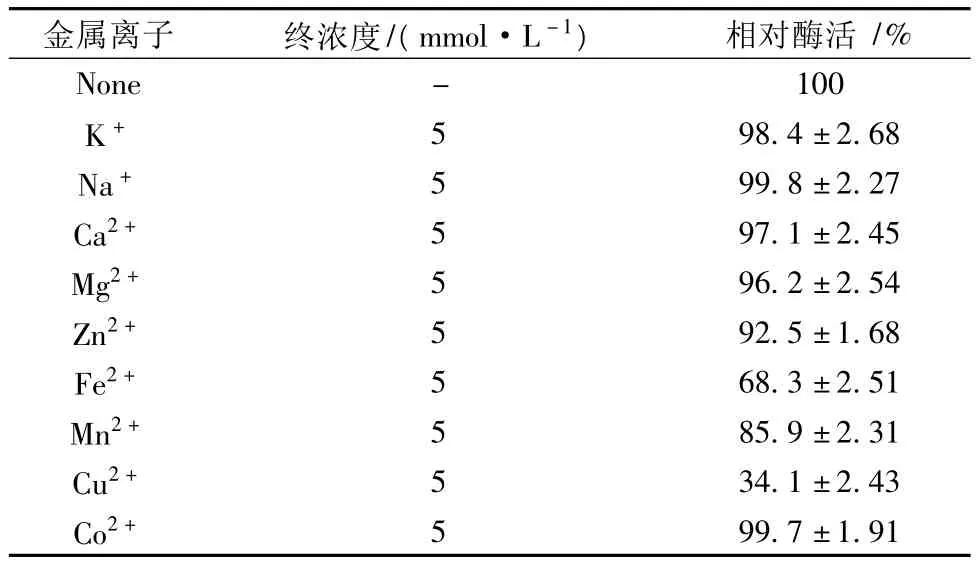
表2 金属离子对蛋白酶活性的影响
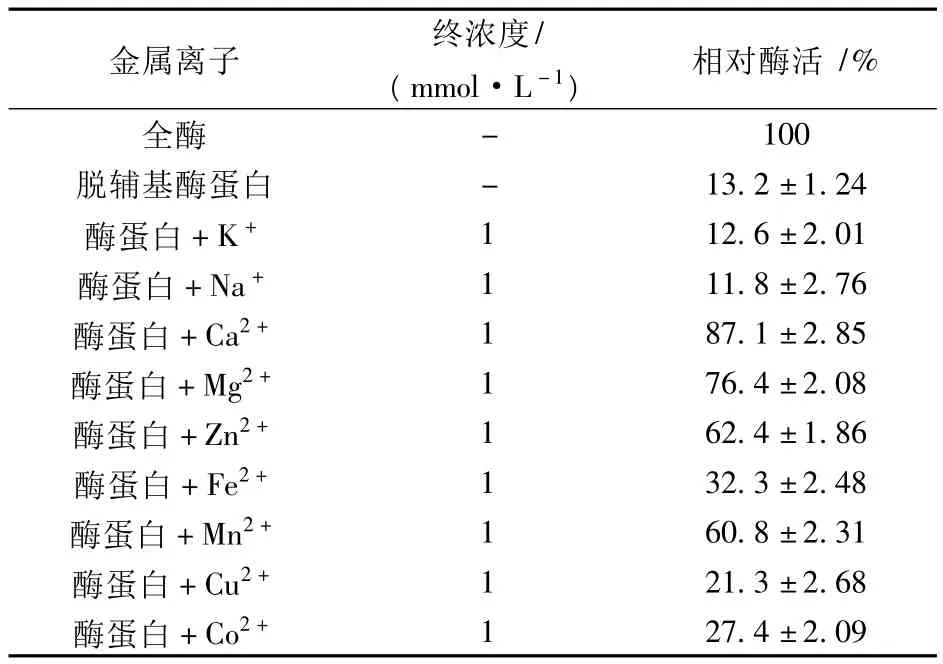
表3 金属离子对脱辅基酶蛋白活性的影响
纳豆杆菌蛋白酶脱除金属离子后,其活性大幅降低,仅为起始酶活的13%左右;在试验的几种常见金属离子中,Ca2+对脱辅基酶蛋白活性恢复有最显著的作用,浓度1mmol/L Ca2+可使酶蛋白活性恢复为起始的87%左右,结果初步表明纳豆杆菌蛋白酶活性中心的离子是Ca2+。实验还发现,将纳豆杆菌蛋白酶活性中心的Ca2+换成Mg2+、Zn2+或Mn2+,该蛋白酶也表现出一定的催化活性;若将Ca2+换成Fe2+、Cu2+或Co2+,该蛋白酶活性几乎完全丧失。
2.6 热失活动力学
为考察纳豆杆菌蛋白酶在50℃的稳定性及变性失活规律,对该酶在50℃的失活动力学进行探讨。以酶活残留率与保温时间作图,结果如图3。根据酶失活理论,用Origin Pro 8.0软件对实验结果进行指数衰减模型拟合。结果发现,该蛋白酶在50℃的热失活规律符合一级指数衰减动力学模型:a=0.124+0.887e(-0.45t)。其模型拟合相关系数R2=0.992。说明该模型能很好的解释该蛋白酶组分在50℃的热变性失活过程,具有较高的可信度。
2.7 纳豆杆菌蛋白酶对大豆蛋白的水解
比较了纳豆杆菌蛋白酶与其他几种商品化蛋白酶对大豆蛋白的水解效果,结果如图4所示。
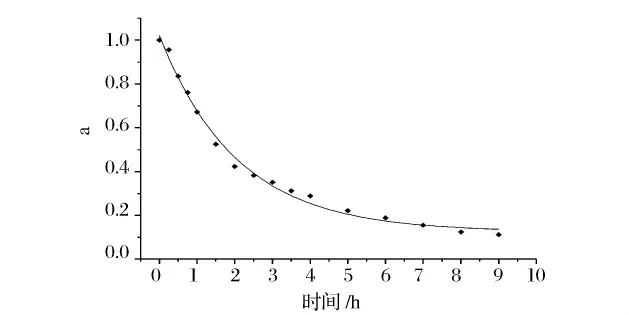
图3 纳豆杆菌蛋白酶的热失活曲线
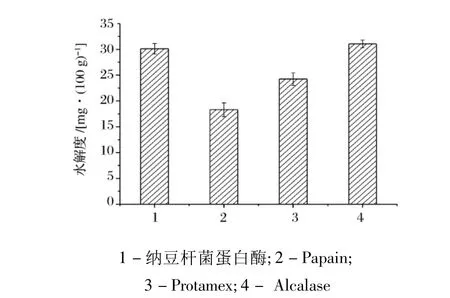
图4 不同蛋白酶对大豆蛋白的水解
在试验的几种蛋白酶中,纳豆杆菌蛋白酶与Alcalase碱性蛋白酶均对大豆蛋白显示出较强的水解效率,两者的水解效果基本相当;而木瓜蛋白酶的水解效率最低。已有的研究结果表明,Alcalase碱性蛋白酶是现有商品化蛋白酶中肽键选择性最为宽泛的一种蛋白酶,它往往可以实现目标蛋白的高效水解[14]。以上结果初步表明,纳豆杆菌蛋白酶也具有相对较为宽泛的肽键选择性,可以实现大豆蛋白的高效水解。
3 结论
与众多豆类发酵食品相似,在纳豆的发酵过程中,大豆蛋白的水解是其中一个非常重要的生化过程,它对于纳豆的营养保健价值及风味形成有着密切的关系。因此,对参与这一生化过程的蛋白酶性质的探讨将有助于发掘出新型的蛋白酶及对纳豆发酵过程的全面了解,为其发酵生产提供理论依据。在前期的工作中,从大量纳豆发酵产品中分离得到了一株高产蛋白酶的纳豆芽孢杆菌,并对其发酵产酶的特点进行了分析,在此基础上对该菌株蛋白酶催化特性进行了探讨。实验结果显示:纳豆杆菌分泌的蛋白酶是一类典型的中性金属蛋白酶,EDTA几乎可完全抑制其活性,Ca2+是其活性中心的辅基;常见金属离子中Cu2+对其有非常强的抑制作用,Fe2+对其也有弱的抑制作用;该蛋白酶在60℃、pH 7.0有最大催化活性,在pH 6~9和低于45℃条件下具有很好的稳定性;当温度在50℃时,该蛋白酶会缓慢失活,其热失活规律符合一级指数衰减模型:a=0.124+0.887e(-0.45t);水解实验结果表明,该蛋白酶对大豆蛋白有很强的水解能力,其水解效率与Alcalase蛋白酶相当,初步表明该蛋白酶具有相当宽泛的肽键选择性,可以实现底物蛋白的深度水解,具有一定的开发应用价值。
[1] 奚晓琦,王加启,卜登攀,等.纳豆芽孢杆菌的分离鉴定及纳豆激酶高产菌株的筛选[J].东北农业大学学报,2009,40(11):69-75.
[2] 段智变,董改香,温晓庆,等.纳豆及其提取物生物活性物质测定[J].山西农业大学学报,2008,28(2):181-183.
[3] 王莉,金学年,金成哲,等.纳豆发酵过程中纳豆激酶及活性物质的变化[J].大连工业大学学报,2006,27(1):5-9.
[4] 张丽靖,杨郁.1株纳豆菌抑菌活性及其培养基优化[J].微生物学杂志,2010,30(1):43-46.
[5] 王萍,杜连祥,路福平,等.溶栓纳豆芽抱杆菌的筛选鉴定及产纳豆激酶条件的研究[J].食品与发酵工业,2006,32(2):74-77.
[6] 陈晓飞,周伏忠,陈国参.纳豆激酶酶学性质研究[J].河南科学,2010,28(1):41-43.
[7] Yamagata Y,Abe R,Fujita Y,et al.Molecular Cloning and nucleotide sequence of the 90k serine protease gene,hspK,from Bacillus subtilis(natto)No.16[J].Current Microbiology 1995,31:340-344.
[8] 帅明,黄占旺,牛丽亚.纳豆芽孢杆菌产蛋白酶固态发酵条件研究[J].饲料工业,2008,29(8):18-20.
[9] 孙妍,王加启,奚晓琦,等.高产蛋白酶纳豆芽孢杆菌的分离筛选与鉴定[J].沈阳农业大学学报,2010,41(2):175-180.
[10] Sierecha J K.Purification and partial characterization of a neutral protease from a virulent strain of Bacillus cereus[J].The International Journal of Biochemistry & Cell Biology,1998,30(5):579-595..
[11] Sookkheo B,Sinchaikul S,Phutrakal S,et al.Purifica-tion and characterization of the highly thermostable protease from Bacillus stearothermophilus TLS33[J].Protein Expression and Purification,2000,20:142-151..
[12] 刘静,李祥,张光华.加热双酶联合水解大豆蛋白的研究[J].中国酿造,2008(12):38-41.
[13] 孙晓鸣,王萍,陈静.纳豆芽孢杆菌配伍发酵产中性蛋白酶的性质研究[J].江西农业大学学报,2010,32(1):163-168.
[14] Beynon R,Bond J S Proteolytoc enzymes—A practical approach(第 2版)[M].New York:Oxford University Press,2001:97-104.
Preparation and Characterization of Protease from Bacillus natto
Pan Jin-quan,Deng She-xing,Liang Ya-mei
(School of Life Science and Technology,Zhanjiang Normal University,Zhanjiang 524048,China)
Bacillus natto was the primary microorganism used in the production of natto ,and the study on the characterization of protease from Bacillus natto will help to conduct the production of natto and to explore new protease.One Bacillus natto of high-yield protease was isolated from natto,and catalysis characterization of protease secreted from this Bacillus natto was investigated.Results indicated:protease from Bacillus natto was a particular Metalloproteases,it could be completely inhibited by EDTA,and had Ca2+in the active center.The protease had the maximum activity at pH 7.0 and 60℃ and was stable in the pH range of 6.0 ~9.0 and below 45℃.The protease was unstable at 50℃and the kinetics of deactivation fit the model:a=0.124+0.887e(-0.45t).Protease from Bacillus natto has a very high hydrolysis efficiency to soy protein,meaning that it's a good application in the production of hydrolysate of food protein.
Bacillus natto,protease,preparation,characterization
博士,讲师。
*广东省自然科学基金项目(9452404801001943);湛江师范学院博士专项基金项目(ZL0912)
2011-06-09,改回日期:2011-07-12
