反复腹痛患儿及家庭成员中幽门螺杆菌感染和外周血淋巴细胞亚群变化的研究①
2011-11-27黄永琴马丽菊黄永坤周丽芳
黄永琴 刘 梅 曹 佳 马丽菊 黄永坤 戚 勤 周丽芳
(云南省昆明医学院第一附属医院儿科,昆明650032)
幽门螺杆菌(Helicobacter pylori,Hp)是一种螺旋状、微需氧革兰阴性杆菌,主要定植于人胃粘膜,长期与人类宿主共生。具有很强的感染性,全球仍有一半的人口感染Hp[1]。发展中国家感染率较高,儿童感染率超过成人。Hp被公认为是慢性胃炎、消化性溃疡的致病因素,也与胃癌的发生密切相关。但Hp感染的致病机制仍不是很清楚,除本身的动力装置、粘附特性以及各种毒力因子引起粘膜损伤致病外,宿主免疫功能异常亦是Hp致病的重要机制。本研究以家庭为单位,对11个家庭反复腹痛患儿及家庭成员50名及55名正常对照行外周血淋巴细胞亚群 CD3+(%)、CD19+(%)、CD4+(%)、CD8+(%)、CD16+56(%)、CD4+/CD8+检测,以了解幽门螺杆菌感染反复腹痛患儿及家庭成员外周血淋巴细胞亚群的变化。
1 对象与方法
1.1 研究对象 选择3岁至14岁因反复腹痛半年以上来我科就诊的患儿及其一级和二级亲属列为研究对象,其标准:①在云南出生且生活3年以上;②无严重的心、肺、脑、肾、皮肤、营养、内分泌疾病及免疫缺陷病;③近4周内无服用抗生素、铋剂、质子泵阻滞剂和激素史。共有11个家庭50名成员符合条件。55名志愿者(包括来医院体检中心进行体检的健康者和在校大学生)所有研究对象必须身体健康。
1.2 研究方法
1.2.1 标本采集 征得患儿父母和家庭其他成员知情同意,采用EDTA抗凝管抽取3 ml静脉血,2 ml提取血浆行Hp抗体及分型检测。1 ml行淋巴细胞亚群检测。
1.2.2 实验材料 ①Hp免疫印迹试剂盒 (试剂由深圳市伯劳特生物制品有限公司提供,批号:101126)。每个试剂盒包括两瓶25 ml浓缩洗涤液(主要成分磷酸盐缓冲液)、一瓶25 ml酶联试剂(主要成分过氧化物酶标记羊抗人IgG)、一瓶25 ml显色剂A(主要成分3,3一二氨基联苯氨)、一瓶25 ml显色剂B(主要成分H2O2)、一瓶25 ml终止液(主要成分H2SO4)、8条Hp抗原印迹薄膜和一张标准带。②淋巴细胞亚群检测试剂盒 BD SimultestTMIMK-lymphocyte(试剂由美国Becton Dickinson公司提供,批号:340182)
1.2.3 检测方法 ①Hp免疫印迹检测:按试剂盒说明书进行操作,检测Hp空泡毒素(CagA)、毒素相关蛋白抗体(VacA)、尿素酶A及B抗体(UreA、UreB)。当CagA抗体(+)和/或VacA抗体(+)阳性时,为Ⅰ型Hp感染;仅出现Ureas抗体(+),为Ⅱ型Hp感染。三种抗体阴性即为Hp抗体阴性。Hp阴性者选为正常对照组。②外周血淋巴细胞亚群直接免疫荧光染色:在6个流式检测管中分别加入 CD45-FITC/CD14-PE、CD3-FITC/CD19-PE、CD3-FITC/CD4-PE、CD3-FITC/CD8-PE、CD3-FITC/CD(16+56)-PE和阴性对照(IgG1-FITC/IgG2a-PE)各20 μl及 EDTA抗凝全血100 μl,室温避光孵育20分钟;加入溶血素2 ml作用10分钟;离心洗涤后加入500 μl PBS缓冲液混匀后行流式细胞仪(FCM)分析。③FCM分析:美国Becton Dickinson公司流式细胞仪(FACScalibur),激发光源FITC(530/30)nm,PE(585/42)nm,应用 SimulSET软件进行数据处理。
1.2.4 Hp感染的诊断标准和分组 根据2007年8月10~12日在江西庐山召开的第三次全国Hp共识会议提出的幽门螺杆菌诊断标准[2]。11个家庭50名成员及55名志愿者中通过检测幽门螺杆菌抗体和分型,选取幽门螺杆菌阴性者作为正常对照组。根据症状将研究对象分为腹痛组和正常对照组。另外再根据症状及年龄将研究对象分为腹痛患儿组、腹痛成人组及正常对照组。
1.3 统计学处理 应用SPSS11.5统计软件,计量资料均进行正态性检验,各指标以±s表示,偏态分布及方差不齐采用秩和检验,三组间比较采用单因素方差分析,其中两两比较采用SNK(q检验),另外两组间比较采用t检验,以α=0.05为统计标准,当P<0.05为差异有统计学意义,P<0.01为差异有显著意义。
2 结果
2.1 Hp感染腹痛组和正常对照组淋巴细胞亚群结果(见表1) CD19+在三组间的值呈偏态分布和方差不齐采用秩和检验,其余为近似正态分布采用t检验。腹痛组外周血CD19+(%)较正常对照组增加(χ2=4.344,P=0.037),腹痛组外周血 CD8+(%)显著降低(t=-3.573,P=0.001),腹痛组外周血CD4+/CD8+比值高于正常对照组(t=2.327,P=0.023),另外两组间比较外周血 CD3+(%)、CD4+(%)、CD16+56(%)均无统计学意义。
表1 Hp感染腹痛组及正常对照组外周血淋巴细胞亚群检测结果(%,±s)Tab.1 Peripheral blood lymphocyte subset between abdominal pain group with Hp infection and control group(%,±s)
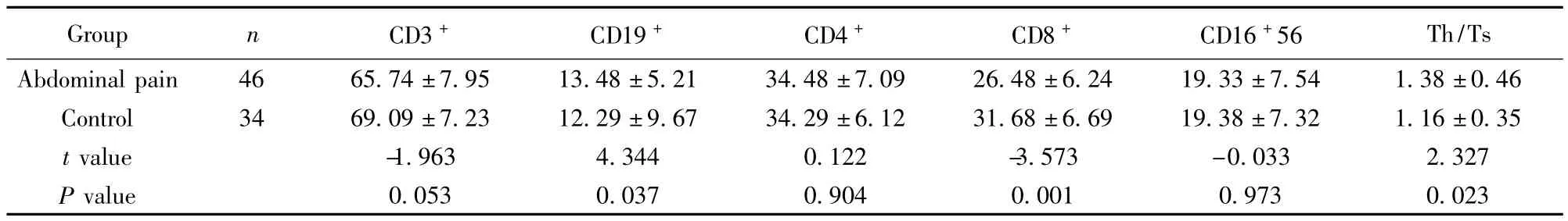
表1 Hp感染腹痛组及正常对照组外周血淋巴细胞亚群检测结果(%,±s)Tab.1 Peripheral blood lymphocyte subset between abdominal pain group with Hp infection and control group(%,±s)
Th/Ts Abdominal pain 46 65.74±7.95 13.48±5.21 34.4 Group n CD3+ CD19+ CD4+ CD8+ CD16+56 8±7.09 26.48±6.24 19.33±7.54 1.38±0.46 Control 34 69.09±7.23 12.29±9.67 34.29±6.12 31.68±6.69 19.38±7.32 1.16±0.35 t value -1.963 4.344 0.122 -3.573 -0.033 2.327 P value 0.053 0.037 0.904 0.001 0.973 0.023
表2 Hp感染腹痛患儿、成人及正常对照组外周血淋巴细胞亚群检测结果(%,±s)Tab.2 Peripheral blood lymphocyte subset among children's and adult's abdominal pain group with Hp infection(%,±s)
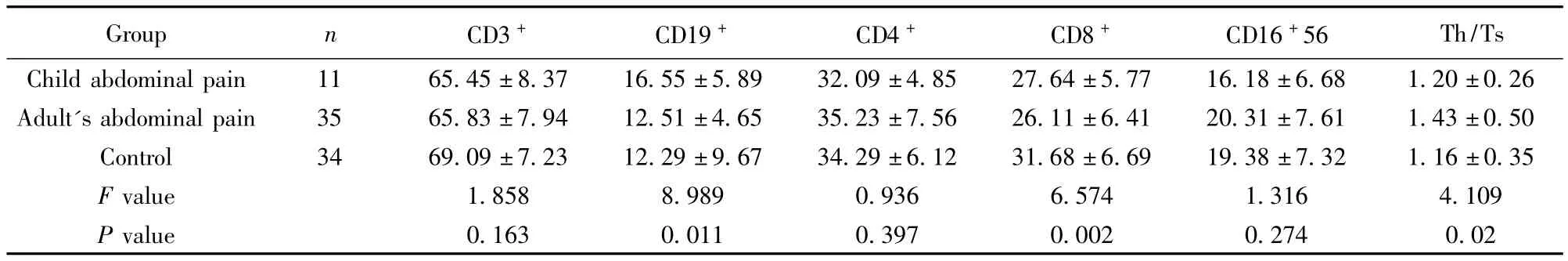
表2 Hp感染腹痛患儿、成人及正常对照组外周血淋巴细胞亚群检测结果(%,±s)Tab.2 Peripheral blood lymphocyte subset among children's and adult's abdominal pain group with Hp infection(%,±s)
Th/Ts Child abdominal pain 11 65.45±8.37 16.55±5.89 32.09±4.85 27.64±5.77 16.18±6.68 1.20±0.26 Group n CD3+ CD19+ CD4+ CD8+ CD16+56 Adult's abdominal pain 35 65.83±7.94 12.51±4.65 35.23±7.56 26.11±6.41 20.31±7.61 1.43±0.50 Control 34 69.09±7.23 12.29±9.67 34.29±6.12 31.68±6.69 19.38±7.32 1.16±0.35 F value 1.858 8.989 0.936 6.574 1.316 4.109 P value 0.163 0.011 0.397 0.002 0.274 0.02
2.2 Hp感染腹痛患儿、成人及正常对照组外周血淋巴细胞亚群检测结果(见表2) CD19+在三组间的值呈偏态分布和方差不齐采用秩和检验,其余为近似正态分布用采用单因素方差分析。腹痛患儿组CD19+(%)较腹痛成人组及正常对照组显著增加(χ2=8.989,P=0.011),腹痛成人组与正常对照组间两两比较无统计学意义。腹痛患儿组及腹痛成人组外周血CD8+(%)较正常对照组均显著降低(F=6.574,P=0.002),但腹痛患儿组与腹痛成人组两两比较,外周血CD8+(%)无统计学意义。腹痛成人组外周血CD4+/CD8+比值高于正常对照组及腹痛患儿组(F=4.109,P=0.020),但腹痛患儿组与正常对照组间两两比较无统计学意义。
3 讨论
Hp感染患者的胃粘膜中存在大量B细胞,同时检测到高滴度的IgG、IgM和IgA。在患者活检组织中,亦能观察到抗体包被细菌的现象,均提示存在活动性体液免疫反应。目前认为Hp诱导宿主B细胞免疫应答的途径包括Hp可溶性产物的被动吸收、上皮细胞直接内吞细菌抗原、抗原通过被破坏的胃上皮进入组织激发机体免疫应答[3]。本研究中反复腹痛组外周血CD19+比正常对照组增加明显,且反复腹痛患儿外周血CD19+比反复腹痛成人组增加,说明Hp感染宿主致病时外周血B细胞增加,患儿组增加更明显,B细胞免疫反应活跃,这提示机体体液免疫反应在Hp致病性中发挥着作用。
Hp感染时胃上皮细胞可呈递抗原,起到非专职性抗原呈递细胞的作用,进而介导免疫反应。宿主出现抗原特异性T细胞,主要是由于CD4+T辅助细胞在固有层内积聚。研究表明慢性活动性胃炎与CD4+/CD8+T细胞比例升高相关[4]。本研究11个家庭反复腹痛患儿及家庭成员46名Hp感染患者外周血CD3+、CD4+T淋巴细胞无明显变化。CD8+T淋巴细胞明显降低。CD4+/CD8+比值明显升高与文献相符,可能因粘膜局部淋巴细胞浸润增加,则外周血中能检测的淋巴细胞减少。本研究显示抑制性T淋巴细胞数量减少,辅助性T淋巴细胞数量相对增多,导致辅助性T淋巴细胞功能相对亢进,抑制性T淋巴细胞功能相对不足,使T淋巴细胞的免疫调节失衡,引起细胞免疫损伤;同时导致B淋巴细胞功能亢迸,产生大量自身抗体,进一步损伤机体。另外辅助性T淋巴细胞功能相对亢进,可引起辅助性T细胞Th1型和Th2型应答,可表现为Th1在胃粘膜内发挥宿主免疫应答并分泌炎性介质白细胞介素(Interleukin,IL)12、IL-18、肿瘤坏死因子 α和干扰素γ等细胞因子;Th2细胞参与粘膜表面的分泌性免疫应答和过敏反应,分泌IL-4、IL-5、IL-6、IL-10等细胞因子,参与本类疾病的发病过程。
自然杀伤细胞(Natural killer cells,NK cells)的杀伤活性无MHC限制,不依赖抗体,因此称为自然杀伤活性,NK细胞是不同于T、B淋巴细胞具有直接杀伤靶细胞效应的特殊淋巴细胞。NK细胞作为固有免疫系统的重要组成部分,可以在无预先活化的情况下对病原体的入侵作出快速广泛的应答,杀伤靶细胞并释放细胞因子,尤其是IFN-γ。NK细胞的效应功能受宿主或病原体的调控,可以由NK细胞表面活化性受体与宿主或病原体细胞表面配体的结合而启动[5]。NK细胞也会对其它信号作出应答,尤其是抗原提呈细胞分泌的细胞因子,诱导NK细胞对病原体的入侵发挥早期的宿主应答[6]。本研究中11个家庭46名成员反复腹痛组外周血NK细胞与正常对照无差异,可能因Hp感染为慢性感染,NK细胞发挥作用在感染的早期有关。
本研究还发现在同一家族家庭成员中有的Hp感染患病,有的被感染而未患病,而同一家族家庭成员的生活方式和所处的环境基本相同,却出现不同结果。说明Hp感染致病性与宿主的自身免疫遗传因素不同有密切关系。另外,本研究中发现CD8+T淋巴细胞明显降低,且CD4+/CD8+比值明显升高,基于Hp的慢性感染可通过B细胞激活并诱导自身抗体的产生而致自身免疫紊乱[7]。这提示Hp感染致病性与宿主的自身免疫遗传因素有密切关系。
总之,Hp感染反复腹痛患儿及家庭成员外周血淋巴细胞亚群存在明显异常,B细胞免疫应答及T细胞免疫应答均较活跃,可能与疾病的进展及不同结局有关。本研究提示外周血淋巴细胞亚群异常与Hp感染后的致病性相互间是有影响和内在联系的。
1 Correa P,Piazuelo M B.Natural history of Helicobacter pylori infection[J].Dig Liver Dis,2008;40(7):490-496.
2 中华医学会消化病学分会.第三次全国幽门螺杆菌感染若干问题共识报告[J].中华医学杂志,2008;88(10):652-656.
3 Baldari C T,Lanzavecchia A,Telford J L.Immune subversion by Helicobacter pylori[J].Trends Immunol,2005;26(4):199-207.
4 Krenska-Wiacek A,Szaflarska-Szczepanik A,Wysocki M.Flow cytometric analysis of peripheral blood lymphocytes in children with chronic gastroduodenitis with and without Helicobacter pylori infection[J].Pol Merkur Lekarski,2002;13(74):107-110.
5 Arase H ,Mocarski E S,Campbell A E et al.Direct recognition of cytomegalovirus by activating and inhibitory NK cell receptors[J].Science,2002;296(5571):1323-1326.
6 Moretta L,Ferlazzo G,Bottino C et al.Effector and regulatory events during natural killer-dendritic cell interactions[J].Immunol Rev,2006;214:219-228.
7 Yamanishi S,Iizumi T,Watanabe E et al.Implications for induction of autoimmunity via activation of B-1 cells by Helicobacter pylori urease[J].Infect Immun,2006;74(1):248-256.