骨髓间充质干细胞治疗小鼠胶原性关节炎MMP-2及MMP-9 mRNA表达的影响①
2011-11-27牛广华高玉洁高明利王柏山辽宁中医药大学附属医院沈阳110032
牛广华 高玉洁 高明利 郭 鹤 王柏山 (辽宁中医药大学附属医院,沈阳 110032)
类风湿关节炎(Rheumatoid arthrits,RA)作为一种发病机理不同,治疗效果不佳,致残率很高的自身免疫性疾病,至今无满意的治疗药物,传统的慢作用抗风湿药副作用大,患者耐受性差,新型的生物制剂费用昂贵,不能口服,体内清除快,靶向性差,而骨髓间充质干细胞移植治疗从理论上可克服以上缺陷,是一种新的非常有前途的治疗手段。
骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)是一种存在于骨髓中的非造血干细胞,具有自我更新、高度增殖及多向分化的能力。随着对BMSCs研究的不断深入,BMSCs自体或异体骨髓移植已经证实在治疗自身免疫病中有确切的疗效,并已成为治疗自身免疫病的一种新的趋势。
基质金属蛋白酶(Matrix metalloproteinases,MMPs)在RA关节骨及软骨的破坏中发挥重要作用[1]。RA患者滑液及滑膜细胞均有MMPs的高表达[2]。MMP-2、MMP-9与RA的病情严重程度及关节破坏相关,MMP-2、MMP-9是明胶酶,其作用的底物是关节软骨的重要组成成分。动物实验也证实,MMP-2、MMP-9与RA的病情严重程度及关节破坏相关。
为此本项目通过BMSCs移植治疗小鼠Ⅱ型胶原性关节炎(CIA)的实验研究,观察BMSCs治疗胶原鼠组织中MMP-2及MMP-9表达的影响,并进一步探讨BMSCs影响MMP表达的调节机制,为BMSCs治疗人类RA提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂及药物 ①牛Ⅱ型胶原(collagen from bovine nasal septutm,C7809,5 mg,Sigma 公司);②弗氏完全佐剂(Fveunds complete adjuvant,098K8729-CAS 9007-81-2,10 ml,Sigma公司);③流式细胞仪抗体 PE-CD34,FITC标记的小鼠抗体(Pharmingen公司)。
1.2 实验方法
1.2.1 BMSCs的体外分离和表型鉴定 ①以健康C57BL/6(H-2b)小鼠为供体,股骨、胫骨离断,自骨髓腔内获取骨髓标本,收集骨髓标本5份,按2∶1的比例加入Ficoll-Hypaque分离液(密度1.077)中,并采用梯度密度离心法分离单个核细胞,用PBS液洗涤3~4遍,用1 ml生理盐水重悬。②干细胞分选:应用美国BD公司FAcscaliburTM型分选式细胞分析仪;进行骨髓的 CD44+细胞分选。收集分选的CD44+阳性细胞,PBS充分洗涤后,以生理盐水重悬,并调整成浓度为2×106ml-1的细胞悬液。处理完毕的采集物通过低温冻存以备回输。③BMSCs鉴定:流式细胞术检测BMSCs表面抗原,BMSCs高表达 CD29、CD44、CD71,而 CD34、CD45 阴性。分别取100 μl细胞与抗鼠 CD45、CD44、CD105、CD71 抗体在室温下充分反应30分钟,用PBS洗涤2次,重悬于PBS液中,流式细胞仪测定其表型。确定所分离的BMSCs的纯度(具体操作按试剂说明书进行),用system 11软件分析结果。每个样本至少分析10 000个细胞。
1.2.2 实验分组 近交系C57BL/6(H-2b)小鼠40只,动物年龄45~50天,体重(17±3)克,随机分为:正常对照组、模型组、甲氨喋呤治疗阳性对照组、BMSCs移植治疗组,每组10只小鼠。
1.2.3 建立CIA动物模型 除正常组外,寒冷刺激10天后,将10 mg牛Ⅱ型胶原(BⅡC)与5 ml弗氏完全佐剂研磨后,以每只100 μl于小鼠背部、踝部、尾根部皮内注射免疫,免疫注射14天按上述方法少量再次腹腔内注射,作为激发注射免疫。之后对各组大鼠的发病情况进行观察。主要为关节水肿,皮肤红斑及关节活动情况等。第15天开始移植治疗,于42天对各组小鼠的膝及肘以下关节进行组织病理学分析。
1.2.4 BMSCs(输注)途径及剂量 均采用尾静脉注射途径:CIA小鼠二次免疫接种后第2天,除模型组、正常对照组用生理盐水,余以2×106细胞数/kg体重的密度将BMSCs注入小鼠尾静脉内。
1.2.5 甲氨喋呤(输注)途径及剂量 采用每次甲氨蝶呤0.017 5 g/kg对甲氨喋呤阳性治疗对照组小鼠进行灌胃,每5天一次,直到实验倒数第2天。42天后将小鼠处死取材。
1.2.6 实验场所 辽宁中医药大学动物实验中心、辽宁中医药大学病理技术实验中心。
1.3 MMP-2、MMP-9 mRNA 检测
1.3.1 取材方法 停药后处死小鼠,解剖取肿瘤组织,完整剥离后称重,取脾组织1 cm×0.15 cm×0.15 cm,放入冻存管,迅速投入液氮罐,用以检测MMP-2、MMP-9 mRNA。
1.3.2 RNA提取 采用Trizol一步法RNA提取试剂盒提取脾组织总RNA,用分光光度计测定吸光度值(OD)值,并用电泳法鉴定分子完整性。
1.3.3 逆转录反应 采用逆转录酶链反应(RTPCR)方法。
1.3.4 PCR 扩增 10×Buffer 5 μl,25 mmol/L MgCl23 μl,2.5 mmol/L,dNTP 4 μl,引物各 1 μl,cDNA 10 μl,Taq 酶0.15 μl,加双蒸水后总体积达50 μl,振荡混匀。循环条件:94℃预变性2分钟,94℃变性30秒,57℃退火30秒,72℃延伸30秒,30个循环;72℃后延伸7分钟。扩增产物在112%琼脂糖凝胶上进行电泳,以凝胶成像系统进行半定量分析,用MMP-2、MMP-9与β-actin比值表示其相对表达水平。MMP-2引物序列:上游5'-ATGCGGAAGCCAAGATGTG-3',下游 5'-GTCCAGGTCAGGTGTGTAAC-3',扩增产物长度126 bp;MMP-9引物序列:上游 5'-TGAGTCCGGCAGACAATCC-3',下游5'-CCTTATCCACGCGAATGACG-3',扩增产物长度432 bp;β-actin引物序列:G1:5'ACCACCATGGAGAAGGCTGG 3';G2:5'CTCAGTGTAGCCCAG-GATGC 3',扩增产物长度528 bp。
2 结果
2.1 RNA质量鉴定 所提组织总RNA经紫外分光光度计测定:OD260/OD280在1.8~2.0之间,经甲醛变性琼脂糖凝胶电泳,获得了两条较清晰的电泳带,18S和28S,其中28S的量约为18S的两倍,证实RNA的完整性(图1)
2.2 各组MMP-2 mRNA表达水平的影响 MMP-2 mRNA的RT-PCR分析凝胶电泳结果显示,在126 bp处呈现出一特异性条带(见图2)。以528 bp βactin扩增产物作为内参照进行半定量分析(图2、表1),由表可见CIA鼠模型组脾组织表达的MMP-2 mRNA明显高于正常对照组、甲氨蝶呤治疗组、BMSCs移植治疗组(P<0.05);而BMSCs移植治疗组与甲氨蝶呤治疗组有显著性差异(P<0.05),与正常对照组无显著性差异(P>0.05)。
2.3 各组MMP-9 mRNA表达水平的影响 MMP-9 mRNA的RT-PCR分析凝胶电泳结果显示,在432 bp处呈现出一特异性条带(见图3)。以528 bp βactin扩增产物作为内参照进行半定量分析(图3、表1),由表可见CIA模型组脾组织表达的MMP-9 mRNA明显高与正常对照组、甲氨蝶呤治疗组、BMSCs移植治疗组(P<0.05);而BMSCs移植治疗组与甲氨蝶呤治疗组有显著性差异(P<0.05),与正常对照组无显著性差异(P>0.05)。
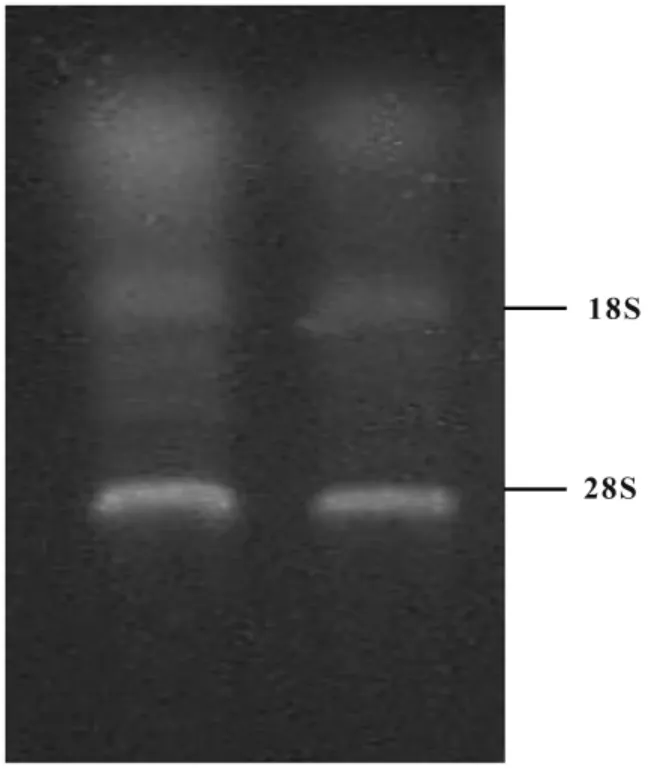
图1 RNA质量鉴定Fig.1 RNA quality identification
2.4 各组灰度值的比较 β-actin灰度值结果显示(见表1):BMSCs移植治疗组与正常对照组无统计学差异(P>0.05);CIA模型组小鼠与正常对照组比较有统计学差异(P<0.05);甲氨蝶呤治疗组与CIA模型组小鼠比较有统计学差异(P<0.05);而BMSCs移植治疗组与甲氨蝶呤治疗组有显著性差异(P<0.05)。
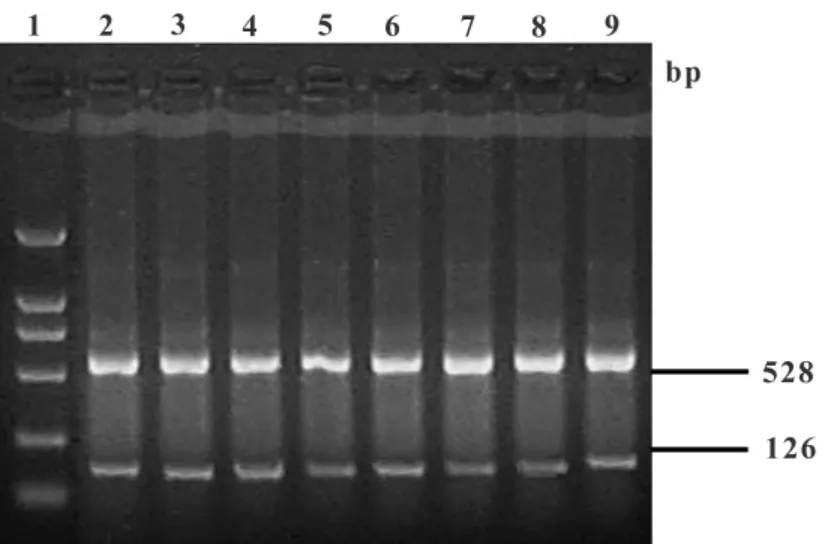
图2 各组组织中MMP-2 mRNA的表达结果Fig.2 The expression of MMP-2 mRNA in each organization
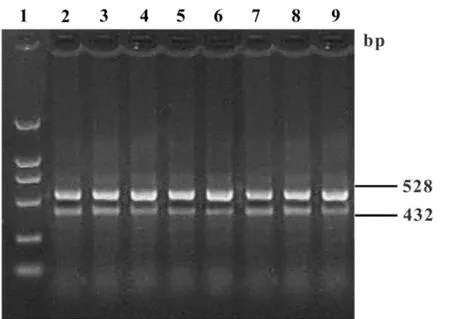
图3 各组组织中MMP-9 mRNA的表达结果Fig.3 The expression of MMP-9 mRNA in each organization
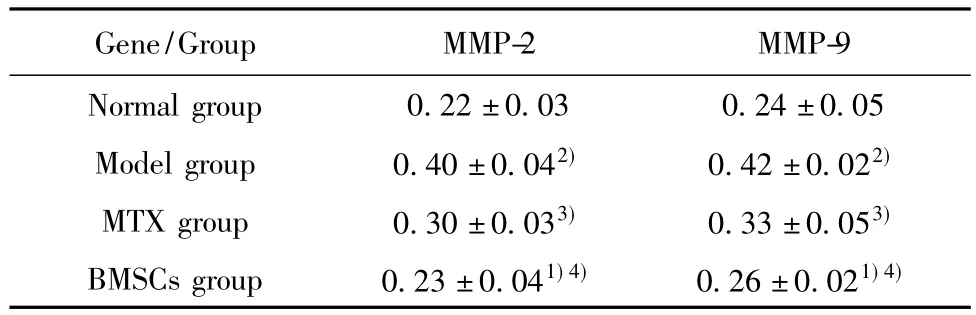
表1 各基因组灰度值比β-actin灰度值(μmol/L)Tab.1 The ratio of gray value genome and β-actin(μmol/L)
3 讨论
MMPs是一类含有锌原子,其活性依赖于钙原子的肽链内切酶,大都以潜酶形式分泌。MMP-2和MMP-9是其中一大类,又名明胶酶,相对分子质量分别为72 000、95 000。由于其是构成细胞外基质(Extracellular matrix,ECM)降解最重要的酶系统,参与EMC的重塑、炎症反应、免疫应答等[1],近几年成为研究热点。
MMPs对细胞外基质EMC的降解是RA患者关节破坏的必要环节[2,3]。近年发现RA患者的滑液及外周血中 MMP-2,MMP-9 水平均增高[4,5]。Uchibori等[6]对关节炎模型小鼠研究也证明 MMP-2、MMP-9在关节炎的发病中起一定作用。我们的测定表明,RA患者血清中MMP-2、MMP-9水平显著高于健康对照,提示血清MMP-2、MMP-9水平与RA病情活动相关,在RA的骨破坏中可能起作用。Makowski等[7]揭示MMP-9与抗-双链DNA呈负相关,在抗体沉积在组织期间,对监测SLE疾病的活动非常重要。Derosa等[8]发现酶谱分析是检查MMPs水平的精确方法,当MMPs的量高于400 pg,其活性才能被检测,其表达量与其活性的比率为7∶1。因此,该实验不仅用于定量检测酶的总量,而且还可检测酶量与活性的比例,这使得酶谱不同于 ELISA,ELISA不能分辨酶的活性和非活性形式[9]。而酶谱结果能够反映研究对象的MMPs活性,通过研究MMPs的表达水平和活性,MMPs在RA和SLE中作用能较清楚地反映出来。在正常的人体组织中,MMPs的表达较低,但在一定的病理过程中其表达水平可升高。细胞外信号,包括细胞因子、生长因子和直接的细胞与细胞之间的接触能瞬时刺激MMPs蛋白的合成[1]。SLE是一种自身免疫性疾病,其特征是以Th2细胞介导的体液免疫反应为主,而RA则是以Th1细胞介导的细胞免疫反应为主。鉴定为什么这两种不同免疫反应的患者血清中MMP-2和MMP-9显著增加的机制是非常有意义的。一种可能的解释是:不管在RA或SLE中,免疫反应过程中核转录因子(NF-κB)组成式激活,上调各种细胞因子的转录活性,提高炎性反应的细胞因子接着刺激MMPs的表达和活性[1]。但是,这种解释需要进一步研究。总之,RA和SLE患者血清中MMP-2和MMP-9的表达水平和活性显著升高,因此MMPs蛋白在自身免疫性疾病中起一定的作用,可作为该类疾病的一种辅助检测指标。
本研究通过RT-PCR法检测和凝胶图像分析结果显示在CIA小鼠脾组织中MMP-2和MMP-9的表达明显增加。这点与别的文献报道一致[10]。而经过BMSCs移植治疗后MMP-2和MMP-9的表达明显下降,统计学处理有显著性差异(P<0.05),从而证明BMSCs对CIA小鼠移植治疗后MMP-2和MMP-9有免疫调节作用。本实验也说明BMSCs可以通过调控MMP-2、MMP-9 mRNA表达,参与RA软骨的病理变化过程及软骨ECM的合成,维持软骨ECM中胶原纤维网络构架,可有效地治疗RA,并改善其临床症状,是一种很有前途的生物治疗方法。
1 Gillian M,Vera K,Susan A et al.Matrix metalloproteinases in arthritic disease[J].Arthritis Res,2002;4(suppl 3):539-540.
2 Yoshihara Y H,Nakamura K,Obata H et al.Matrix metallo-proteinases and tissue inhibitors of metalloproteinases in synovialfluids from patients with rheumatoid arthritis or osteoarthritis[J].Ann Rheum Dis,2000;59:455-459.
3 Gaye C,Oliver F G,Charlotte B et al.Early joint erosions and serum levels of matrix metalloproteinase 1,matrix metalloproteinase 3,and tissue inhibitor of metalloproteinases 1 in rheumatoid arthritis[J].Arthritis Rheum,2001;44(10):2263-2274.
4 Yamanaka H K,Makino M,Takizawa H et al.Expression and tissue localization of membrane-types 1,2,and 3 matrix metalloproteinases in rheumatoid synovium[J].Lab Invest,2000;80:677-680.
5 Giannelli G,Erriquez R,Iannone F et al.MMP-2,MMP-9,TIMP-1 and TIMP-2 levels in patients with rheumatoid arthritis and psoriatic arthritis[J].Clin Exp Rheumatol,2004;22(3):335-338.
6 Uchibori M,Nishida Y,Tabata I et al.Expression of matrix metalloproteinases and tissue inhibitors of metalloproteinases in pigmented villonodular synovitis suggests their potential role for joint destruction[J].J Rheumatol,2004;31(1):110-119.
7 Makowski G S,Ramsby M L.Concentrations of circulating matrix metalloproteinase 9 inversely correlate with autoimmune antibodies to double stranded DNA:implications form onitoring disease activity in systemic lupus erythematosus[J].Mol Pathol,2003;56(4):244-247.
8 Derosa G,Avanzini M A,Geroldi D et al.Matrix metalloproteinase maybe a marker of microangiopathyin children and adolescents with type 1 diabetes mellitus[J].Diabetes Res Clin Pract,2005;70(2):119-125.
9 Kleiner E D,Stetler-Stevenson W G.Quantitative zym o-graphy:detection of picogram quantities of gelatinases[J].Anal Biochem,1994;218(2):325-329.
10 Ainiala H,Hietaharju A,Dastidar P et al.Increased serum matrix metalloproteinase 9 levels in systemic lupus erythematosus patients with neuropsychiatric manifestations and brain magnetic resonance imaging abnormalities[J].Arthritis Rheum,2004;50(3):858-865.