斑点叉尾鮰败血症病原的分离与鉴定
2011-11-24戴振炎刘小燕陈冬香余建波李权生潘望城
戴振炎,刘小燕,陈冬香,余建波,李权生,钟 蕾,潘望城
(1.湖南农业大学动物科学技术学院,中国 长沙 410128; 2.安化县移民局,中国 安化 413500)
嗜水气单胞菌(Aeromonashydrophila,Ah)属弧菌科(Vibronaceae)气单胞菌(Aeromonas),为嗜温、有运动性的气单胞菌群.是一种在水体中广泛存在的细菌,可引起鱼类及其它水生动物多种疾病[1-2].
斑点叉尾鮰(Ictaluruspunctatus)亦称沟鲶,是较适宜深加工的优质淡水鱼.我国于1984年引进该品种,并于1987年人工繁育成功[3].目前已成为湖南名优鱼中养殖规模与产量最大的品种,速冻鱼片运销欧美和东南亚国家,具有较为明显的经济效益与社会效益及产业化发展优势,能进一步促进我国渔业饲料工业的发展、水产品加工及其出口贸易等产业,形成了完整的产业链.但是随着引进时间的推移,由于养殖方式的不完善,经常有新的病害发生,其中最主要的是细菌感染引起的疾病[4].近几年陆续在湖南柘溪水库、五强溪水库、凤滩水库等地的网箱养殖中发生了一种严重危害斑点叉尾鮰健康的急性型败血症,该病具有发病突然,死亡率高,传染快等特点.作者以典型症状的病鱼作为材料,分离出优势菌株,通过菌株的分离鉴定,并进行人工感染试验等方法,对其致病菌进行了研究.
1 材料与方法
1.1 试验材料
1.1.1 患病的斑点叉尾鮰 2009年3~5月,取自湖南柘溪水库安化库区龙栖村和宝塔山村的网箱养殖基地(成鱼:平均体长24±2 cm,平均体重500±10 g;鱼种:平均体长12±2 cm,平均体重45±10 g).
1.1.2 健康的斑点叉尾鮰 取自湖南农业大学东方鑫座斑点叉尾鮰养殖基地.平均体长18±2 cm,平均体重80±10 g,喂养在100 L的水泥池中,每天投喂1次.池中的水为曝气48 h的自来水,水温控制在28±2 ℃,两天换水1次.
1.2 病原菌的分离
无菌条件下,取发病症状典型的濒死斑点叉尾鮰,用无菌水冲洗干净,再用70%的酒精棉球反复擦拭病鱼的腹部和体表进行消毒,用无菌剪刀剪开腹腔,用接种环从病鱼的鳃、肠壁、肝、脾、肾等处取样,划线接种于普通牛肉膏蛋白胨培养基上,置于电热恒温培养箱内28 ℃培养24~28 h后,挑取形态特征一致的优势菌落进行重复划线纯化培养,然后将纯化的菌株转接种到斜面培养基于4 ℃保存备用[5].
1.3 人工感染试验
1.3.1 病毒感染试验 在病原菌分离的同时,将病鱼的肠、肝、脾、肾等组织剪碎、匀浆,12 000 r/min离心2 min,取其上清液用0.22 μm微孔滤膜过滤除菌,以无菌操作将得到的滤液进行平板划线,28 ℃,培养24 h,观察滤液是否有菌落生长,确认无菌后取10尾健康的斑点叉尾鮰,腹腔注射得到的无菌滤液,每尾注射0.4 mL;同时设对照组,每尾注射0.4 mL的无菌生理盐水.试验组和对照组放在28 ℃水温的不同水池内饲养,观察斑点叉尾鮰的发病情况,并记录结果.
1.3.2 细菌感染试验 将分离到的细菌接种于普通牛肉膏蛋白胨培养基斜面,28 ℃恒温培养24 h,用无菌生理盐水冲洗下菌苔.试验共设4个处理,3个重复. 每个处理用叉尾鮰10尾.处理1:取无病斑点叉尾鮰,从腹鳍基部注射含菌群数为1.5×108个/mL的菌悬液,每尾注射0.4 mL ;处理2,每尾注射0.4 mL的6.5 g/L的无菌生理盐水,作为处理1的对照.处理3:取无病斑点叉尾鮰,人为创伤感染,即用灭菌解剖刀划破鱼体体表皮肤,浸泡在含菌群数为5.0×108个/mL的菌悬液中2 h后转入不同水池中正常饲养;处理4:取同样大小创伤、未创伤的健康斑点叉尾鮰,用6.5 g/L无菌生理盐水浸泡2 h,为处理3的对照.试验组和对照组分别放在水温28 ℃的不同水池中饲养,观察斑点叉尾鮰的发病情况,记录鱼的死亡数量及症状.
1.3.3 回归感染试验 选择人工感染患病症状与自然发病症状相似的肠、肝、肾等组织进行再分离,挑取与原来人工感染试验形态特征一致的单个菌落,再次进行人工感染试验,观察斑点叉尾鮰发病情况,并记录结果.
1.4 分离菌的鉴定
1.4.1 生理生化鉴定 将病原菌在28 ℃的恒温培养箱中培养24 h后,观察菌落的形态特征,并进行革兰氏染色.按照《常见细菌系统鉴定手册》[6]、《伯杰细菌鉴定手册》(第九版)[7]和中国科学院微生物研究所 《一般细菌常用鉴定方法》[8]中的方法进行生理生化性质测定.另外,取单个菌落纯化培养后用Bio Merieux Vitek全自动微生物分析系统进行细菌鉴定,该步骤由长沙市天地人微生物实验室进行.
1.4.2 分子生物学鉴定 取1 mL培养好的菌液,用TIANGEN DNA试剂盒提取总DNA.抽提细菌的基因组DNA在8 g/L琼脂糖凝胶电泳上观察检验,并作为PCR扩增的模板.选用1对扩增细菌16S rDNA的通用引物,引物序列如下:上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物5′-TACGGCTACCTTGTTACGACTT-3′.PCR反应体系(50 μL)为:模板DNA 4 μL,上、下游引物各2 μL(引物浓度10 μmol/L),2×PCR MasterMix 25 μL,加ddH2O至50 μL混匀.PCR反应条件为:94 ℃预变性10 min;94 ℃变性1 min,65 ℃退火1 min,72 ℃延伸2 min,共进行30个循环;最后72 ℃温育10 min结束反应.取5 μL 的反应液用8 g/L琼脂糖凝胶进行电泳检测,在凝胶成像系统下将目的条带切下,用TIANGEN琼脂糖凝胶DNA回收试剂盒回收纯化,纯化后送至上海生工公司进行序列测定,将所得到的16S rDNA序列运用NCBI的BALST程序进行同源序列比对[9-10].
2 结果与分析
病鱼的自然发病症状:病鱼主要表现为体表 ( 特别是腹部和下颌 ) 充血、出血(图1a),肛门红肿( 图1b).病鱼鳃丝肿胀发白,粘附大量黏液.腹部膨大( 图1b),解剖病鱼腹腔内充满大量含血的腹水 ( 图1c),胃肠道粘膜充血、出血,胃肠道内没有食物,胃底部和幽门部粘膜充血、出血( 图1c、d、e).肝肿大,颜色变淡,有的呈土黄色,部分鱼可见出血斑,质地变脆,胆囊扩张,胆汁充盈;脾、肾肿大,淤血,部分病鱼可见鳔和脂肪充血和出血( 图1e).

图1 病鱼自然发病症状
2.1 分离菌的培养特性
从发病症状典型的斑点叉尾鮰病鱼的鳃、肠壁、肝、脾、肾等处通过分离、提纯、重复回归感染试验得到3株菌FB1、FB2、FB3,3株菌在普通牛肉膏蛋白胨培养基平板上都生长良好,形成表面湿润光滑、边缘整齐、中央微隆起、灰白色半透明的中等大小圆形菌落.
2.2 人工感染试验
2.2.1 病毒感染试验 在经过滤膜过滤后的滤液的划线培养试验中,没有发现细菌生长,证明滤液无菌.将过滤后无菌的滤液注射感染健康斑点叉尾鮰,未出现病症和死亡,其结果表明了斑点叉尾鮰败血症不是由病毒引起的.
2.2.2 细菌感染试验 见表1,腹腔注射FB1菌株的斑点叉尾鮰在9 d内全部死亡,注射FB2、FB3菌株死亡现象不明显;而对照组无任何症状和死亡现象.FB1实验组体表溃烂,体内各器官充血、出血,腹腔内有腹水;FB2、FB3部分实验鱼肠壁开始变薄,继续饲养20 d后,解剖实验鱼出现套肠症状.
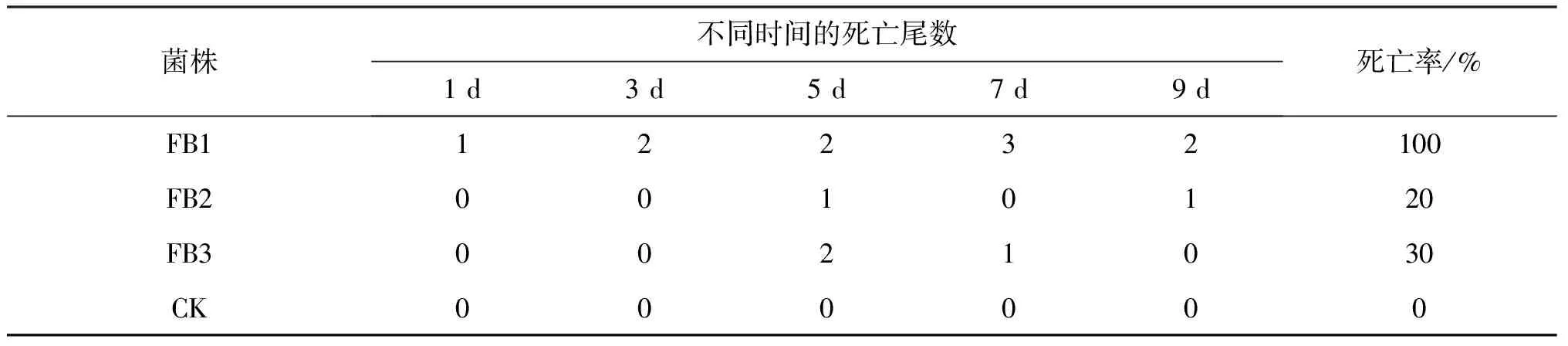
表1 人工注射感染试验结果
创伤浸浴感染FB1菌株的斑点叉尾鮰在9 d内全部相继死亡,见表2,FB2 、FB3死亡率均为20%;而未创伤浸泡感染FB1、FB2、FB3菌株的死亡率都低于创伤浸泡感染组,斑点叉尾鮰在9 d内死亡率分别为:60%、0%、10%.对照组无任何症状和死亡现象.
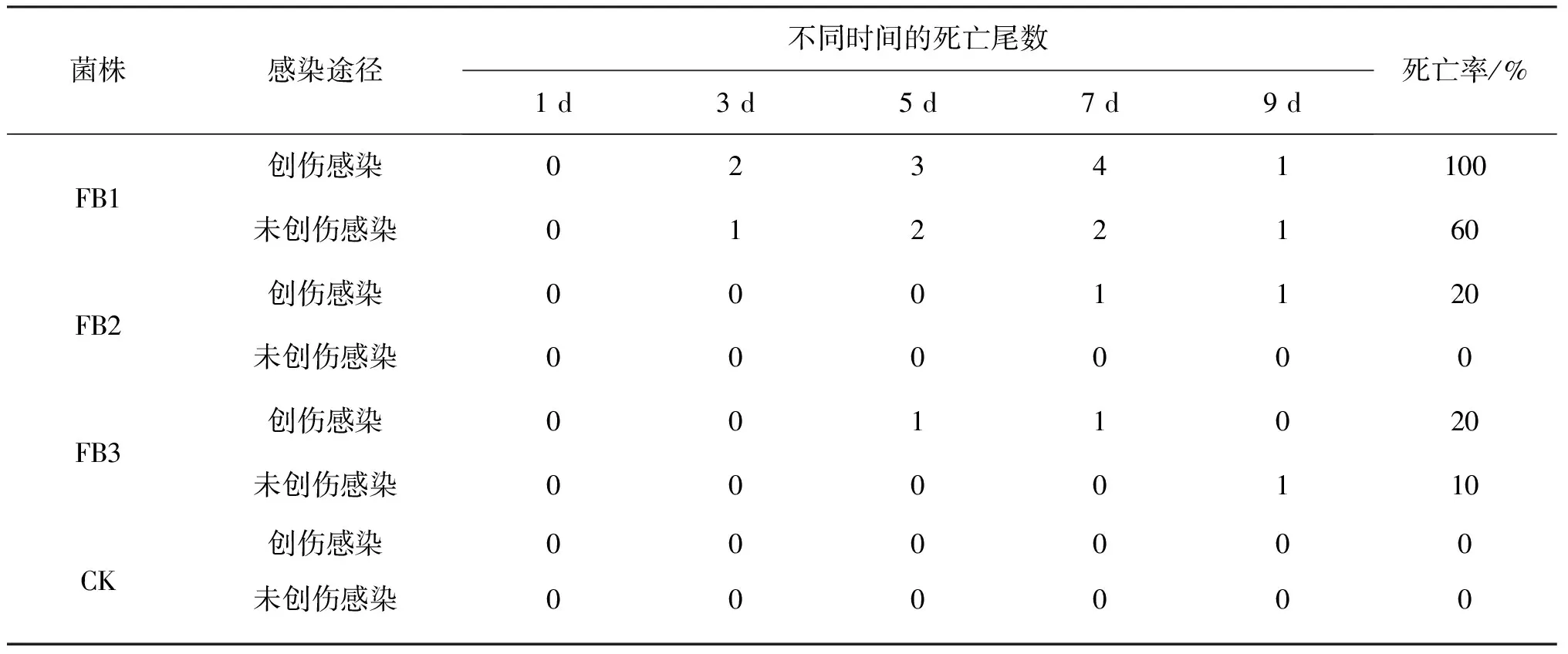
表2 浸泡感染试验结果
2.2.3 回归感染试验 在人工注射感染和人工浸泡感染试验中出现与自然发病情况下相似症状的鮰鱼的鳃、肠、肝、肾等组织处分别分离到与原病原菌一致的菌株,经再次感染又可分离到FB1菌株,这说明FB1菌为斑点叉尾鮰细菌性败血症的致病菌.
2.3 分离菌的鉴定
2.3.1 生理生化特性鉴定 对分离到的3株菌FB1、FB2、FB3进行生理生化测定,结果见表3.由表3可见,3株菌都属于革兰氏阴性杆菌,FB1为兼性厌氧的革兰氏阴性短杆菌,极生单鞭毛,具运动力,无芽孢,无荚膜.能发酵葡萄糖、麦芽糖、蔗糖、甘露糖等产酸但不产气,不发酵肌醇、木糖等,氧化酶、过氧化氢酶、DNA酶、酯酶、赖氨酸脱羧酶阳性,鸟氨酸脱羧酶、脲酶阴性,还原硝酸盐,产H2S,胨化牛奶,液化明胶.经湖南天地人生物有限公司Bio Merieux Vitek全自动微生物分析系统鉴定FB1为嗜水气单胞菌.FB2和FB3经检测鉴定为嗜麦芽寡养单胞菌.专性需氧,非发酵型的革兰氏阴性极生多鞭毛短杆菌.氧化酶阴性,过氧化氢酶、蛋白酶、脲酶、赖氨酸脱羧酶阳性,不产H2S,还原硝酸盐,水解明胶和七叶苷.在氧化发酵试验中除分解麦芽糖产酸明显外,其余的都产酸缓慢或不产酸.
2.3.2 分子生物学鉴定 FB1的测序结果如下:
CCTCCATGAACTTACGGCCAGGGCTACACACGTGCTACAATGGCGCGTACAGAGGGCTGCAAGCTAGCGATAGTGAGCGAATCCCAAAAAGCGCGTCGTAGTCCGGATCGGAGTCTGCAACTCGACTCCGTGAAGTCGGAATCGCTAGTAATCGCAAATCAGAATGTTGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGGGAGTGGGTTGCACCAGAAGTAGATAGCTTAACCTTCGGGAGGGCGTTTACCACGGTGTGATTCATGACTGGGGTGAAGTCGTAACAAGGTAACCCTAGGGGAACCTGCGGTTGGATCCAGTCCTA
大小为342 bp.FB1菌株16S rDNA序列的GenBank登录号为HM161724.
FB2的测序结果如下:
CCTCTCATGGACTTACGGCCAGGGCTACACACGTACTACAATGGTAGGGACAGAGGGCTGCAAGCCGGCGACGGTAAGCCAATCCCAGAAACCCTATCTCAGTCCGGATTGGAGTCTGCAACTCGACTCCATGAAGTCGGAATCGCTAGTAATCGCAGATCAGCATTGCTGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGGGAGTTTGTTGCACCAGAAGCAGGTAGCTTAACCTTCGGGAGGGCGCTTGCCACGGTGTGGCCGATGACTGGGGTGAAGTCGTAACAAGGTAGCCGTATCGGAAGGTGCGGTTGGATCACCTCCTAA
大小为345 bp.FB2菌株16S rDNA序列的GenBank登录号为HM161726.

表3 分离菌的生理生化特征
注:“+”为阳性;“-”为阴性;⊕为产酸产气.
FB3的测序结果如下:
CGTCTCATGGTCTTACGGCCAGGGCTACACACGTACTACAATGGTAGGGACAGAGGGCTGCAAGCCGGCGACGGTAAGCCAATCCCAGAAACCCTATCTCAGTCCGGATTGGAGTCTGCAACTCGACTCCATGAAGTCGGAATCGCTAGTAATCGCAGATCAGCATTGCTGCGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCGTCACACCATGGGAGTTTGTTGCACCAGAAGCAGGTAGCTTAACCTTCGGGAGGGCGCTTGCCACGGTGTGGCCGATGACTGGGGTGAAGTCGTAACAAGGTAGCCGTATCGGAAGGTGCGGTTGGATCACCTCCTAA
大小为345 bp.FB3菌株16S rDNA序列的GenBank登录号为HM161725.
将这3株细菌的16S rDNA序列递交NCBI进行BLAST分析,发现FB1的16S rDNA序列与GenBank database中AeromonashydrophiliaAF106602比对所得总分最高,具有较高的同源性(99%),且两个可变区域的序列完全一致[11].FB2和FB3的16S rDNA序列与StenotrophomonasmaltrophiliaAJ293471 的序列有99%的相似性.这与Bio Merieux Vitek全自动微生物分析系统鉴定的结果一致,确定FB1为嗜水气单胞菌,FB2和FB3为嗜麦芽寡养单胞菌.
3 讨论
(1)在人工浸泡感染试验中,创伤浸浴感染组死亡率明显高于未创伤浸浴感染组,这可能是因为鱼体体表存在大量的粘液,主要由多糖和蛋白质组成,含有大量抵抗病原微生物入侵的非特异性免疫活性物质,可以保护鱼体不受病原体的侵害[12].
(2)本研究对分离提纯得到的FB1,FB2,FB3进行微分子生物学鉴定,结果表明FB1为嗜水气单胞菌,FB2,FB3为嗜麦芽寡养单胞菌. 嗜水气单胞菌和嗜麦芽寡养单胞菌是重要的人畜共患病的病原菌,同时也是危害我国淡水养殖业的重要病原菌之一.它们可感染多种水生动物引起相应的疾病,各种淡水鱼都可感染[4,11],本研究中分离得到的嗜水气单胞菌FB1可引起叉尾鮰的肌肉及各器官组织的充血、出血与溶血等现象,而无套肠症状,这与苏应兵[13]等报道结果不一致,苏应兵[13]等报道嗜水气单胞菌会引起叉尾鮰套肠症状,而作者用FB1注射感染叉尾鮰无此症状.
(3)用FB2,FB3注射感染叉尾鮰,20 d以后检查存活的实验用鱼,有套肠症或肠道壁变薄现象,但病鱼无充血出血现象.实验还在进行中,其结果将另文报道.
参考文献:
[1] 杨先乐.特种水产动物疾病的诊断与防治[M].北京:中国农业出版社,2001.
[2] 钱 冬,陈月英.引起鱼类暴发性流行病的嗜水气单胞菌的血清型、毒力及溶血性[J].微生物学报,1995,35(6):460-464.
[3] 邬国民,陈 慈,李恒颂,等.我国斑点叉尾鮰养殖现状和前景展望[J].中山大学学报论丛,1998(4):75-79.
[4] 战文斌.水产动物病害学[M].北京:中国农业出版社,2004.
[5] 耿 毅,汪开毓,陈德芳,等.斑点叉尾鮰一株致病菌的分离鉴定及系统发育分析[J].微生物学报,2006,46(4):649-652.
[6] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[7] 布坎南.伯杰细菌鉴定手册(第九版)[M].中国科学院微生物研究所译.北京:科学出版社,1994.
[8] 中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978.
[9] THEODORE S,COENYE T,VANDAMME P.PCR-based assay for differentiation of pseudomonas species recovered from cystic fibrosis[J].J Clin Microbiol,2004,42:2074-2079.
[10] YUAN F,QU S P,CUI C S.A new strain of Eruinia carotovora subsp.Carotovora isolated from soft rotted Chinese cabbage[J].Acta Microbiol Sinica,2004(2):136-140.
[11] 陆承平.致病性嗜水气单胞菌及其所致鱼病[J].水产学报,1992,16(3):225-227.
[12] HARRIS N B,ROGERS D G.Septicemia as sociated with stenotrophomonas maltophiliaina west African dwarf crocodile ( Osteolaemu stetraspis subsp.Tetraspis ) [J].J Vet Diagn Invest,2001,13(3): 255-258.
[13] 苏应兵.斑点叉尾鮰暴发性败血症的病原及免疫预防研究 [D].武汉:华中农业大学,2006.
