金属氧化物半导体纳米晶液相法控制合成研究进展
2011-11-24施利毅王竹仪
施利毅,王竹仪,袁 帅,赵 尹
(上海大学 纳米科学与技术研究中心,上海 200444)
金属氧化物半导体纳米晶液相法控制合成研究进展
施利毅,王竹仪,袁 帅,赵 尹
(上海大学 纳米科学与技术研究中心,上海 200444)
对金属氧化物纳米晶的晶型、形貌及晶粒大小调控方法进行了综述,重点介绍了液相合成体系中表面活性剂、溶剂、杂质离子等因素对纳米晶形貌、晶型的调控作用以及各种方法的特点,提出发展绿色、高选择性合成方法制备单分散结构可控的金属氧化物半导体纳米晶仍是今后重要的研究方向之一。
金属氧化物半导体;纳米晶;液相合成;形貌;晶型
金属氧化物半导体纳米晶具有很大的比表面积,并且随着粒径的下降,表面原子数、表面能和表面张力急剧增加,由于小尺寸效应、表面效应、量子尺寸效应和宏观量子隧道效应等,表现出常规材料所不具备的新颖的物理、化学和生物学特性,在太阳能转换、电池、催化、陶瓷、传感等领域具有良好的性能及应用,从而受到广泛的研究。例如,TiO2、SnO2和ZrO2是3种具有非常重要的物理和化学性质的宽禁带金属氧化物,它们的纳米晶展现出不同于常规状态下的光电转换、气敏、和光学性质,在染料敏化太阳能电池、光电子器件、新型气敏材料、抗静电复合材料、耐磨材料和催化材料、固体电解质电池、功能涂层等领域具有广泛的应用[1]。氧化物半导体纳米晶的性质和应用取决于其晶型、形貌、大小和结晶度(缺陷)等关键因素[2]。实现微观结构调控可以更深入地研究金属氧化物半导体纳米晶微观结构和性能之间的构效关系、更好地拓展其潜在的应用,因此,研究纳米晶的可调控制备技术具有非常重要的意义[3]。
目前,人们发展了气相法如气相反应法、气相凝聚法、气相沉积法等,及液相法如共沉淀法、溶胶-凝胶法、反胶束法、水热法、溶剂热法等制备半导体氧化物纳米晶。气相法主要用于制备粉状、块状和纤维状材料,通常需要高温加热、激光诱导、等离子反应、火焰燃烧等特殊条件。溶剂热法及水热法是目前制备具有高分散性纳米材料的液相法。溶剂热法是指在密封的压力容器中,采用一定的溶剂为反应介质,在高温、高压反应环境下进行的化学反应。由于反应溶液上下部存在一定温差,当下部温度较高的饱和溶液由于对流作用被带到溶液上部时,会因温度迅速降低形成过饱和溶液而析出,从而形成结构基元,进而成核结晶[4]。当反应体系为水相时,即为水热反应。水热和溶剂热合成法的优点在于合成温度相对较低(<250 ℃),而且可以直接生成氧化物纳米晶,避免了其它液相法需要煅烧处理的过程,尽量减少了硬团聚的形成,制得的氧化物纳米晶晶粒较小、纯度高、结晶度高、分散性好,生产成本低。
本文作者以 TiO2纳米晶、SnO2纳米晶、ZrO2纳米晶等的可控制备为例,综述了近期利用溶剂热法或水热法合成形貌、晶型可调控纳米晶的研究进展。
1 半导体氧化物纳米晶的控制合成
1.1 纳米晶形貌的调控
半导体纳米晶在液相中的形成过程可分为成核与生长两个阶段,得到宽分布的纳米半导体后,可通过尺寸选择以及Ostwald效应达到窄尺寸分布的纳米体系[5]。例如XIE和YE[6]使用共沉淀与水热结合的方法合成了超细的棒状SnO2纳米晶,研究认为纳米晶的形成过程经历了Ostwald熟化过程和定向附着生长两个过程,首先形成立方体形SnO2纳米晶,然后通过(001)面的键合,形成沿[001]方向生长的 SnO2纳米棒。这说明通过控制反应时间,在不同反应阶段可以获得不同形貌的SnO2纳米晶。
通过改变反应体系的其它条件如反应温度、pH值和反应物浓度等,也可以影响纳米晶形貌,如 NOH等[7]和 ZHAO 等[8]通过调节水热反应条件利用水热法,制备出具有球形、棒状、纺锤状、树叶状、箭头状、枝杈状和水滴状等形貌的ZrO2纳米晶。
根据Wullf晶面理论和Gibbs-Curie-Wullf理论[9],在热力学平衡的状态下,晶面能大的生长速度快,晶面能小的则反之。固有的结晶表面能及其选择性表面活性剂修饰的晶相确定后,生长阶段将最终影响晶体的形貌。例如锐钛矿型纳米TiO2为四方晶系具有较好的光催化活性,其中(001)面的光催化活性较高,选择性合成具有高(001)面含量的TiO2纳米晶,可以获得高活性光催化剂,但是(001)的表面能较大,在生长过程中容易消失。但是可通过改变体系的化学组分,如添加表面活性剂、氢氟酸等方式调节各个晶面的表面能,从而控制晶体的生长。
JUN 等[10]报道了以月桂酸(LA)作选择性表面活性剂,三辛基氧化磷(TOPO)作非选择性表面活性剂,通过控制表面活性剂的量制备了子弹状、钻石型、棒状及带枝的棒状结构的锐钛矿型 TiO2晶体。CHEMSEDDINE和 MORITZ[11]报道了以有机钛源为前驱体,四烷基氢氧化铵(Me4NOH)为结构导向剂,通过调控钛前驱体与Me4NOH的相对浓度比例、反应温度及反应压强制备球状、棒状等形貌的TiO2纳米晶。包南等[12]和CHEN等[13]研究也发现:季铵碱的种类和浓度具有加速晶化速率,优化结晶度和规整度,改善产物分散性和控制形貌等多重作用。 RYU等[14]考察了具有不同有机官能团的有机碱(R3NOH、R=H、CH3、C2H5和C4H9等)对水热法制备的TiO2纳米粒子形貌的影响,制备的TiO2纳米粒子的分散性较好,晶粒随有机官能团碳链的增长而减小,添加TEAOH条件下制备的TiO2晶粒为12 nm,对染料 Orange II的降解具有较高的光催化活性。但是红外及 XRD分析表明有机碱在TiO2粒子表面残留较多,需要经过高温煅烧(高于400 ℃) 才能去除吸附的有机物并获得良好的结晶性。而随着煅烧温度的升高,晶粒尺寸不断变大。
金红石型SnO2结构是Sn-O正四面体结构,是四角对称点阵,每个锡原子周围有6个氧原子,SnO2晶体大多数情况是沿着(110)、(101)或(211)方向生长。CHEN 等[15]使用水热法合成了沿(101)方向生长的SnO2纳米棒。WANG等[16]以 Sn(OtBu)4为前驱体,在油胺和油酸的溶剂体系中采用溶剂热的方法合成了SnO2纳米棒,随着油酸含量的增加,出现了V字形的SnO2纳米晶,SnO2纳米棒沿[110]方向生长,V字形纳米晶的双臂总是在(101)面内沿[002]方向生长。
PAN等[17]利用十六烷基溴化铵(CTAB)调控CeO2各晶面的生长速率,可控合成了具有不同形貌的CeO2纳米晶(见图1)。由图1可看出,较低温度下,CTA+易吸附在 CeO2(111)晶面上,未被稳定的(100)面更易彼此结合,形成方形纳米片;温度升高后,CTA+与CeO2(111)晶面结合减弱,(111)面彼此结合,形成六方和菱形纳米片。当CTAB加入量加入量较少时,由于CTA+导向作用较低,纳米片逐渐增厚,部分转化为纳米棒,随着CTAB加入量增加,CTA+导向作用增强,CeO2纳米片生长被限制,同时纳米片间作用力被减弱,导致层状结构卷曲,转化为 CeO2纳米管。CeO2纳米片较纳米管和纳米棒暴露出更多的(110)面,更易形成氧空穴,展现出优良的CO催化氧化性能。
采用表面活性剂等有机添加剂可以有效地控制金属氧化物纳米晶的形貌,但是残留的有机物较难去除,而高温煅烧会造成晶粒的生长和晶粒之间的硬团聚,造成单分散性的下降以及形貌的改变,进而影响其性质和应用。
除有机添加剂外,在水热体系中添加某些无机盐可以增大溶质的溶解度和加快生长基元向生长界面的输运,从而影响纳米晶的生长。例如本课题组在水热体系中加入不同的碱金属卤化物,通过改变碱金属卤化物的类型和浓度能简便地制备具有不同结晶度、不同粒子尺寸和长径比的单斜相ZrO2纳米棒。图2所示为在添加不同浓度KF条件下制得的ZrO2纳米晶的XRD谱。从图2可以看出,随着KF量的增加,XRD衍射峰变窄,强度增加,说明调节KF的量可以调节ZrO2纳米晶的结晶度和晶粒尺寸。图3所示为添加不同浓度 KF制得的 ZrO2的 TEM 像。从图 3可以看出,在不加KF时,合成的ZrO2的粒子尺寸比较小,以小的团聚体分散存在;随着KF量的增加,ZrO2的粒子尺寸增大,长径比减小,分散性变好;但是随着KF量的进一步增加,ZrO2纳米晶的分散性变差。
氟化物盐不仅可以起到矿化剂的作用,也可以作为F离子掺杂的前驱体,获得具有特殊性质的F离子掺杂金属氧化物纳米晶。例如相对于导电纳米晶锡掺杂氧化铟(ITO)和锑掺杂氧化锡(ATO),氟掺杂氧化锡(FTO)具有更好的热稳定性、化学耐久性、机械耐久性、光学性质,以及低毒性。WU等[18]以无机盐SnCl4·5H2O为锡源,NH4F等为氟源,采用溶胶-水热的方法,制备了粒径均匀、分散性好的FTO纳米晶溶胶,并对其电学特性进行了研究。XRD分析结构表明:反应体系中NH4F与Sn的物质的量比影响到FTO纳米晶的晶粒大小。当n(NH4F)/n(Sn)为0~2时FTO纳米晶的晶粒尺寸不断增大,其对应的方块电阻也逐渐减少;而当n(NH4F)/n(Sn)为2~5时,FTO纳米晶的晶粒尺寸又逐渐减小,其对应的方块电阻也逐渐增加。图4所示为不同氟掺杂量FTO纳米晶的HRTEM和FFT像通过高分辨透射照片,可以清晰地看到FTO纳米晶的粒度在10 nm左右,粒子具有明显的晶格条纹、结构完整无缺陷,说明其结晶性良好,这也同产品的XRD分析结果一致。

图1 CeO2纳米结构的转化机理[17]Fig.1 Transformation mechanism of CeO2 nanostructure[17]

图2 添加不同浓度KF制得的ZrO2的XRD谱Fig.2 XRD patterns of ZrO2 nanocrystal prepared with different KF concentrations: (a) n(KF)/n(Zr)=0; (b) n(KF)/n(Zr)=0.125; (c) n(KF)/n(Zr)=0.25; (d) n(KF)/n(Zr)=0.5

图3 添加不同浓度KF制得的ZrO2的TEM像Fig.3 TEM images of prepared ZrO2 nanocrystal at different KF concentrations: (a) n(KF)/n(Zr)=0; (b) n(KF)/n(Zr)=0.125;(c) n(KF)/n(Zr)=0.25; (d) n(KF)/n(Zr)=0.5

图4 不同氟掺杂量FTO纳米晶的HRTEM与FFT像[18]Fig.4 HRTEM and FFT images of FTO nanocrystals at different fluorine doping concentrations: (a) SnO2; (b) n(NH4F):n(Sn)=2;(c) n(NH4F):n(Sn)=5; (d) FFT image corresponding to Fig.4(c)[18]
由于F原子具有很强的电负性,可以和金属原子形成高键能的F—Metal键。如YANG等[19]利用TiF4和HF为前驱体和晶面控制剂,180 ℃水热反应制备了(001)晶面占 64%的锐钛矿型 TiO2微晶,研究认为高键能的F—Ti键可以显著降低(001)面的表面能,比(101)面还稳定,经过600 ℃高温煅烧可以去除表面的F。HAN等[20]采用类似的方法合成了(001)面含量高达89%的锐钛矿相TiO2纳米片,并呈现出高光催化活性,即使多次重复使用降解甲基橙,活性仍未见降低。YANG等[21]曾根据第一性原理计算了卤素离子对TiO2纳米晶禁带宽度、能级位置的影响,认为发生O取代的难度按 F、Cl、Br、I的顺序增加,而发生Ti取代的难度逐渐减少。SU等[22]采用水热反应结合煅烧的方法,制备了I离子掺杂的TiO2纳米晶,I离子不仅可以实现可见光敏化而且可以显著抑制 TiO2纳米晶的生长,纯TiO2的晶粒大小为23.7 nm,而I掺杂TiO2的粒径仅为7.6 nm。但除F离子外其它卤素离子无法起到提高锐钛矿型TiO2(001)晶面比例的作用。
由于HF不论是在液相中还是气态都具有很强的毒性和腐蚀性,所以不适合大规模制备具有高(001)晶面组成的 TiO2纳米晶。而且 F离子会使晶体表面钝化,必须经过高温煅烧去除后才能具有高光催化活性。在高温煅烧过程中,(001)晶面可能会在一定程度上由于表面发生重建而失活。例如在超高真空条件下,锐钛矿的(001)晶面会发生重组,形成含有(103)等晶面的表面[23]。高选择性地合成洁净且具有高含量(001)晶面的TiO2纳米晶仍然是一项具有挑战性的工作。
本课题组在前期研究中开发了一种不需要表面活性剂及氢氟酸的溶剂热方法,并制备了形貌、晶形可控、具有高度分散性的纳米TiO2晶体。本文作者采用无机盐Ti(SO4)2为钛源,H2O2为络合剂,通过不同溶剂中的过氧钛酸溶液的溶剂热法制备出了锐钛矿结构的TiO2纳米晶溶胶[24]。所得溶胶的分散性好、形貌可控、稳定性好且结晶度高。通过改变混合溶剂中的乙醇与水的比例,可以控制所生成的锐钛矿TiO2纳米晶的长径比。研究发现,乙醇分子更易吸附在(001)面上,导致在[001]方向生长受阻,相应地在[101]方向生长较快,从而形成四方形结构。在水与乙醇的混合溶剂中,随着乙醇与水的比例不断增加,TiO2粒径(TEM)由47 nm减小到9 nm。通过对苯酚的降解考察了不同形貌样品的光催化性能。在水与乙醇体积比为1:4的溶剂中制备的TiO2纳米晶具有最高的光催化性能。
在混合溶剂体系中,乙醇分子起到了控制晶面生长的作用,从图5可以看出,经过溶剂热反应后,过氧键消失,但新制备的TiO2纳米晶表面仍然有吸附的有机分子,经过真空低温脱附后(40 ℃)表面吸附的有机物得到了有效脱除。脱除表面吸附的有机物后,TiO2纳米晶的光催化活性略微有提高。
本课题组还通过OH-的选择性吸附,调控各晶面生长速率,获得不同形貌的稀土氧化物纳米晶[25-28]。例如在室温下,高浓度 OH-选择性吸附在 CeO2纳米晶的(100)和(111)晶面上,限制了晶体在[100]和[111]方向上的生长,晶体选择性地在[110]方向生长,最终生长为CeO2纳米棒(见图6)[25]。在高温高压水热条件下,CeO2纳米棒逐渐发生溶解后沉积,由于表面吸附一层致密的OH-,阻碍了其在外表面的溶解,其内部逐渐被刻蚀,最终形成CeO2纳米管(见图7(a))。随着温度升高、反应时间延长,纳米管逐渐被刻蚀,进而破裂,生成CeO2纳米粒子。在高温条件下,过量OH-只能吸附在 CeO2纳米晶的(100)晶面上,限制[100]方向的生长,最终得到纳米立方体(见图7(c)),当碱铈投料比足够大时,超过量的OH-与(111)晶面的结合能又可能变为负值,过量OH-也能吸附在(100)和(111)晶面上,限制其在[100]和[111]方向上的生长,从而选择性地沿[110]方向上生长得到纳米线(见图7(b))。
1.2 纳米晶晶型的调控
金属氧化物通常具有多种晶型结构,晶型结构决定了其性质的差异,因此实现纳米晶晶型的调控具有重要的意义。例如,ZrO2有3种晶型,其低温稳定相为单斜相(m-ZrO2);高于1 000 ℃时四方相(t-ZrO2)逐渐形成;直至2 370 ℃时,只存在四方相;高于2 370℃至熔点温度时,则为立方相,其单斜相最为常见,四方和立方相在室温下属于亚稳态。在水热法合成ZrO2纳米晶的过程中,可以通过调节体系的pH值来调节单斜相和四方相的比率,得到单斜和四方相不同程度混合的ZrO2纳米晶。在合成纯四方相ZrO2纳米晶方面,LI等[29]报道一种通过溶剂热反应合成四方相氧化锆的简便方法,以水和无水甲醇为溶剂,具有四方结构的锆沉淀物前驱体由于在不同溶剂中的溶解性的差异,在甲醇中不易发生Ostwald 熟化过程而造成四方对称性结构向热力学上更稳定的单斜对称性结构的转变,而使其四方结构得以保留。QIN和CHEN[30]在水热法合成ZrO2纳米晶的过程中,通过在体系中引入丙三醇取代四聚体的部分水分子从而改变了羟基桥联、氧基桥联以及晶核生成、晶体生长的过程,制得了纯四方相 ZrO2。JIAO等[31]也通过在水热体系中引入有机添加剂来调控ZrO2纳米晶的晶型,他们发现在体系中引入多羟基醇或乙醇胺利于四方ZrO2纳米晶的形成,而引入一些烷基卤化物则有利于单斜 ZrO2纳米晶的形成。
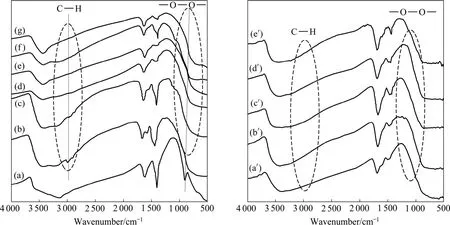
图5 不同溶剂制备的TiO2 纳米晶及经低温真空脱附表面吸附乙醇后的FT-IR谱Fig.5 FT-IR spectra of TiO2 nanocrystals prepared in different solvents and after removing absorbed ethanol on surface: (a) H2O;(b) ethanol before solvothermal treatment; (c) Ethanol; (d) V(H2O):V(ethanol)=1:4; (e) V(H2O):V(ethanol)=1:1; (f) V(H2O):V(ethanol)=4:1; (g) H2O; (a′) Ethanol; (b′) V(H2O):V(ethanol)=1:4; (c′) V(H2O):V(ethanol)=1:1; (d′) V(H2O):V(ethanol)=4:1; (e′) H2O

图6 CeO2纳米棒的TEM、HRTEM像和CeO2的结构示意图[24]Fig.6 TEM (a) and HRTEM (b) images of CeO2 nanorods and structure of CeO2 nanocrytal (c)[24]

图7 CeO2纳米管、纳米线和纳米立方体的TEM像[27]Fig.7 TEM images of CeO2 nanotubes (a), nanowire (b) and nanocubes[27]
TiO2也同样存在多种晶型,其中最常见的晶型为金红石与锐钛矿。YAN等[32]利用微乳液-水热法制备了一系列 TiO2纳米晶,研究发现通过调节微乳液体系中 Cl-和的比例可以调节产物中锐钛矿相与金红石相的比例。由于的空间位阻效应,会抑制金红石型TiO2纳米晶的成核,而更有利于形成锐钛矿相TiO2纳米晶,但是实验结果表明随着含量的增加,虽然金红石相的含量逐渐减少,但是金红石晶粒的尺寸逐渐变大。
与锐钛矿型TiO2相比,金红石TiO2具有高热稳定性、化学惰性、高折射率等特点,具有广泛的应用,但是通常需要经过高温煅烧才能得到金红石结构。本课题组在前期的研究基础上,通过引入Sn4+离子掺杂,采用溶剂热的方法合成了晶粒尺寸小于10 nm,同时具有高分散性的金红石型 TiO2。Sn4+的引入被认为可促进金红石相的生成,从而可以通过控制Sn4+的掺杂量达到调控纳米晶晶型的目的[33]。以 Ti(SO4)2和SnCl4·5H2O 为前驱体,采用 H2O2络合,制备了中性的过氧混合金属溶胶(PMC),再经水热处理后获得高稳定性、晶相可控的Sn4+掺杂Ti1-xSnxO2纳米晶溶胶。图 9(a)所示为不同 Sn4+掺杂量 Ti1-xSnxO2纳米晶溶胶的XRD谱。随着Sn4+掺杂量的增加,Ti1-xSnxO2纳米晶的晶型由锐钛矿相向金红石相转变。此外所有样品中均没有出现SnO2的特征衍射峰,说明Sn4+已经替代Ti4+进入TiO2晶格或在TiO2的表面以高分散的团簇形式存在[34]。Sn4+的离子半径(0.69 Å)与Ti4+的离子半径(0.53 Å)相近,因此 Sn4+易替代 Ti4+进入 TiO2晶格[35]。另外,SnO2和金红石型 TiO2的晶体结构和晶格参数均相似,因此 Ti1-xSnxO2纳米晶晶型的变化是由 Sn4+的掺杂引起的。
Ti1-xSnxO2纳米晶的晶粒尺寸可通过Scherrer公式算得。对于锐钛矿相样品 TiO2、Ti0.99Sn0.01O2和Ti0.97Sn0.03O2(分别表示为 TiSn0、TiSn1和 TiSn3,后面依次类推),随着 Sn4+掺杂量的增加,晶粒尺寸从16.2 nm减小至9.8 nm。而混晶相TiSn4和TiSn5中的锐钛矿相晶粒尺寸明显增加。值得注意的是对于纯锐钛矿相样品(TiSn0、TiSn1和 TiSn3),晶粒尺寸随着Sn4+掺杂量的增加而降低。而对于混晶样品(TiSn4和TiSn5),锐钛矿相的晶粒尺寸却随着Sn4+掺杂量的增加而增加。这可能是由于在纯锐钛矿相样品中,掺杂的Sn4+仅存在于TiO2的表相,由于 Ti-O-Sn的存在,掺杂Sn4+会抑制晶粒的生长,因此,随着Sn4+掺杂量的增加,晶粒尺寸逐渐减小[36]。而对于混晶型样品,掺杂的Sn4+可能主要集中在金红石相上而对锐钛矿相结构影响很小,因此混晶中锐钛矿相样品的晶粒尺寸明显增加[37]。此外,对于混晶型样品TiSn4和TiSn5,金红石相的尺寸远小于锐钛矿相的尺寸。OVENSTONE和YANAGISAWA[38]报道金红石型TiO2是由锐钛矿型TiO2经高温焙烧而获得,所以金红石型TiO2的尺寸往往要大于后者的。但本实验却得到了不同的结果,这说明制得的 Ti1-xSnxO2纳米晶中的金红石相是通过不同的反应历程获得的。
Ti1-xSnxO2纳米晶的生长过程可能如下:首先,钛盐和锡盐的水解产物([Ti(OH)5(OH2)]-和[Sn(OH)5(OH2)]-)与 H2O2发生络合反应,即胶溶时H2O2首先与[Ti(OH)5(OH2)]-和[Sn(OH)5(OH2)]-反应,生成含有过氧基的过氧钛酸和过氧锡酸。水热过程中,过氧基分解并形成生长基元[Ti(OH)4(OH2)2]0和[Sn(OH)4(OH2)2]0,再经过缩聚作用形成晶核。当未掺杂Sn4+和Sn4+掺杂量较低时,[Ti(OH)4(OH2)2]0是主要的生长基元,共边形成锐钛矿相结构的几率远大于对边连接形成金红石相结构的几率(见图 8 )。因此,TiSn0、TiSn1和TiSn3为锐钛矿相结构。当Sn4+掺杂量较高时,[Sn(OH)4(OH2)2]0逐渐增多,[Sn(OH)4(OH2)2]0的量越大,金红石相晶核越易形成,使得[Ti(OH)4(OH2)2]0围绕金红石相晶核生长为金红石型TiO2[39]。因此,在Sn4+掺杂量较高的条件下,可诱导金红石型TiO2的生成。XPS的结果也证实对这一反应机理的推测。一般来讲,XPS分析反映的是样品的表面组成,而ICP-AES反映的是样品的平均组成。通过计算当量Δ=(表面组成-平均组成)/平均组成(表面组成为XPS析出的Sn4+在晶粒的摩尔分数,平均组成为ICP分析出的Sn4+在晶粒整体里的摩尔分数),比较了ΔTiSn3、ΔTiSn5和ΔTiSn10。结果表明,ΔTiSn3远大于ΔTiSn5和ΔTiSn10,这说明当Sn4+掺杂量较高时,形成金红石型晶核,诱导了金红石型 TiO2的生长[40-41]。
为了进一步分析溶剂及 Sn4+掺杂对 TiO2晶型及形貌的影响,考察了溶剂类型、及在丁醇溶剂中不同Sn4+掺杂量对 Sn掺杂 TiO2生长的影响。结果发现在乙醇或丁醇溶剂中,SnO2的晶体生长受到抑制,在丁醇溶剂中,即使再高的掺杂量,也仅得到锐钛矿相的TiO2,简而言之,在醇溶剂的溶剂热条件下,Sn4+的诱导形成金红石结构的行为受到了抑制(见图 9和10)。这可能是因为Sn4+的电负性(1.8)大于Ti4+的电负性(1.5),所以结构基元[Sn(OH)4(OH2)2]0中六配位锡原子表面的电荷要明显低于结构基元[Ti(OH)4(OH2)2]0中六配位钛原子表面的电荷[42-43],这大大增强了锡原子和终端氧共价键特性,使得[Sn(OH)4(OH2)2]0中终端氧的负电性降低,终端质子得到活化[44-45]。[Sn(OH)4(OH2)2]0中的活化质子与正丁醇中的羟基易发生脱羟基反应,由于长烷基链的空间位阻效应抑制了金红石相的生成,因此当以正丁醇为反应溶剂,即使Sn4+掺杂量很高时,得到的仍是锐钛矿型Ti1-xSnxO2纳米晶。

图8 不同Sn4+掺杂量的TiO2的XRD谱及其生长机理Fig.8 XRD patterns of Sn4+ doping amount (a) and growth mechanism of TiO2 nanocrystal (b)

图9 不同溶剂中制备SnO2的XRD谱Fig.9 XRD patterns of SnO2 nanocrystals prepared in different solvents: (a) H2O; (b) V(H2O)/V(ethanol)=4:1;(c) V(H2O)/V(ethanol)=1:4; (d) Ethanol; (e) 1-butanol
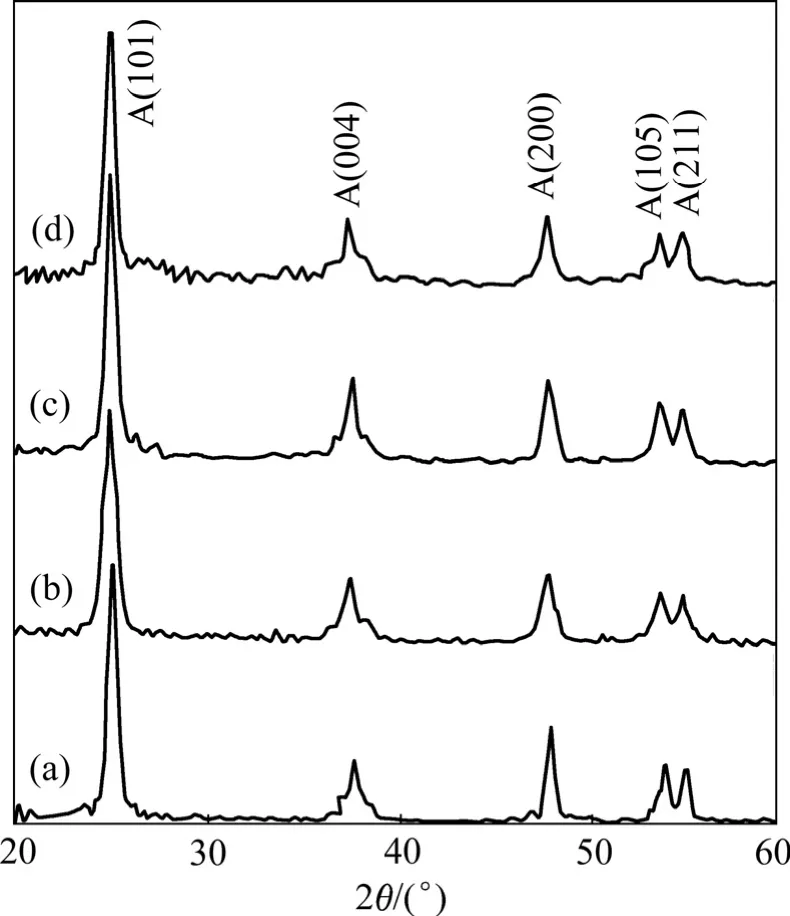
图10 不同Sn4+掺杂的TiO2 样品的XRD谱Fig.10 XRD patterns of TiO2 doped by different Sn4+nanocrystals: (a) TiO2; (b) Ti0.97Sn0.03O2; (c)Ti0.95Sn0.05O2;(d) Ti0.90Sn0.10O2
2 结语与展望
金属氧化物纳米晶的性质与应用取决于其晶型、形貌、尺寸等结构特征。水热法和溶剂热法具有直接生成纳米晶而不需要高温煅烧的特点,是制备高分散金属氧化物纳米晶的有效方法。通过控制反应条件如时间、温度、pH值、添加表面活性剂、引入一定的离子等方法可以实现对晶型、形貌、尺寸、晶面等参数的精细调控,但是也存在诸如表面活性剂等添加剂难以去除、某些结构控制剂(如氢氟酸)具有强腐蚀性和毒性等问题。因此仍需要进一步深入研究纳米晶的生长机理并开发出绿色、高选择性的制备方法,实现具有特定结构、单分散金属氧化物纳米晶的环境友好、低成本的工业化制备,充分发挥其在环境、能源等领域的应用价值。
REFERENCES
[1] CHEN X B, MAO S S. Titanium dioxide nanomaterials:Synthesis, properties, modifications, and applications[J].Chemical Reviews, 2007, 107: 2891-2959.
[2] WEN P H, TAO Z Q, ISHIKAWA Y, ITOH H, FENG Q.Dye-sensitized solar cells based on anatase TiO2nanocrystals exposing a specific lattice plane on the surface[J]. Applied Physics Letters, 2010, 97(13): 131906.
[3] NORRIS D J, EFROS A L, ERWIN S C. Doped nanocrystals[J].Science, 2008, 319: 1776-1779.
[4] WEI Z R, LUO X P, FU S L, LI Z, HU Z P, GAO P, WANG W W, DONG G Y. Fabrication of rutile Sn-doped TiO2nanocrystals by hydrotherma method[J]. Journal of Synthetic Crystal, 2007,36(5): 1113-1117.
[5] JUN Y W, CHOI J S, CHEON J. Shape control of semiconductor and metal oxide nanocrystal through nonhyddrolytic colloidal routes[J]. Angewandte Chemie International Edition, 2006,45(21): 3414-3439.
[6] XI G C, YE J H. Ultrathin SnO2nanorods: template- and surfactant-free solution phase synthesis, growth mechanism,optical, gas-sensing, and surface adsorption properties[J]. 2010,49(5): 2302-2309.
[7] NOH H J, SEO D S, KIM H, LEE J K. Synthesis and crystallization of anisotropic shaped ZrO2nanocrystalline powders by hydrothermal process[J]. Materials Letters, 2003, 57:2425-2431.
[8] ZHAO N N, PAN D C, NIE W, JI X L. Two-Phase Synthesis of shape-controlled colloidal zirconia nanocrystals and their characterization[J]. Journal of the American Chemical Society,2006, 128(31): 10118-10124.
[9] MULLIN J W. Crystallization[M]. 3rd ed. Oxford: Butterworth-Heinemann, 1997.
[10] JUN Y W, CASULA M F, SIM J H, KIM S Y, CHEON J,ALIVISATOS A P. Surfactant-assisted elimination of a high energy facet as a means of controlling the shapes of TiO2nanocrystals[J]. Journal of the American Chemical Society, 2003,125(51): 15981-15985.
[11] CHEMSEDDINE A, MORITZ T. Nanostructuring titania:control over nanocrystal structure, size, shape, and organization[J]. European Journal of Inorganic Chemistry, 1999:235-245.
[12] 包 南, 马 东, 孙 剑, 张 锋, 马志会. 形貌可控的纳米晶的溶胶凝胶-水热法组合制备[J]. 功能材料, 2006, 8(37):1331-1334.
BAO Nan, MA Dong, SUN Jian, ZHANG Feng, MA Zhi-hui.Controlling the morphology of nanocrystalline TiO2in a sol-gel-hydrothermal combination process[J]. Journal of Functional Materials, 2006, 8(37): 1331-1334.
[13] CHEN Y X, HE X N, ZHAO X J, YUAN Q H, GU X Y.Preparation, characterization, and growth mechanism of a novel aligned nanosquare anatase in large quantities in the presence of TMAOH[J]. Journal of Colloid and Interface Science, 2007, 310:171-177.
[14] RYU Y B, LEE M S, JEONG E D, KIM H G, JUNG W Y, BAEK S H, LEE G D, PARK S S, HONG S S. Hydrothermal synthesis of titanium dioxides from perotitanate solution using different amine group containing organics and their photocatalytic activity[J]. Catalysis Today, 2007, 124(3/4): 88-93.
[15] CHEN Y J, NIE L, XUE X Y, WANG Y G, WANG T H. Linear ethanol sensing of SnO2nanorods with extremely high sensitivity[J]. Applied Physics Letters, 2006, 88: 083105.
[16] WANG G, LU W, LI J Y, JEONG Y, CHOI S Y, PARK J B, RYU M K, LEE K. V-shaped tin oxide nanostructures featuring a broad photocurrent signal: An effective visible-light-driven photocatalyst[J]. Small, 2(12): 1436-1439.
[17] PAN C S, ZHANG D S, SHI L Y. CTAB assisted hydrothermal synthesis, controlled conversion and CO oxidation properties of CeO2nanoplates, nanotubes, and nanorods[J]. Journal of Solid State Chemistry, 2008, 181: 1298-1306.
[18] WU S S, YUAN S, SHI L Y, ZHAO Y, FANG J H. Preparation,characterization and electrical properties of fluorine doped tin dioxide nanocrystals[J]. Journal of Colloid and Interface Science,2010, 346: 12-16.
[19] YANG H G, SUN C H, QIAO S Z, ZOU J, LIU G, SMITH S C,CHENG H M, LU G Q. Anatase TiO2single crystals with a large percentage of reactive facets[J]. Nature, 2008, 453: 638-642.
[20] HAN X G, KUANG Q, JIN M S, XIE Z X, ZHENG L S.Synthesis of titania nanosheets with a high percentage of exposed (001) facets and related photocatalytic properties[J].Journal of the American Chemical Society, 2009, 131:3152-3153.
[21] YANG K S, DAI Y, HUANG B B, WHANGBO M H. Density functional characterization of the band edges, the band gap states,and the preferred doping sites of halogen-doped TiO2[J].Chemistry of Materials, 2008, 20 (20): 6528-6534.
[22] SU W Y, ZHANG Y F, LI Z H, WU L, WANG X X, LI J Q, FU X Z. Multivalency iodine doped TiO2: preparation,characterization, theoretical studies, and visible-light photocatalysis[J]. Langmuir, 2008, 24(7): 3422-3428.
[23] SELLONI A. Crystal growth: Anatase shows its reactive side[J].Nature Materials, 2008, 7: 613.
[24] LIAO J H, SHI L Y, YUAN S, ZHAO Y, FANG J H.Solvothermal synthesis of TiO2nanocrystal colloids from peroxotitanate complex solution and their photocatalytic activities[J]. Journal of Physical Chemistry C, 2009, 113:18778-18783.
[25] PAN C S, ZHANG D S, SHI L Y, et al. Template-free synthesis,controlled conversion, and CO oxidation properties of CeO2 nanorods, nanotubes, nanowires, and nanocubes[J]. European Journal of Inorganic Chemistry, 2008, 15: 2429-2436.
[26] 张登松. 稀土氧化物一维纳米结构的可控合成及性能研究[D].上海: 上海大学, 2007: 133.
ZHANG Deng-song. Controlled synthesis and performance of rare earth oxide one-dimensional nanostructures[D]. Shanghai:Shanghai University, 2007: 133.
[27] 颜婷婷, 张登松, 施利毅. 纳米结构材料的制备及应用进展[J]. 上海大学学报, 2011, 17(4): 447-457.
YAN Ting-ting, ZHANG Deng-song, SHI Li-yi. Progress in synthesis and applications of nanomaterials[J]. Journal of Shanghai University, 2011, 17(4): 447-457.
[28] 张登松, 李红蕊, 施利毅. 氧化铈低维纳米结构形态控制新进展[J]. 纳米科技与发展, 2009, 9: 19-23.
ZHANG Deng-song, LI Hong-rui, SHI Li-yi. Recent review of morphology-controlled synthesis of ceria low-dimensional nanostructures[J]. Nano Technology and Development, 2009, 9:19-23.
[29] LI W Z, HUANG H, LI H J, ZHANG W, LIU H C. Facile synthesis of pure monoclinic and tetragonal zirconia nanoparticles and their phase effects on the behavior of supported molybdena catalysts for methanol-selective oxidation[J]. Langmuir, 2008, 24(15): 8358.
[30] QIN D K, CHEN H L. The influence of alcohol additives on the crystallization of ZrO2under hydrothermal conditions[J]. Journal of Materials Science, 2006, 41: 7059-7063.
[31] JIAO X L, CHEN D R, XIAO L H. Effects of organic additives on hydrothermal zirconia nanocrystallites[J]. Journal of Crystal Growth, 2003, 258(1/2): 158-162.
[32] YAN M C, CHEN F, ZHANG J L, ANPO M. Preparation of controllable crystalline titania and study on the photocatalytic properties[J]. Journal of Physical Chemistry B, 2005, 109(18):8673-8678.
[33] ZHAO Y, LIU J, SHI L Y, YUAN S, FANG J H, WANG Z Y,ZHANG M H. Surfactant-free synthesis uniform Ti1-xSnxO2nanocrystal colloids and their photocatalytic performance[J].Applied Catalysis B, 2010, 100: 68-76.
[34] SENSATO F R, CUSTODIO R, LONGO E, BELTRÁN A,ANDRÉS J. Electronic and structural properties of SnxTi1-xO2solid solutions: A periodic DFT study[J]. Catalysis Today, 2003,85(2/4): 145-152.
[35] CAO Y Q, HE T, ZHAO L S, WANG E J, YANG W S, CAO Y A.Structure and phase transition behavior of Sn4+-doped TiO2nanoparticles[J]. Journal of Physical Chemistyr C, 2009, 113(42):18121-18124.
[36] SAYILKANA F, ASILTURKA M, KIRAZB N. Photocatalytic antibacterial performance of Sn4+-doped TiO2thin films on glass substrate[J]. Journal of Hazardous Materials, 2009, 162(2/3):1309-1316.
[37] CHINARRO E, MORENO B, JURADO J R. Combustion synthesis and EIS characterization of TiO2-SnO2system[J].Journal of European Ceramic Society, 2007, 27(13/15):3601-3604.
[38] OVENSTONE J, YANAGISAWA K. Effect of hydrothermal treatment of amorphous titania on the phase change from anatase to rutile during calcinations[J]. Chemistry of Materials, 1999,11(10): 2770-2774.
[39] FRESNO F, TUDEL D, CORONADO J M, SORIA J. Synthesis of Ti1-xSnxO2nanosized photocatalysts in reverse microemulsions[J]. Catalysis Today, 2009, 143(3/4): 230-236.
[40] ZHAO Y, LIU J, SHI L Y, YUAN S, FANG J, WANG Z Y,ZHANG M H. Solvothermal preparation of Sn4+doped anatase TiO2nanocrystals from peroxo-metal-complex and their photocatalytic activity[J]. Applied Catalysis B, 2011, 103:436-443.
[41] LIU J, ZHAO Y, SHI L Y, YUAN S, FANG J H, WANG Z Y,ZHANG M H. Solvothermal synthesis of crystalline phase and shape controlled Sn4+doped TiO2nanocrystals: effects of reaction solvent[J]. ACS Applied Materials and Interfaces, 2011,3: 1261-1268.
[42] KLEINKE H, WALDECK M, GUETLICH P. Ti2Sn3: A novel binary intermetallic phase, prepared by chemical transport at intermediate temperature[J]. Chemistry of Materials, 2000, 12(8):2219-2224.
[43] CAO Y Q, HE T, CHEN Y M, CAO Y. Fabrication of rutile TiO2-Sn/anatase TiO2-N heterostructure and its application in visible-light photocatalysis[J]. Journal of Physical Chemistry C,2011, 114(8): 3627-3633.
[44] ROSENQVIST J, MACHESKY M L, VLCEK L, CUMMING P T, WESOLOWSKI D J. Charging properties of cassiterite(α-SnO2) surfaces in NaCl and RbCl ionic media[J]. Langmuir,2009, 2(18): 10852-10862.
[45] SAYILKAN H. Improved photocatalytic activity of Sn4+-doped and undoped TiO2thin film coated stainless steel under UV- and VIS- irradiation[J]. Applied Catalysis A: General, 2007, 319:230-236.
Recent advances of controlled synthesis of metal oxide semiconductor nanocrystals in liquid phase
SHI Li-yi, WANG Zhu-yi, YUAN Shuai, ZHAO Yin
(Research Center of Nanoscience and Nanotechnology, Shanghai University, Shanghai 200444, China)
The recent advances of methods of controlling the crystal phases, crystal facets, shapes and sizes were reviewed. The effects of surfactants, solvents and doping ions on the morphology and crystal phase of metal oxide semiconductor nanocrystals in the liquid-phase synthesis processes were introduced in detail. The characteristics of different methods were also summarized. Developing the green, high-selectivity processes to prepare monodispersed metal oxide nanocrystals with special structures is still the research trend.
metal oxide semiconductor; nanocrystals; liquid-phase synthesis; morphology; crystal phase
O782+1
A
1004-0609(2011)10-2465-11
上海市科委国际合作项目(09520709500);上海市第三期重点学科建设项目(S30107);上海市教委第五期重点学科建设项目(J50102)
2011-05-08;
2011-07-19
施利毅,教授,博士;电话:021-66134852;E-mail: shiliyi@shu.edu.cn
(编辑 李艳红)
