手性双哌啶酰胺的合成
2011-11-23高敬园张月成石乃月赵继全
高敬园, 张月成, 石乃月, 赵继全
(河北工业大学 化工学院,天津 300130)

(-)-Sparteine(Chart 1)是一种天然羽扇豆生物碱,在不对称合成中广泛用作手性诱导双氮配体。可用于Pd催化的仲醇的氧化动力学拆分[1]、吡咯衍生物的不对称锂化/去质子反应[2]、Pd-催化的构型保持的烯丙基化反应[3]、亚胺与有机锂的加成反应[4]等。(-)-Sparteine重要的中心结构是双哌啶环,在桥环上不含取代基,且结构具有很强的刚性。(-)-Sparteine是天然产物,资源有限,人工全合成困难,也很难通过衍生的方法对其结构进行修饰[5]。
鉴于(-)-Sparteine在催化领域的优良性能,合成与其结构类似的化合物有可能达到代替(-)-Sparteine的目的,本文报道N-正丙基双哌啶(3a)与(2S,4R)-N-Boc-4-乙酰氧基-2-吡咯烷甲酸(4a)反应合成3-[(2′S,4′R)-1′-Boc-4′-乙酰氧基-2′-吡咯烷基]甲酰基-7-正丙基-3,7-二氮杂双环[3.3.1]壬烷(5a);5a经三氟乙酸(TFA)脱Boc保护制得3-[(2′S,4′R)-4′-乙酰氧基-2′-吡咯烷基]甲酰基-7-正丙基-3,7-二氮杂双环[3.3.1]壬烷(6a, Scheme 1)。用类似方法,N-异丙基双哌啶(3b)与(2S,4R)-N-Boc-2-吡咯烷甲酸(4b)反应合成3-[(2′S)-1′-Boc-2′-吡咯烷基]甲酰基-7-异丙基-3,7-二氮杂双环[3.3.1]壬烷(5b);5b经TFA脱Boc保护制得3-[(2′S)-2′-吡咯烷基)甲酰基-7-异丙基-3,7-二氮杂双环[3.3.1]壬烷(6b, Scheme 1)。新型手性双哌啶酰胺5和新型手性双哌啶α-氨基酰胺6的结构经NMR, IR和MS表征。


CompabRn-Pri-PrR'AcOH
Scheme1
1 实验部分
1.1 仪器与试剂
YRT-3型双目显微熔点仪;WZZ-2S/2SS型数字式自动糖度/旋光仪(CH2Cl2为溶剂);Bruker AC-P 400型核磁共振波谱仪(CDCl3为溶剂,TMS为内标);Bruker Vector 22型傅立叶变换红外光谱仪(KBr压片或涂膜法);VG ZAB-HS型高分辨有机磁式质谱仪;SP-6800A型气相色谱仪(GC)。
3a和3b[8],4a[6],4b[7]按文献方法合成;苄基哌啶酮,化学纯;L-羟脯氨酸、L-脯氨酸、水合肼、TFA,天津市光复精细化工研究所;Pd/C(10%,含水5%);其余所用试剂均为分析纯, 溶剂使用前按标准方法纯化。柱层析硅胶(100目~200目)和薄层色谱硅胶板(TLC, GF254),青岛海洋化工厂。
1.2 合成
(1)5的合成
氮气保护、冰水浴冷却,在三口瓶中依次加入CH2Cl2150 mL,4a6.88 g(25.2 mmol)和DMAP 2.26 g(18.5 mmol),搅拌使其完全溶解,滴加3a2.82 g(16.8 mmol),滴毕,加EDCl[1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐] 4.83 g(25.2 mmol),反应30 min,于室温反应至终点(TLC跟踪)。用饱和氯化钠溶液(3×50 mL)洗涤,无水硫酸钠干燥,旋蒸脱溶,残余物经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]分离得无色油状液体,置冰箱中冷冻析晶,过滤,滤饼干燥得5a4.0 g。
以4b和3b为原料,用类似方法合成5b。
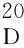
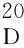
(2)6的合成
N2保护,在三口瓶中加入5a423 mg(1.0 mmol)和CH2Cl25 mL,搅拌下于0 ℃滴加TFA 3 mL,反应30 min;于室温反应2 h。旋干溶剂,加CH2Cl210 mL,1 mol·L-1氢氧化钠溶液调节至pH 8~10,用CH2Cl2(3×100 mL)萃取,无水硫酸钠干燥,旋干溶剂得6a312 mg。
以5b为原料,用类似方法合成6b。
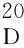
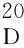
2 结果与讨论
相对于3的1H NMR谱图[8],5双哌啶环上的氢向高位移方向移动,其原因是受3-位羰基拉电子效应等因素的影响;由于氨基被Boc保护,5a和5b分别在1.32和1.41处出现Boc特征单峰;在154.5和154.5处出现Bocr 羰基碳特征峰。6无论是氢谱,还是碳谱都没有了Boc的特征峰。在5的IR谱图中未见3 300 cm-1附近的吸收峰,而6则出现了仲胺N-H伸缩振动(3 300 cm-1)的特征峰。
3 结论
以N-烷基双哌啶与Boc保护的氨基酸为原料合成出具有双哌啶骨架的未见文献报道的手性酰胺化合物。预期这些手性双哌啶酰胺化合物有可能通过三个氮原子与过渡金属配位形成刚性的过渡金属配合物,在一些配位催化反应中显示出较好的催化性能。
[1] Bagdanoff J T, Stoltz B M. Palladium-catalyzed oxidative kKinetic resolution with ambient air as the stoichiometric oxidation gas[J].Angew Chem Int Ed,2004,43(3):353-357.
[2] Gallagher D J, Du H, Long S A,etal. Chiral organolithium complexes:The structure ofβ-lithiatedβ-phenylcarboxamides and the mechanism of asymmetric substitution in the presence of (-)-sparteine[J].J Am Chem Soc,1996,118(46):11391-11398.
[3] Togni A. Asymmetric allylic alkylation catalyzed by palladium-sparteine complexes[J].Tetrahedron:Asymmetry,1991,2(7):683-690.
[4] Denmark S E, Nakajima N, Nicaise O J C. Asymmetric addition of organolithium reagents to imines[J].J Am Chem Soc,1994,116(19):8797-8798.
[5] Lesma G, Pilati T, Sacchetti A,etal. New chiral diamino ligands as sparteine analogues.Application to the palladium-catalyzed kinetic oxidative resolution of 1-phenyl ethanol[J].Tetrahedron:Asymmetry,2008,19:1363-1366.
[6] Wong M K, Ho L M, Zheng Y S,etal. Asymmetric epoxidation of olefins catalyzed by chiral iminium salts generated in situ from amines and aldehydes[J].Org Lett,2001,3(16):2587-2590.
[7] Vernall A J, Ballet S, Abell A D. Cross-metathesis and ring-closing metathesis reactions of amino acid-based substrates[J].Tetrahedron,2008,64:3980-3997.
[8] 冉维津,张月成,王芳,等. 具有手性中心的新型双哌啶衍生物的合成[J].合成化学,2010,18(3):310-313.
[9] Liu J, Yang Z G, Wang Z,etal. Asymmetric aldol reaction using new bispidine catalysts[J].J Am Chem Soc,2008,130:5654-5655.
