新型多氧取代环己烯酮的合成*1
2011-11-23杨圣伟李振卿敖桂珍候丙波
杨圣伟, 陈 熙, 李振卿, 敖桂珍, 候丙波
(苏州大学 药学院,江苏 苏州 215123)
紫玉盘属植物的主要化学成分为多氧取代环己烯类、番荔枝内酯类、黄酮类等。其中一些多氧取代环己烯类化合物具有抗肿瘤活性,且对多药耐药性的肿瘤细胞的杀伤作用与敏感肿瘤细胞相同[1~3]。Streptomyces griseosporeus培养液中成分COTC及其结构修饰物等也含有α,β-不饱和环己烯酮结构,具有较好的抗肿瘤活性[4,5]。由于这些环己烯酮类化合物的母核上具有多个含氧取代基,其取代基的种类、构型、位置和个数的不同,导致抗肿瘤活性差异。
为研究这类化合物的构效关系,在保留环己烯酮母核的基础上,本文设计了结构全新的含有两个手性碳的(5R,6S)-3-苯甲酰氧基亚甲基-5,6-二羟基-2-环己烯-1-酮(1)。
由于1与天然产物莽草酸的构型相同,因此采用仿生学方法,利用莽草酸价格便宜、光学纯度高、不易出现消旋现象等优点,以莽草酸为起始原料,经酯化、丙酮叉保护顺式邻二羟基、叔丁基二甲硅烷保护羟基、还原、羟基酯化、脱保护基、保护反式邻二羟基、烯丙醇氧化,脱保护基共9步反应合成了1(Scheme 1),总产率19.3%,其结构经1H NMR, IR和HR-MS表征。
1 实验部分
1.1 仪器与试剂
XT5型显微熔点仪;Varian Unity Inova 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Thermo Nicolet Corporation Nicolet Avatar 360 FT-IR型红外光谱仪(KBr压片);Agilent 6220 LC/MSD TOF型液质联用仪(LC-MS)。
2~5按文献[6~8]方法合成;莽草酸,成都超人植化开发有限公司;其余所用试剂均为分析纯。
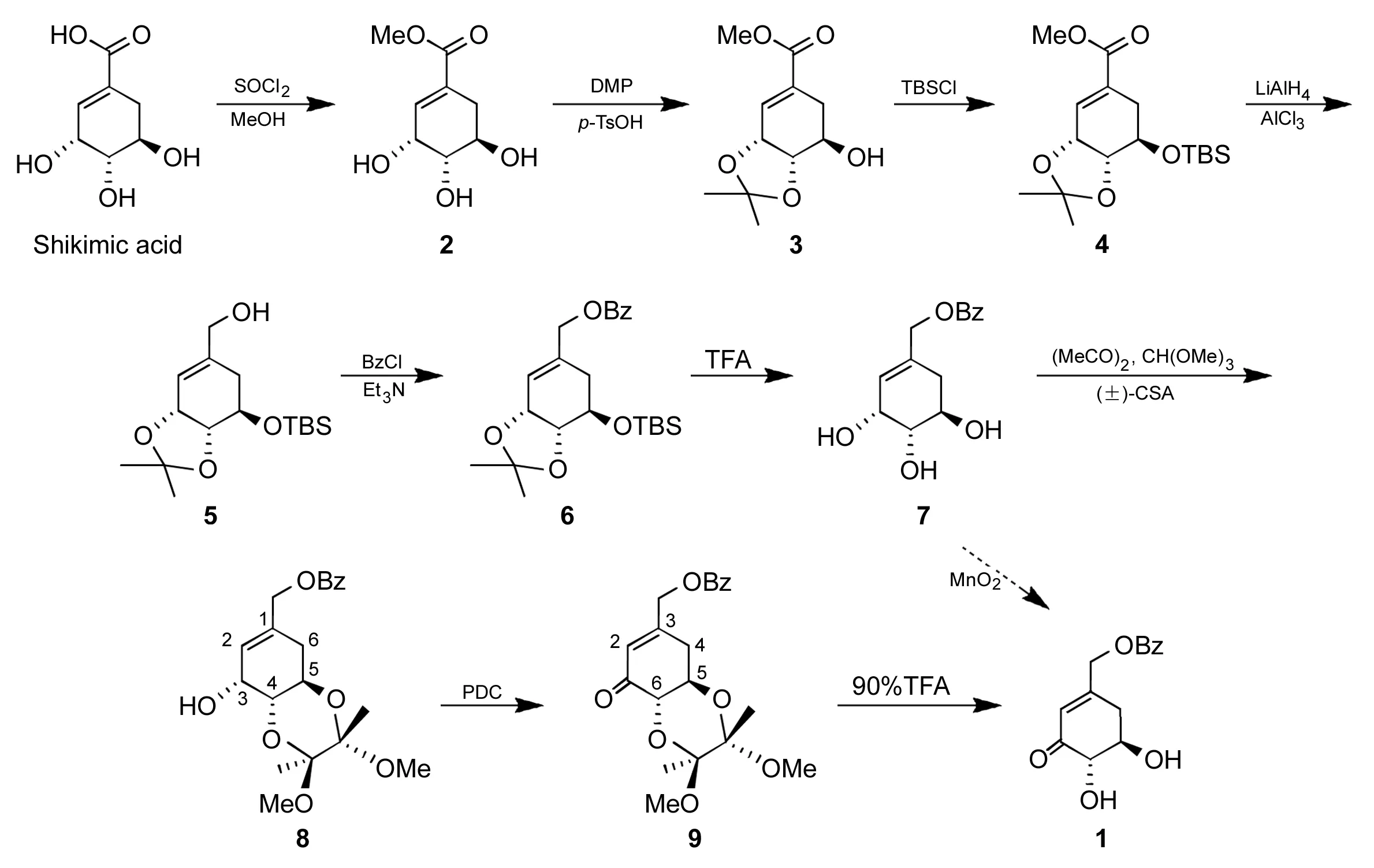
Scheme 1
1.2 合成
(1) (3R,4S,5R)-1-苯甲酰氧亚甲基-5-叔丁基二甲基硅氧基-3,4-O,O-异丙叉-1-环己烯(6)的合成
在三颈烧瓶中依次加入5 13.97 g(44.46 mmol), CH2Cl2200 mL, Et3N 32 mL(223 mmol)和催化量DMAP(二甲氧基吡啶),冰浴冷却,搅拌下滴加苯甲酰氯(BzCl) 6.2 mL(53.35 mmol),滴毕,于室温反应4 h。加入饱和碳酸氢钠溶液100 mL,用CH2Cl2(3×100 mL)萃取,合并有机层,用水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析[洗脱剂: A=V(石油醚) ∶V(乙酸乙酯)=10 ∶1]分离得无色黏稠液体616.25 g,产率87.4%;1H NMRδ: 0.07(s, 3H, CH3), 0.10(s, 3H, CH3), 0.88(s, 9H, CH3), 1.39(s, 3H, CH3), 1.46(s, 3H, CH3), 2.14(dd,J=7.3 Hz, 16.9 Hz, 1H, CH2), 2.23(dd,J=4.4 Hz, 17.1 Hz, 1H, CH2), 3.98(dd,J=4.8 Hz, 7.1 Hz, 1H, CH), 4.04(t,J=6.2 Hz, 1H, CH), 4.65~4.70(m, 1H, CH), 4.75 (s, 2H, CH2), 5.91(t,J=1.3 Hz, 1H, =CH), 7.45 (t,J=7.8 Hz, 2H, ArH), 7.57(t,J=7.4 Hz, 1H, ArH), 8.05(d,J=7.20 Hz, 2H, ArH); IRν: 3 064(Ar-H), 1 725(C=O), 1 658(C=C) cm-1; HR-MS: Calcd for C23H36O6Si{[M+N H4]+} 436.251 4, found 436.252 3。
(2) (3R,4S,5R)-1-苯甲酰氧亚甲基-3,4,5-三羟基-1-环己烯(7)的合成
在三颈圆底烧瓶中依次加入CH2Cl2150 mL, 6 14.67 g(35.07 mmol), 75%TFA(三氟乙酸)水溶液35 mL(430 mmol),搅拌下于室温反应1 h。用10%碳酸氢钠溶液(约200 mL)调至pH 7,用CH2Cl2(3×100 mL)萃取,合并有机层,用水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析(洗脱剂:A=1 ∶3)分离得白色固体76.73 g,产率72.8%, m.p.75 ℃~76 ℃;1H NMR(DMSO-d6)δ: 1.91(dd,J=6.2 Hz, 17.5 Hz, 1H, CH2), 2.36(dd,J=5.0 Hz, 17.4 Hz, 1H, CH2), 3.45 (dd,J=4.1 Hz, 7.6 Hz, 1H, CH), 3.77~3.85(m, 1H, CH), 4.08~4.12(m, 1H, CH), 4.70(s, 2H, CH2), 5.67(t,J=1.4 Hz, 1H, =CH), 7.54(t,J=7.7 Hz, 2H, ArH), 7.67(t,J=7.4 Hz, 1H, ArH), 7.98(d,J=8.4 Hz, 2H, ArH)。
(3) (3R,4S,5R)-1-苯甲酰氧亚甲基-4,5-(2,3-二甲氧丁烷-2,3-二氧)-3-羟基-1-环己烯(8)的合成
在三颈圆底烧瓶中依次加入甲醇80 mL,73.0 g(11.3 mmol), 2,3-丁二酮2.0 mL(22.7 mmol), 催化量(±)-CSA(樟脑磺酸),三甲基原甲酸酯6.2 mL(56.8 mmol),氮气保护,搅拌下回流反应3 d。加入碳酸氢钠10 g,搅拌5 min,过滤,滤液减压蒸干溶剂得黑色黏稠液体;加入饱和碳酸氢钠溶液5 mL,用乙酸乙酯(3×10 mL)萃取,合并有机层,用水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析(洗脱剂:A=1 ∶1)分离得白色粉末83.15 g,产率74.4%, m.p.56 ℃~57 ℃;1H NMRδ: 1.32(s, 3H, CH3), 1.35 (s, 3H, CH3), 2.26(dd,J=9.7 Hz, 16.2 Hz, 1H, CH2), 2.44(dd,J=6.1 Hz, 17.0 Hz, 1H, CH2), 3.27(s, 3H, OCH3), 3.28(s, 3H, OCH3), 3.65~3.70(m, 1H, CH), 4.16~4.27(m, 1H, CH), 4.32(t,J=4.5 Hz, 1H, CH), 4.75~4.85(m, 2H, CH2), 5.96(d,J=3.9 Hz, 1H, =CH), 7.45(t,J=7.8 Hz, 2H, ArH), 7.58(t,J=7.4 Hz, 1H, ArH), 8.05(d,J=7.3 Hz, 2H, ArH); IRν: 3 468(OH), 1 721(C=O), 1 655(C=C) cm-1; HR-MS: Calcd for C20H28O8{[M+NH4]+} 396.201 7, found 396.203 0。
(4) (5R,6S)-3-苯甲酰氧亚甲基-5,6-(2,3-二甲氧丁烷-2,3-二氧)环己烯-1-酮(9)的合成
在三颈圆底烧瓶中依次加入CH2Cl280 mL和81.2 g(3.2 mmol),冰浴冷却,剧烈搅拌下分批加入PDC(重铬酸吡啶嗡盐)6.0 g(15.9 mmol),加毕,逐渐升至室温,氮气保护下反应10 h。倾入冰水中,用CH2Cl2(3×100 mL)萃取,合并有机层,用水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析(洗脱剂:A=6 ∶1)分离得白色粉末90.61 g,产率52.5%, m.p.109 ℃~110 ℃;1H NMRδ: 1.34(s, 3H, CH3), 1.43(s, 3H, CH3), 2.60(dd,J=6.1 Hz, 17.0 Hz, 1H, CH2), 2.69(dd,J=9.1 Hz, 16.3 Hz, 1H, CH2), 3.27(s, 3H, OCH3), 3.32(s, 3H, OCH3), 4.22(td,J=6.1 Hz, 10.5 Hz, 1H, CH), 4.34(d,J=11.4 Hz, 1H, CH), 4.90~5.02(m, 2H, CH2), 6.20(d,J=1.2 Hz, 1H, =CH), 7.48(t,J=7.8 Hz, 2H, ArH), 7.62(t,J=7.4 Hz, 1H, ArH), 8.06 (d,J=7.3 Hz, 2H, ArH); IRν: 3 423(OH), 1 721(C=O), 1 693(C=O), 1 622(C=C) cm-1; HR-MS: Calcd for C20H25O7{[M+H]+} 377.159 5, found 377.160 9。
(5)1的合成
在三颈圆底烧瓶中依次加入9 500 mg(1.3 mmol)的CH2Cl2(50 mL)溶液和90%TFA水溶液1.7 mL(20 mmol),搅拌下室温反应3 h。加入10%碳酸氢钠水溶液20 mL,用CH2Cl2(3×20 mL)萃取,合并有机层,用水洗涤,无水硫酸钠干燥,蒸干溶剂后经硅胶柱层析(洗脱剂:A=1 ∶2)分离得无色晶体1309 mg,产率90.6%, m.p.156 ℃~157 ℃;1H NMRδ: 2.61(dd,J=10.2 Hz, 18.0 Hz, 1H, CH2), 2.78(dd,J=5.4 Hz, 17.9 Hz, 1H, CH2), 3.99(td,J=5.4 Hz, 10.3 Hz, 1H, CH), 4.12(d,J=10.7 Hz, 1H, CH), 4.99(s, 2H, CH2), 6.26~6.28(m, 1H, =CH), 7.49(t,J=7.8 Hz, 2H, ArH), 7.63(t,J=7.4 Hz, 1H, ArH), 8.07(d,J=8.1 Hz, 2H, ArH); IRν: 3 441(OH), 1 720(C=O), 1 678(C=O), 1 647(C=C) cm-1; HR-MS: Calcd for C14H15O5{[M+H]+} 263.091 4, found 263.091 9。
2 结果与讨论
7的烯丙醇氧化(7→1)如果采用MnO2作氧化剂,以丙酮为溶剂,室温下或回流条件均不反应;以苯为溶剂,室温下也不反应,回流30 min时有少量产物,时间延长,产物消失。可能是生成的α,β-不饱和环己烯酮进一步氧化成芳香化合物。基于此种考虑,选择用2,3-丁二酮选择性保护7的反式双羟基(7→8),然后用合适试剂将烯丙醇的羟基氧化成酮(8→9),再在酸性溶液中脱去4,5-反式保护基(9→1)。
用2,3-丁二酮保护7的4,5-反式双羟基时,首先需要将2,3-丁二酮生成2,2,3,3-四甲氧基丁烷,然后在催化量(±)-CSA存在下与7反应,该反应有两个产物。随着反应的进行,反式羟基保护的产物(8)比例逐渐增加,反应72 h得到8的产率最高(74.4%)。
将仲醇氧化成酮(8→9)的铬氧化试剂比较多,但是8结构中含有反式双羟基的保护基团。如果酸性太强,容易将保护基同时脱掉,游离出来的三个羟基可能逐步被氧化,导致副产物太多,产率降低,甚至得不到所需要的产物。因此要求反应液不能酸性太强,尽量为中性。经综合考虑,决定采用PDC氧化。由于还有极性较小的副产物生成,9产率较低(52.5%)。
[1] Xu Q M, Xu L Z, Yang S L. New polyoxygenated cyclohexenes from Uvaria kweichowensis and their antitumor activities[J].Chem Pharm Bull,2005,53(7):8262-8291.
[2] 刘安,徐丽珍,邹忠梅,等. 紫玉盘属植物的化学成分[J].国外医学,中医中药分册,2001,23(4):195-203.
[3] Liao Y H, Xu L Z, Yang S L,etal. Three cyclohexene oxides from Uvaria grandiflora[J].Phytochem,1998,45(4):729-732.
[4] Arthurs C L, Wind N S, Whitehead R C,etal. Analogues of 2-crotonyloxymethyl-(4R,5R,6R)-4,5,6-trihydroxy-cyclohex-2-enone(COTC) with anti-tumor properties[J].Bioorg & Med Chemistry Lett,2007,17:553-557.
[5] Arthurs C L, Raftery J, Whitby H L,etal. Useful precursors for the preparation of analogues of the anti-tumor agent,2-crotonyloxymethyl-(4R,5R,6R)-4,5,6-trihydroxy-cyclohex-2-enone(COTC)[J].Bioorg. & Med Chemistry Lett,2007,17:5974-5977.
[6] 李振卿,许琼明,敖桂珍,等. 多氧取代2-环己烯甲醇的合成[J].化学试剂,2009,31(6):469-470.
[7] 李振卿,许琼明,敖桂珍,等. 多氧取代环己基甲醇苯甲酸酯的合成及其表征[J].化学世界,2009,11:44-47.
[8] Liu A, Liu Z Z, Zou Z M,etal. Synthesis of (+)-zeylenone from shikimic acid[J].Tetrahedron,2004,60(16):3689-3694.
