联合磁性微球和基质辅助的激光解吸/离子化-飞行时间质谱筛选肾细胞癌血清差异蛋白
2011-11-23柳金顺李汉忠张玉石严维刚董德鑫
柳金顺,李汉忠,张玉石,王 澎,严维刚,谢 静,董德鑫
中国医学科学院 北京协和医学院 北京协和医院 1泌尿外科 2中心实验室,北京 100730
·论著·
联合磁性微球和基质辅助的激光解吸/离子化-飞行时间质谱筛选肾细胞癌血清差异蛋白
柳金顺1,李汉忠1,张玉石1,王 澎2,严维刚1,谢 静2,董德鑫1
中国医学科学院 北京协和医学院 北京协和医院1泌尿外科2中心实验室,北京 100730
目的采用联合磁性微球和基质辅助的激光解吸/离子化-飞行时间(MALDI-TOF-MS)技术筛选肾细胞癌患者血清差异蛋白峰。方法采用弱阳离子磁性微球从99份血清标本(肾细胞癌62份,肾脏良性占位病变37份)捕获血清蛋白,MALDI-TOF-MS质谱仪检测蛋白峰,Biomarker Wizard 3.1和Biomarker Patterns Software 5.0分析数据,以47例肾细胞癌及26例肾脏良性占位病变标本建立肾细胞癌诊断模型,15例肾细胞癌和11例肾脏良性占位病变标本进行盲法验证。结果发现7个蛋白峰具有统计学差异(P<0.05),以质荷比2945.35 、15340.8、6984.51、5819.23的4个蛋白峰建立肾细胞癌诊断模型,该模型区分肾细胞癌与肾脏良性占位病变的敏感性为83.0%,特异性为84.6%;盲法验证,该模型诊断肾细胞癌的敏感性为80.0%,特异性为81.8%。结论采用磁性微球与MALDI-TOF-MS技术可以检测肾细胞癌血清中的差异蛋白峰,并建立敏感性、特异性较高的肾细胞癌诊断模型。
肾细胞癌;磁性微球;基质辅助的激光解吸/离子化-飞行时间质谱
肾细胞癌是泌尿系统第二常见的恶性肿瘤[1]。早期肾细胞癌常无任何临床症状,出现血尿、腰痛和腹部肿块等肾癌三联征时,往往已到晚期,预后较差,转移性肾细胞癌5年存活率低于10%[2]。目前临床上没有理想的肾细胞癌特异性标志物。表面增强激光解吸/离子化飞行时间质谱(surface enhanced laser desorption ionization time-of-flight mass spectrometry,SELDI-TOF-MS)是一种蛋白质组学研究技术,由蛋白质芯片、质谱仪和芯片分析软件3部分组成,已广泛用于肿瘤标志物研究,也被应用于肾癌血清蛋白质组学研究领域[3-7]。本研究采用磁性微球联合基质辅助的激光解吸/离子化-飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)检测肾细胞癌、肾脏良性占位病变患者血清,寻找差异蛋白峰,以期为下一步差异蛋白质鉴定、寻找肾细胞癌生物标志物研究奠定基础。
材料和方法
材料弱阳离子(weak cation exchange,WCX)磁性微球购自北京赛尔迪生物技术有限公司,乙腈、三氟乙酸、尿素、4羟乙基哌嗪乙磺酸(Hepes)、水(HPLC级)、Tris碱、3-环乙胺-1-丙磺酸(CHAPS)、二硫苏糖醇(DDT) 、芥子酸(SPA)购自美国Sigma公司,PBSⅡC®蛋白质芯片阅读仪为美国Ciphergen公司产品。
标本来源及采集血清标本取自2007年11月至2008年10月在北京协和医院泌尿外科收治的肾细胞癌及肾脏良性占位病变患者,其中,肾细胞癌62例(肾细胞癌组),男44例,女18例,平均年龄(52.7±10.6)岁(36~72岁);透明细胞癌60例,乳头状癌2例,均经病理证实;肿瘤分期(2002年AJCC肾癌TNM分期):Ⅰ期41例,Ⅱ期9例,Ⅲ期8例,Ⅳ期4例。肾脏良性占位病变37例(对照组),男21例,女16例,平均年龄(45.3±11.2)岁(34~76岁);肾囊肿25例,肾血管平滑肌脂肪瘤12例,均经病理证实。所有患者于术前3d或以上清晨空腹采静脉血2~3 ml,4℃冰箱保存,2 h内处理血标本。血清3000 g离心15 min,小心吸取上清分装入eppendorf管,-80℃冰箱保存备用。
标本准备自-80℃冰箱取出备用的血清,冰浴融化,取5 μl加入含10 μl U9 裂解液(9mol/L 尿素,2%CHAPS,50mmol/L Tris-HCl,pH 9.0),充分混匀;室温下静置30 min;加入100 mmol/L NaAC(pH 4.0)185 μl,尽快混匀。
弱阳离子磁性微球的活化50 μl WCX磁性微珠加入PCR管中,置于磁力架上1 min,弃上清,加入NaAC 100 μl活化2次,每次5 min。
活化的磁性微球捕获血清蛋白每份弃上清液活化的磁性微球中加入100 μl处理好的血清样品,混匀后室温下孵育30 min,置磁力架上分离,弃上清液,加100 μl NaAC洗涤2次,加入10 μl洗脱液(1%TFA),吹打混匀,反应2 min;置磁力架分离,取蛋白洗脱液5 μl,加入5 μl SPA饱和溶液,混匀后取2.5 μl混合液上样到Au Chip 上,室温风干。采用PBSⅡC蛋白质芯片阅读仪读取芯片,收集数据。
软件设定芯片阅读仪参数设定相对分子质量范围为1000~50 000,选择3个内标峰进行相对分子质量校正,内标相对分子质量为:3958、5905、7989。采用 Biomarker WizardTM3.1软件进行数据分析,设定BPS识别蛋白峰的参数:First Pass: 5 S/N;Second Pass: 2 S/N;Cluster Mass window:0.3%;Min Peak Treshold: 5%。
统计学处理采用SPSS 11.0软件,组间比较行t检验或Mann-Whitney秩检验(偏态分布数据),P<0.05为差异有统计学意义。把差异蛋白峰代入Biomarker PatternsTMSoftware (BPS) 5.0软件,73例标本建立诊断模型,采用盲法对未知的26例标本数据进行验证。
结 果
差异蛋白峰筛查结果采用73例标本(肾细胞癌组47例,对照组26例)检测结果筛查两组的差异蛋白峰,发现m/z 2945.35、5819.23、6984.51、7573.82、7943.42、15144.2、15340.8等7个蛋白峰在两组间差异有统计学意义(P<0.05)(表1)。
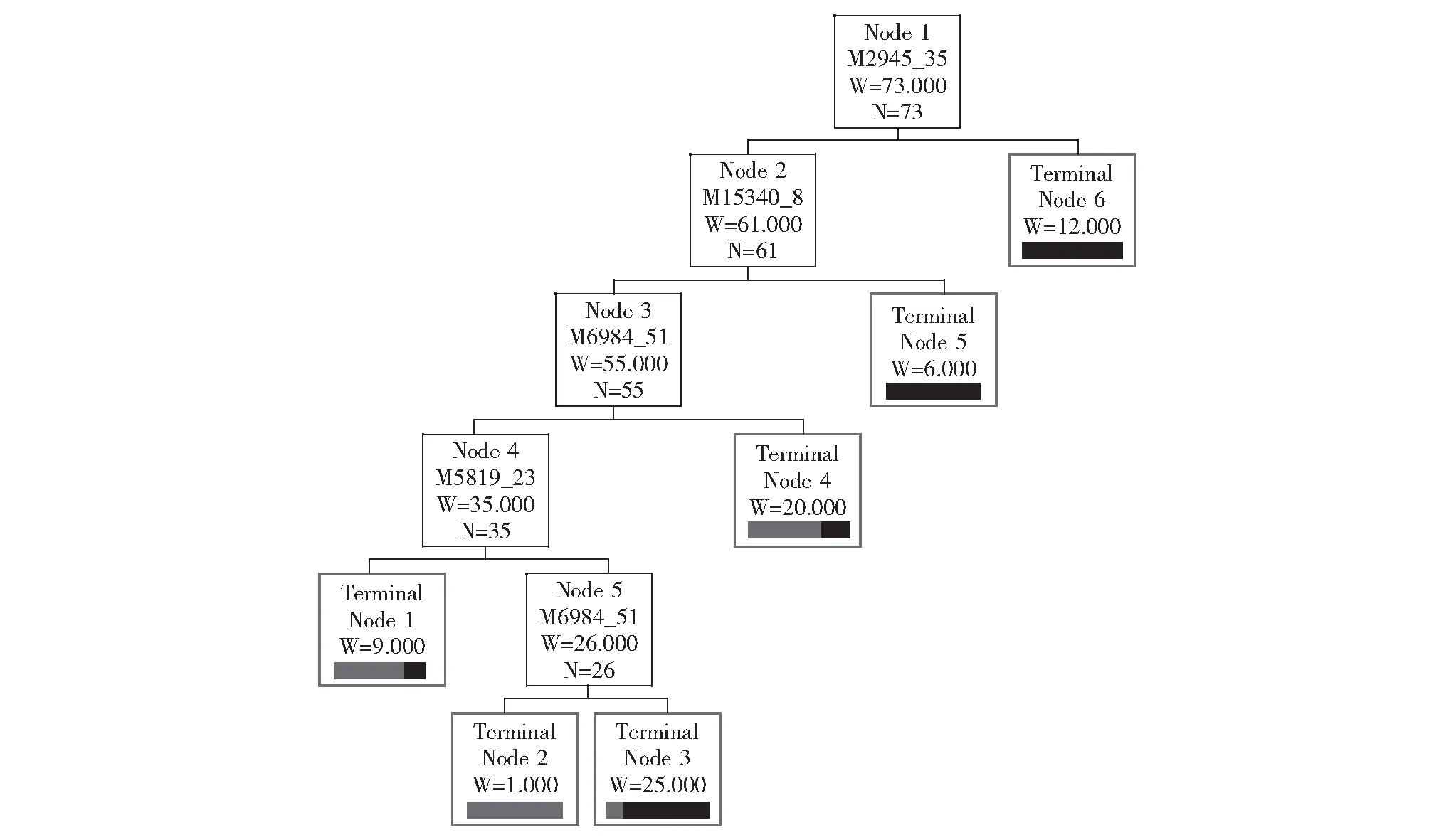
建立诊断模型采用Biomarker PatternsTMSoftware (BPS) 5.0软件在这些差异蛋白峰中优化选择m/z 2945.35、15340.8、6984.51、5819.23 蛋白峰建立肾细胞癌诊断模型(图1),其蛋白峰值分别为4.88059、1.36466、1.20711、0.486689。该模型诊断肾细胞癌的敏感性为83.0%(39/47),特异性为84.6%(22/26)。其中,m/z 2945.35、15340.8、5819.23蛋白在肾细胞癌组高表达,m/z 6984.51蛋白在肾细胞癌组低表达(图2~5)。
诊断模型盲法验证将未经过模型识别的15例肾细胞癌和11例肾脏良性占位病变检测结果代入诊断模型进行验证,诊断肾细胞癌的敏感性为80.0%(12/15),特异性为81.8%(9/11)。
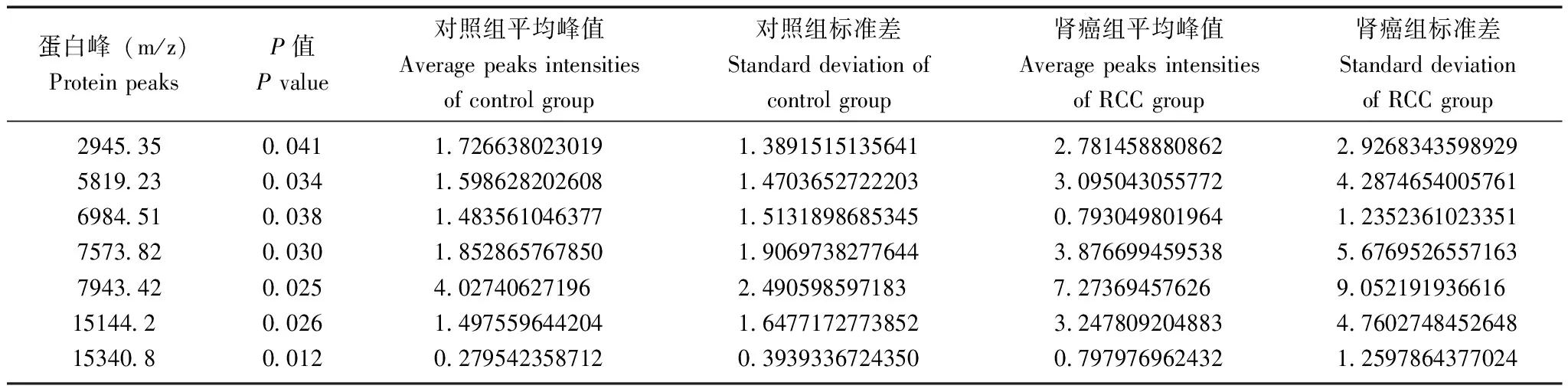
表 1 肾细胞癌组与对照组差异蛋白峰
RCC:肾细胞癌
RCC:renal cell carcinoma
RCC:肾细胞癌RCC: renal cell carcinoma
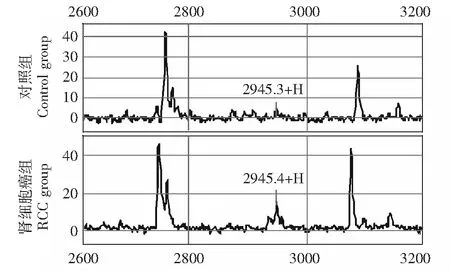
图 2 m/z 2945.35差异蛋白峰在肾细胞癌组与对照组的典型图谱,在肾细胞癌组高表达Fig 2 Typical spectra of RCC and benign renal space-occupying lesion, the differential peak of m/z 2945.35 was overexpressed in RCC group
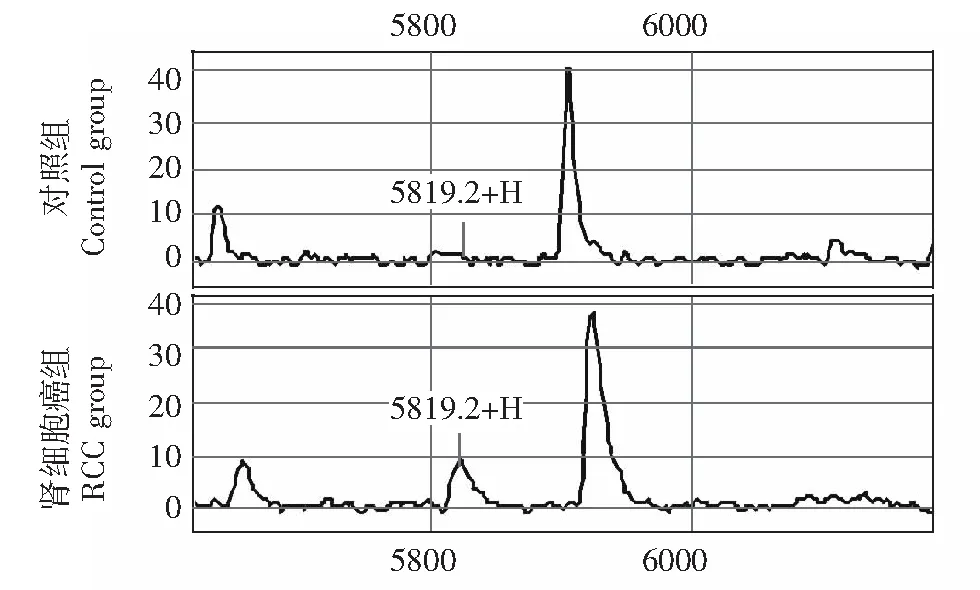
图 3 m/z 5819.23差异蛋白峰在肾细胞癌组与对照组的典型图谱,在肾细胞癌组高表达Fig 3 Typical spectra of RCC and benign renal space-occupying lesion, the differential peak of m/z 5918.23 was overexpressed in RCC group
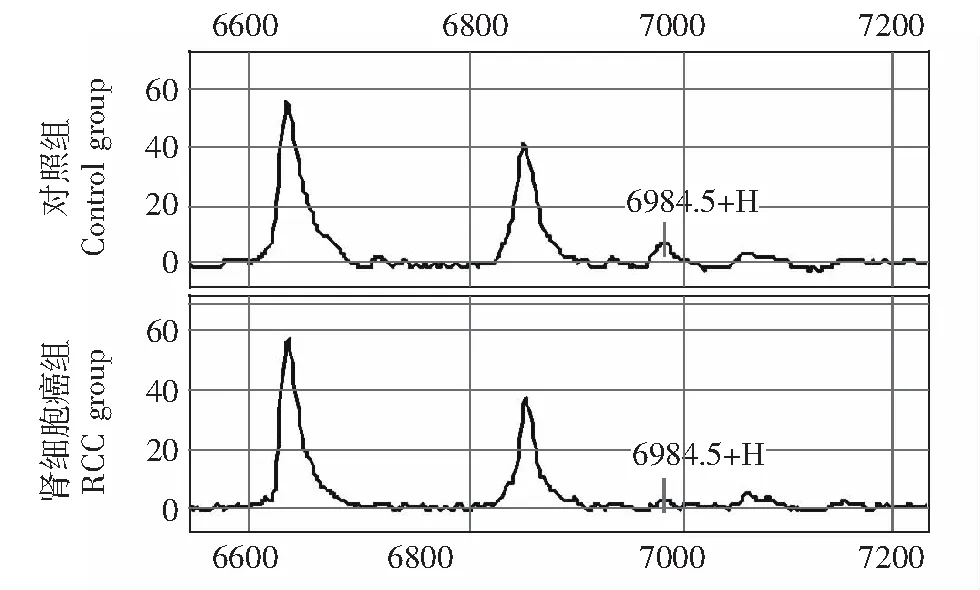
图 4 m/z 6984.51差异蛋白峰在肾细胞癌组与对照组的典型图谱,在肾细胞癌组低表达Fig 4 Typical spectra of RCC and benign renal space-occupying lesion, the differential peak of m/z 6984.51 was underexpressed in RCC group
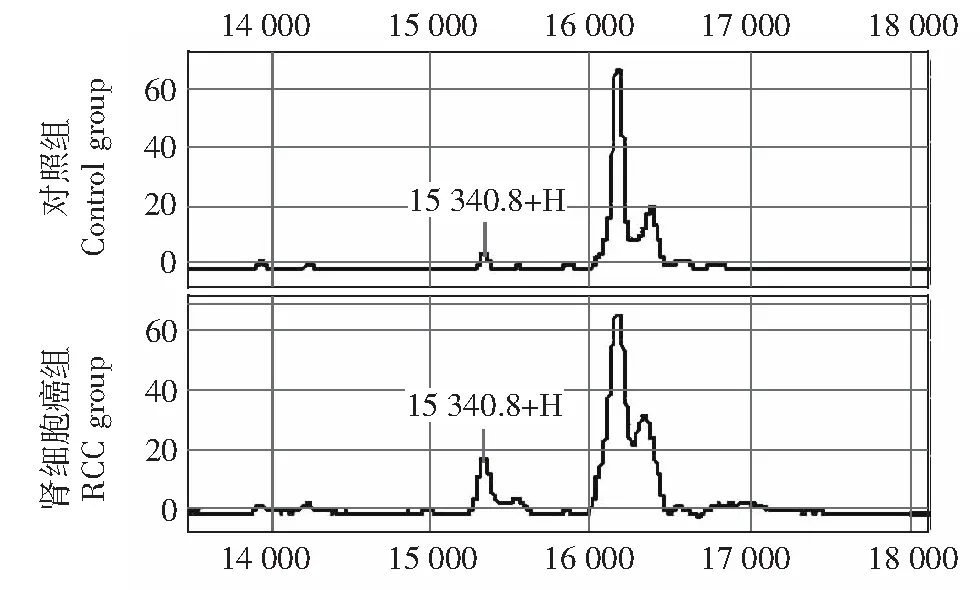
图 5 m/z 15 340.8差异蛋白峰在肾细胞癌组与对照组的典型图谱,在肾细胞癌组高表达Fig 5 Typical spectra of RCC and benign renal space-occupying lesion, the differential peak of m/z 15 340.8 was overexpressed in RCC group
讨 论
磁性微球,也称为磁珠,是直径小于100 nm的单晶体或多晶体,由磁性粒与各种高分子骨架材料制备而成。磁性微球表面可以外被多种具有生物活性的官能团,能共价结合目标蛋白质,利用外部磁场进行分离。磁珠检测样品超小体积(只要0.5 μl)即可,不需做特殊前处理,直接点样检测;分离过程不需要对混合溶液的pH值、温度、离子强度等进行调整,从而避免了传统分离过程中的蛋白质损失,具有快速、高纯、高收率等优点[8];而且具有表面效应和体积效应,比表面积激增,官能团密度和选择性吸附能力增大,可以结合更多的蛋白质[9]。基于磁性微球以上的优点,本研究采用这种技术分离肾细胞癌患者血清中的蛋白质,并联合MALDI-TOF-MS 技术进行质谱分析,其基本原理与SELDI-TOF-MS类似。这种组合已被应用于直肠癌、头颈部肿瘤等领域的研究[10-12]。
肿瘤的发生发展过程必然伴随着细胞内蛋白质类型、数量上的变化,这些蛋白质、分解肽段或其代谢产物可能会释放入血,比较肿瘤与正常健康人群/良性病变血清差异蛋白谱,可能筛选出对肿瘤具有诊断意义的指标。本研究采用弱阳离子磁性微球联合MALDI-TOF-MS技术比较肾细胞癌、肾脏良性占位病变患者血清蛋白,寻找差异蛋白峰,结果在两组中发现7个差异蛋白峰,经过BPS软件智能选择,有4个蛋白峰进入诊断模型,其中3个蛋白峰在肾细胞癌组有高表达,1个蛋白峰低表达。特别是m/z 2945.35、m/z 15340.8这两个蛋白峰,只要m/z 2945.35蛋白峰强度>4.88059就可以判断出12/47例肾细胞癌,m/z 15340.8蛋白峰强度> 1.36466可以判断出6/47例肾细胞癌。这两个蛋白峰有成为肿瘤标记物的潜力,值得进一步鉴定、验证。m/z 6984.51蛋白峰在肾细胞癌组低表达,提示该蛋白的低表达可能促进肿瘤发生发展,对于了解肾肿瘤的机制有一定意义。虽然目前无法明确差异蛋白的性质,采用已经建立的诊断模型,诊断未知的标本具有较高的敏感性、特异性。
Tolson等[3]采用SELDI-TOF-MS技术研究肾癌患者血清,发现相对分子质量为9200和1683两个标志物,经过进一步鉴定,分别为α-1结合珠蛋白(haptoglobin alpha 1,Hptα-1)和血清淀粉样蛋白的异构体(serum amyloid A1,SAA-1)。Engwegen等[4]发现SAA波峰可以出现在肾癌早期、晚期、术前、术后;但后来的研究提示Hptα-1、SAA-1不是肾癌的特异性蛋白,Hptα-1可出现在卵巢癌患者血清中,SAA-1在卵巢癌、前列腺癌、鼻咽癌血清中被发现[13]。上述研究比较的是肾癌、健康人群之间的差异蛋白峰,结果可能是肿瘤的非特异性蛋白,并非肾癌所特有的。本研究比较肾细胞癌、肾脏良性占位病变之间的差异,可以消除一部分非特异性的差异蛋白峰,结果显示在这两个蛋白峰附近,肾细胞癌组与肾脏良性占位病变组的差异没有统计学意义。由于各种肿瘤蛋白理化性质不同,部分肾癌组织发现的差异蛋白可能无法渗入或分泌入血清,在血清中无法检测到。Holcakova等[5]在组织内发现肾癌中相对分子质量为20 165 的差异蛋白,鉴定为α-晶状体蛋白B,采用SELDI-TOF-MS检测同一人群的血清,在相对分子质量 20 165 附近无法检测到蛋白峰。本研究在相对分子质量 20 165 附近也没有检测到蛋白峰。
本研究中标准差较大,提示数据离散较大,Kolmogorov-Smirnov检验P>0.05,说明数据是符合正态分布的。这与MALDI-TOF-MS技术的缺点有关,它是一种半定量技术,蛋白峰高度只是相对于捕获的蛋白丰度,而不是真正血清蛋白浓度。另外,无论使用芯片或者磁珠,不能捕获所有性质相同的蛋白质;不能直接测定蛋白质序列,不能给出c端、N端和蛋白质构型等一些重要信息。蛋白质的鉴定需要通过经典的蛋白质组学研究手段。
[1] 吴阶平. 吴阶平泌尿外科学[M]. 山东:山东科学技术出版社,2004:888-917.
[2] Banks RE, Craven RA, Harnden P, et al. Key clinical issues in renal cancer: a challenge for proteomics[J]. World J Urol, 2007, 25(6):537-556.
[3] Tolson J, Bogumil R, Brunst E, et al. Serum protein profiling by SELDI mass spectrometry: detection of multiple variants of serum amyloid alpha in renal cancer patients[J]. Lab Invest, 2004, 84(7):845-856.
[4] Engwegen JY, Mehra N, Haanen JB, et al. Validation of SELDI-TOF-MS serum protein profiles for renal cell carcinoma in new populations[J]. Lab Invest, 2007, 87(2):161-172.
[5] Holcakova J, Hernychova L, Bouchal P, et al. Identification of alphaB- crystallin, a biomarker of renal cell carcinoma by SELDI-TOF-MS[J]. Int J Biol Markers, 2008, 23(1):48-53.
[6] Jones J, Otu HH, Grall F, et al. Proteomic identification of interleukin-2 therapy response in metastatic renal cell cancer[J]. J Urol, 2008, 179(2):730-736.
[7] Nakamura K, Yoshikawa K, Yamada Y, et al. Differential profiling analysis of proteins involved in anti-proliferative effect of interferon-alpha on renal cell carcinoma cell lines by protein biochip technology[J]. Int J Oncol, 2006, 28(4):965-970.
[8] 王胜林, 王强斌,古宏晨, 等. 磁性微球的生物医学应用研究进展[J]. 化学世界, 2001, 42(7):384-387.
[9] 赵慧君, 王德平,黄文旵, 等. 磁性纳米微球的特性及其在生物医学中的应用[J]. 同济大学学报:医学版, 2003,24(4):288-291.
[10] Sparbier K, Asperger A, Resemann A, et al. Analysis of glycoproteins in human serum by means of glycospecific magnetic bead separation and LC-MALDI-TOF/TOF analysis with automated glycopeptide detection[J]. J Biomol Tech, 2007, 18(4):252-258.
[11] Ducoux-Petit M, Uttenweiler-Joseph S, Brichory F, et al. Scaled-down purification protocol to access proteomic analysis of 20S proteasome from human tissue samples: comparison of normal and tumor colorectal cells[J]. J Proteome Res, 2008, 7(7):2852-2859.
[12] Freed GL, Cazares LH, Fichandler CE, et al. Differential capture of serum proteins for expression profiling and biomarker discovery in pre- and posttreatment head and neck cancer samples[J]. Laryngoscope, 2008, 118(1):61-68.
[13] Engwegen JY, Gast MC, Schellens JH, et al. Clinical proteomics: searching for better tumour markers with SELDI-TOF mass spectrometry[J]. Trends Pharmacol Sci, 2006, 27(5):251-259.
ScreeningfortheSerumDifferentialProteinsofRenalCellCarcinomaUsingMagneticBeads-basedMatrix-assistedLaserDesorption/IonizationTime-of-flightMassSpectrometry
LIU Jin-shun1, LI Han-zhong1, ZHANG Yu-shi1, WANG Peng2,YAN Wei-gang1, XIE Jing2, DONG De-xin1
1Department of Urology,2Centre Laboratory, PUMC Hospital, CAMS and PUMC, Beijing 100730, China
LI Han-zhong Tel: 010-65296035, E-mail: lihanzhong@medmail.com.cn
ObjectiveTo screen for the differential protein peaks of renal cell carcinoma (RCC) using magnetic beads-based matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS).MethodsSerum proteins were profiled by magnetic beads (WCX) from 62 RCC patients and 37 patients with benign renal space-occupying lesions. Protein peaks were identified by MALDI-TOF-MS. Data were analyzed with Biomarker Wizard 3.1 and Biomarker Patterns Software 5.0. Diagnostic model for RCC was constructed based on 47 RCC cases and 26 patients with benign renal space-occupying lesions. The remaining 26 cases were evaluated with blind method.ResultsSeven differential protein peaks related to RCC were identified (P<0.05). The diagnostic model for RCC constructed by the differential protein peaks (m/z2945.35, 15340.8, 6984.51, and 5819.23) generated excellent separation between the RCC and control groups, with a sensitivity of 83.0% and the specificity of 84.6%. As validated by blind method, the model had a sensitivity of 80.0 % and a specificity of 81.8%.ConclusionDifferential protein peaks for RCC can be identified in serum by magnetic beads-based MALDI-TOF-MS, which is also valuable for the establishment of a RCC diagnostic model with a high sensitivity and specificity.
renal cell carcinoma; magnetic beads; matrix-assisted laser desorption/ionization time-of-flight mass spectrometry
ActaAcadMedSin,2011,33(3):287-291
李汉忠 电话:010-65296035,电子邮件: lihanzhong@medmail.com.cn
R737.11
A
1000-503X(2011)03-0287-05
10.3881/j.issn.1000-503X.2011.03.016
国家自然科学基金(30772165)和高等学校博士学科点专项科研基金(20070023069)Supported by the National Natural Sciences Foundation of China(30772165)and the Research Fund for the Doctoral Program of Higher Education of China(20070023069)
2010-07-02)
