沙利度胺对人胰腺癌细胞株SW1990体外增殖及凋亡的影响
2011-11-22沈阳许春芳
沈阳 许春芳
·论著·
沙利度胺对人胰腺癌细胞株SW1990体外增殖及凋亡的影响
沈阳 许春芳
目的观察沙利度胺(THD)体外抑制人胰腺癌细胞株SW1990增殖及诱导其凋亡的作用。方法应用不同浓度的THD(3.125、6.25、12.5、25、50、100、200、400μg/ml)处理胰腺癌SW1990细胞24、48、72 h,用MTT法测定细胞的生长抑制率,流式细胞仪分析细胞周期,AnnexinⅤ/PI检测细胞凋亡率,蛋白质印迹法检测细胞Bcl-2、Bax蛋白的表达。结果THD呈浓度和时间依赖性抑制胰腺癌细胞SW1990的生长。200 μg/ml的THD干预使SW1990细胞G0/G1期比例从(41.15±2.23)%上升到(58.83±2.33)%;细胞凋亡率从2.6%增加到28.0%;细胞Bax蛋白表达量从0.17±0.03上调到0.33±0.04,Bcl-2蛋白表达量从0.35±0.02下调到0.17±0.01,Bcl-2/Bax比值从2.17±0.44下降到0.52±0.07。结论THD可以抑制SW1990细胞增殖,其机制可能与上调Bax蛋白表达、下调Bcl-2蛋白表达,促进细胞凋亡,将细胞周期阻滞于G0/G1期有关。
胰腺肿瘤; 细胞增殖; 细胞凋亡; 沙利度胺
大约80%的胰腺癌发现时已存在远处转移或局部浸润,手术切除率低,预后极差,进展期胰腺癌的中位生存期仅约6个月。因此,寻求新的安全有效的化疗药物成为许多学者研究的焦点之一。沙利度胺(又名反应停, thalidomide,THD)是谷氨酸的衍生物,目前发现其具有良好的抗肿瘤作用。本研究应用沙利度胺体外干预人胰腺癌细胞株SW1990,观察其对细胞增殖、凋亡的影响,探讨其作用机制。
材料和方法
一、MTT法检测细胞增殖
人胰腺癌细胞株SW1990由苏州大学附属第一医院血液研究所惠赠,常规培养。取对数生长期细胞,按1×104/ml的密度接种于96孔培养板,每孔100 μl ,培养至80%融合后,分别加入3.125、6.25、12.5、25、50、100、200、400 μg/ml的THD(常州制药厂生产,批号09102213),同时设空白对照组,每组5个复孔。培养24、48、72 h后,每孔加入5 mg/ml的MTT 20 μl轻轻晃匀,37℃培养4 h,去除上清液,每孔加入DMSO 150 μl,振荡混匀10 min,在BIOLISA酶标仪上测定492 nm处的吸光度(A492)值。细胞增殖抑制率=(A对照组-A实验组)/A对照组×100%。实验重复3次,取均值。
二、流式细胞仪分析细胞周期及AnnexinV/PI细胞凋亡检测
用50、100、200 μg/ml的THD处理SW1990细胞48 h,用含EDTA的胰酶消化收集细胞,PBS洗涤,离心,70%乙醇4℃固定过夜。PBS洗涤后加RNaseA 37℃水浴30 min,最后加入PI 400 μl。于BIOLISA流式细胞仪上分析细胞周期;另用不含EDTA的胰酶消化收集细胞,PBS洗涤,加入Binding Buffer 500 μl,加入AnnexinV(FITC)5 μl,混匀后加入5 μl PI,混匀,室温避光反应5~15 min,于流式细胞仪检测细胞凋亡。实验重复3次。
三、蛋白质印迹法检测Bcl-2、Bax蛋白表达
以50、100、200 μg/ml的THD处理SW1990细胞48 h,收集细胞,加入细胞裂解液冰上孵育30 min,常规行蛋白质印迹法。设空白对照组。Bcl-2、Bax一抗及二抗均购自江苏碧云天生物技术研究所,1∶1000稀释,最后ECL发光,暗盒曝光、显影和定影,用明基5000扫描仪扫描。以β-actin作为内参。目的条带与内参条带灰度比值表示蛋白表达量。
四、统计学分析

结 果
一、SW1990细胞增殖的变化
THD基本呈浓度和时间依赖性抑制胰腺癌细胞SW1990的生长(图1)。6.25、12.5 μg/ml组72 h点的细胞生长抑制率较24 h点显著增加,≥25 μg/ml各组48、72 h点的细胞生长抑制率均较24 h点显著增加(P值均﹤0.05)。

与24 h组比较,aP﹤0.05
二、SW1990细胞周期的变化
50、100、200 μg/ml的THD处理SW1990细胞48 h后,G0/G1期比例增多,S期和G2/M期比例减少(表1)。


组别G0/G1期G2/M期S期对照组41.15±2.2334.05±0.8324.80±1.63THD50μg/ml组46.55±2.44a33.00±3.3120.45±0.87a 100μg/ml组53.30±3.17a27.67±3.12a19.02±1.73a 200μg/ml组58.83±2.33a26.30±3.30a14.87±3.28a
注: 与对照组比较,aP<0.05
三、SW1990细胞凋亡率的变化
50、100、200 μg/ml的THD处理SW1990细胞48 h后,细胞凋亡率分别为8.7%、17.1%、28.0%,均较对照组显著增加(P值均<0.05,图2)。
四、SW1990细胞Bcl-2、Bax蛋白表达的变化
THD处理SW1990细胞48 h后,细胞Bcl-2的表达减弱,Bax的表达增强,Bcl-2/Bax比值下降,各组间差异有统计学意义(P值均<0.05;图3,表2)。

图2 各组SW1990细胞的凋亡率

图3 各组SW1990细胞的Bcl-2、Bax表达
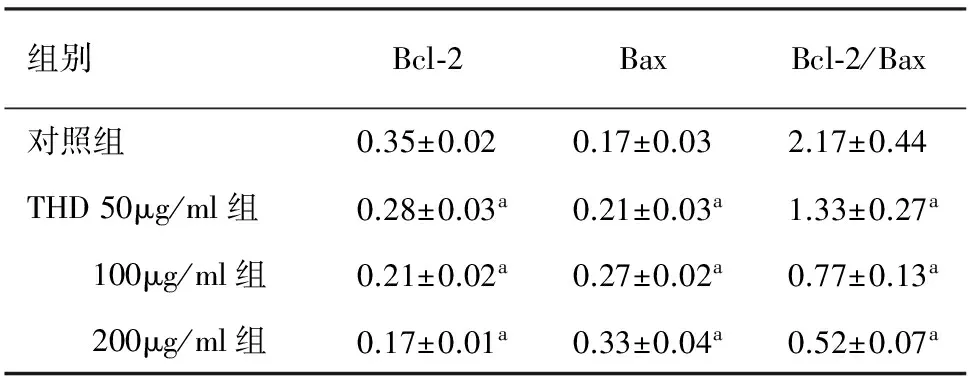
组别Bcl⁃2BaxBcl⁃2/Bax对照组0.35±0.020.17±0.032.17±0.44THD50μg/ml组0.28±0.03a0.21±0.03a1.33±0.27a 100μg/ml组0.21±0.02a0.27±0.02a0.77±0.13a 200μg/ml组0.17±0.01a0.33±0.04a0.52±0.07a
注:与对照组比较,aP<0.05
讨 论
THD对血液系统肿瘤和实体瘤,如前列腺癌、肾癌、多发性骨髓瘤和套细胞淋巴瘤等均具有良好的抗肿瘤作用[1]。其机制广泛而复杂,不仅具有抗血管生成和免疫调节功能[2],而且具有抑制细胞增殖、诱导凋亡和阻滞细胞周期作用[3]。本实验结果显示,THD呈浓度和时间依赖性抑制SW1990的生长,其中以THD 400 μg/ml作用72 h的增殖抑制作用最为明显,与Sun等[4]用THD处理肝细胞癌的研究结果相似。
细胞周期调控异常与肿瘤的发生、发展密切相关。申凤乾等[5]报道,THD能将人结肠癌HCT-8细胞阻滞在G0/G1期,从而抑制细胞增殖。本结果显示,THD处理SW1990细胞后,G0/G1期细胞比例上升,而S、G2/M期细胞比例减少。但Gao等[6]报道,THD对神经胶质瘤U251-MG的细胞周期无明显阻滞作用,可见THD对细胞周期的影响可能因肿瘤类型或细胞类型存在差异。
Bcl-2家族分为促凋亡(Bax、Bak、Bad)和抗凋亡(Bcl-2、Bcl-xL)两类基因。目前研究发现,Bc1-2/Bax比例平衡是细胞凋亡发生与否的关键因素[7]。本实验结果显示,THD处理SW1990细胞后,Bcl-2蛋白表达下调,Bax蛋白表达上调,Bcl-2/Bax比值降低,与Dmoszynska等[8]研究结果相似。进一步证实THD诱导SW1990细胞凋亡可能与下调Bc1-2、上调Bax基因表达有关。
[1] Huang YT, Hsu CW, Chiu TH. Thalidomide and its analogs as anticancer agents. Tzu Chi Medical Journal, 2008, 20: 188-195.
[2] Stepień H, Lawnicka H, Mucha S, et al. Inhibitory effect of thalidomide on the growth, secretory function and angiogenesis of estrogen-induced prolactinoma in Fischer 344 rats. Life Sci, 2006, 79: 1741-1748.
[3] Wang HY, Zhang M, He PC, et al. Changes of gene expression profile in human myeloma cell line induced by thalidomide. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2010, 18: 396-402.
[4] Sun P, Zhang LM, Sun DJ, et al. Inhibitory effect of thalidomide on growth of human hepatoma cell line SMMC-7721 cells. Zhonghua Zhong Liu Za Zhi, 2009, 31: 582-586.
[5] 申凤乾,王贵吉,崔瑞雪,等.沙利度胺对人结肠癌HCT-8细胞周期及NF-κB、PPARγ表达的影响.中国实用医刊,2009,36:49-51.
[6] Gao S, Yang XJ, Zhang WG, et al.Mechanism of thalidomide to enhance cytotoxicity of temozolomide in U251-MG glioma cells in vitro. Chin Med J(Engl), 2009,122: 1260-1266.
[7] Reed JC. Proapoptotic multidomain Bcl-2/Bax-family proteins: mechanisms, physiological roles, and therapeutic opportunities. Cell Death Differ,2006,13:1378-1386.
[8] Dmoszynska A, Podhorecka M, Klimek P,et al. Lovastatin and Thalidomide have a combined effect on the rate of multiple myeloma cell apoptosis in short term cell cultures. Eur J Clin, 2006, 62: 325-329.
2011-01-04)
(本文编辑:屠振兴)
EffectsofthalidomideonproliferationandapoptosisinhumanpancreaticcancercelllineSW1990
SHENYang,XUChun-fang.
DepartmentofGastroenterology,JianhuHospital,NantongUniversity,Nantong224700,China
XUChun-fang,Email:xcf601@163.com
ObjectiveTo investigate the effect of thalidomide on the proliferation and apoptosis in human pancreatic cancer cell SW1990 in vitro.MethodsSW1990 cell line was treated with thalidomide at different concentrations (3.125, 6.25, 12.5, 25, 50, 100, 200 and 400 μg/ml) for 24, 48, 72 h, and then cell proliferation were evaluated by MTT. Cell cycle was determined by flow cytometry, apoptosis was determined by annexin V/PI fluos staining, Bcl-2, Bax protein expression and Bcl-2/Bax ratios were measured by Western Blot in vitro.ResultsThalidomide inhibited the proliferation of SW1990 cells in a time and dose-dependant manner. The proportion of G0/G1phase of SW1990 cells with 200 μg/ml thalidomide treatment increased from (41.15±2.23)% to (58.83±2.33)%, apoptosis rate increased from 2.6% to 28.0%, the expression of Bax protein up-regulated from 0.17±0.03 to 0.33±0.04, the expression of Bcl-2 protein down-regulated from 0.35±0.02 to 0.17±0.01, the ration of Bcl-2/Bax decreased from 2.17±0.44 to 0.52±0.07.ConclusionsThalidomide can inhibit the proliferation of pancreatic cancer SW1990 cells by up-regulating Bax, down-regulating Bcl-2, inducing cell apoptosis and cell G0/G1phase arrest.
Pancreatic neoplasms; Cell proliferation; Apoptosis; Thalidomide
10.3760/cma.j.issn.1674-1935.2011.06.008
224700 南通,南通大学附属建湖医院消化科(沈阳);苏州大学附属第一医院消化科(许春芳)
许春芳,Email:xcf601@163.com
