木瓜蛋白酶制备大豆抗癌活性肽的研究
2011-11-20于胜男葛锡娟
吴 非 于胜男 葛锡娟 王 鹏 李 良
(东北农业大学食品学院,哈尔滨 150030)
木瓜蛋白酶制备大豆抗癌活性肽的研究
吴 非 于胜男 葛锡娟 王 鹏 李 良
(东北农业大学食品学院,哈尔滨 150030)
以大豆分离蛋白为原料,以细胞生长抑制率为指标,用木瓜蛋白酶对其进行酶解,得到大豆抗癌活性肽。木瓜蛋白酶的最佳作用条件为:温度55℃、酶添加量7 000 U/g、反应pH 7.5、底物质量分数6%、酶解时间4 h。在抗癌活性肽制备过程中,对水解度和肽活性之间的关系进行了研究。结果表明,水解度与大豆肽的抗癌活性不呈线性关系。用10 000 u和5 000 u的超滤膜处理木瓜蛋白酶的酶解产物,在不同分子质量的超滤组分中,分子质量小于5 000 u组分的癌细胞生长抑制率最高,达32.58%。
大豆抗癌活性肽 制备 木瓜蛋白酶
大豆含有35%~40%的蛋白质,是食物蛋白的一种重要来源[1]。大豆肽是大豆蛋白经蛋白酶作用后,再经过特殊处理所得到的蛋白质分解物。国内对大豆多肽的研究主要集中在抗氧化性、抗高血压性、降血脂和降胆固醇方面[2-5],有关大豆抗癌活性肽的报道较少。前期研究结果表明,大豆多肽也具有抗癌活性[6]。
癌症是当今发病率最高的疾病,严重危害人类健康。目前我国癌症患者已超过750万,每年约有130多万人死于癌症,而且其发病率和死亡率还在逐年递增[7]。合成的抗癌药物虽能有效地控制疾病,但同时它也具有造成免疫系统损伤、骨髓受抑制等副作用[8],因而,研究食品源的抗癌活性肽具有十分重要的意义。我国是大豆的主产国,大豆资源非常丰富[9],为研究大豆抗癌活性肽提供了物质基础。前期研究结果表明,多种蛋白酶都可以用来制备大豆抗癌活性肽,木瓜蛋白酶的制备效果更加突出[6]。大豆抗癌活性肽具有安全性高、毒副作用小、容易吸收和易于制备等优点[10]。该论文研究结果对开发大豆抗癌活性肽产品、预防和辅助治疗疾病、促进大豆精深加工都具有积极的意义。
1 材料与方法
1.1 主要试验材料及设备
大豆分离蛋白:国家大豆工程技术研究中心。胃癌细胞7901:乳品国家重点实验室;木瓜蛋白酶:无锡杰能科生物有限公司;其他试剂均为分析纯。
快速离心机:北京医用离心机厂;凯氏定氮仪:上海新嘉电子有限公司;冷冻干燥机:上海医用离心机厂;Labscale TFF System超滤系统:Millipore;超净工作台:北京安泰;CO2细胞培养箱:上海博迅实业有限公司;倒置显微镜:日本OLYMPUS;酶联免疫检测仪:美国BIO-RAD。
1.2 试验方法
1.2.1 原料常规指标测定
蛋白质含量的测定方法按照 GB/T 5009.5—2003,水分含量的测定方法按照 GB/T 5009.3—2003,灰分的测定方法按照GB/T 5009.4—2003。
1.2.2 酶活力测定
采用福林-酚法进行测定,参照SB/T 10317—1999。
1.2.3 水解度(DH)测定
依据pH-Stat法,蛋白质水解时会释放出氨基酸使溶液的pH变化,通过滴定保持蛋白酶的最佳反应pH环境,因此,水解度可由水解过程中NaOH的消耗量来计算[11]。
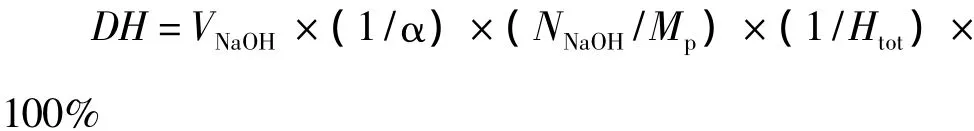
式中:VNaOH为水解过程中消耗NaOH的量/mL,Mp为底物蛋白质的总量/g,NNaOH为NaOH的当量浓度/mol/L,Htot为每克蛋白质中肽键的克当量数(取7.8),α 为氨基的解离度,1/α =1+10(pK-pH)
1.2.4 大豆肽抗癌活性的测定
采用MTT法测定大豆肽对胃癌细胞的生长抑制率[12]。
1.2.5 大豆抗癌活性肽的制备研究
配制质量分数为6%的大豆分离蛋白溶液,在90℃热处理15 min,然后,将反应条件调至木瓜蛋白酶反应的最适条件[13],用6 000 U/g酶活单位的木瓜蛋白酶进行水解制备大豆肽。反应过程中用1 mol/L的NaOH溶液或HCl调节酸碱度,使其一直处于酶的最适反应pH值,并使温度始终保持在酶反应的最适温度。在酶解开始后2、3、4、5、6 h取水解液,在100℃条件下保温15 min使酶失活,调节pH到大豆分离蛋白等电点pI 4.5后,4 000 r/min离心15 min,取上清液测水解度。余下上清液进行冻干,取一定质量的冻干粉溶于磷酸盐缓冲液(pH 7.4),溶液过0.2 μm的滤膜后,作用于胃癌细胞,测定细胞生长抑制率。以底物浓度、温度、pH、酶用量、酶解时间为因素,以癌细胞生长抑制率为检测指标,采用5因素5水平正交试验设计(见表1),确定木瓜蛋白酶的最优反应条件。
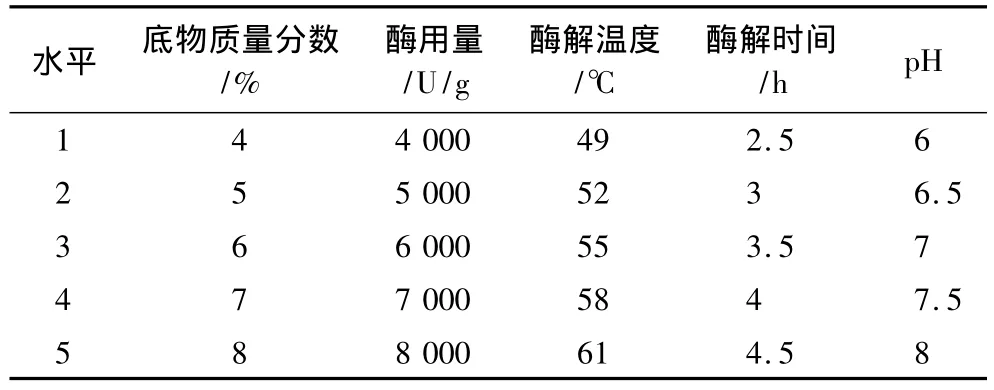
表1 L25(55)因素水平表
1.2.6 大豆抗癌活性肽的超滤分离
将大豆分离蛋白的酶解液通过截留分子质量为10 000 u和5 000 u的聚醚砜膜,将10 000 u的超滤膜的滤过液作为5 000 u超滤膜的起始液,超滤条件为压力0.2 Mpa、pH 7.0。分别收集外液和内液,得到分子质量大于10 000 u、分子质量在10 000~5 000 u之间和分子质量小于5 000 u的3种酶解液。冻干后测定其细胞生长抑制率。
1.2.7 数据处理
原始数据的整理采用Microsoft Excel(Office 2007)软件完成;试验数据采用SAS8.1软件进行统计分析。
2 结果与讨论
2.1 大豆分离蛋白的常规指标
试验所用大豆分离蛋白含蛋白质、水分、灰分分别为 90.33%、3.72%、3.04%。
2.2 蛋白酶的活力
通过绘制酪氨酸标准曲线得回归方程为Y=0.010 6x -0.002 5,R2=0.984 6。式中,x 代表酪氨酸质量浓度(g/mL),Y代表OD值,0.984 6为标准曲线的线性相关系数。结果表明,木瓜蛋白酶活力为23 106.3 U/g。酶活性的测定对本试验十分重要,它反应了1 g酶制剂在适宜的条件下水解酪蛋白的能力。
2.3 用木瓜蛋白酶制备大豆抗癌活性肽的酶解条件优化
以底物浓度、酶用量、温度、水解时间、pH为单因素进行试验,以癌细胞生长抑制率为检测指标,研究单因素对于木瓜蛋白酶酶解液抗癌活性的影响。单因素试验确定了底物质量分数、酶用量、温度、水解时间、pH 分别为 6%、7 000 U/g、55 ℃、4 h、7.5时,其对癌细胞生长抑制作用效果最佳。
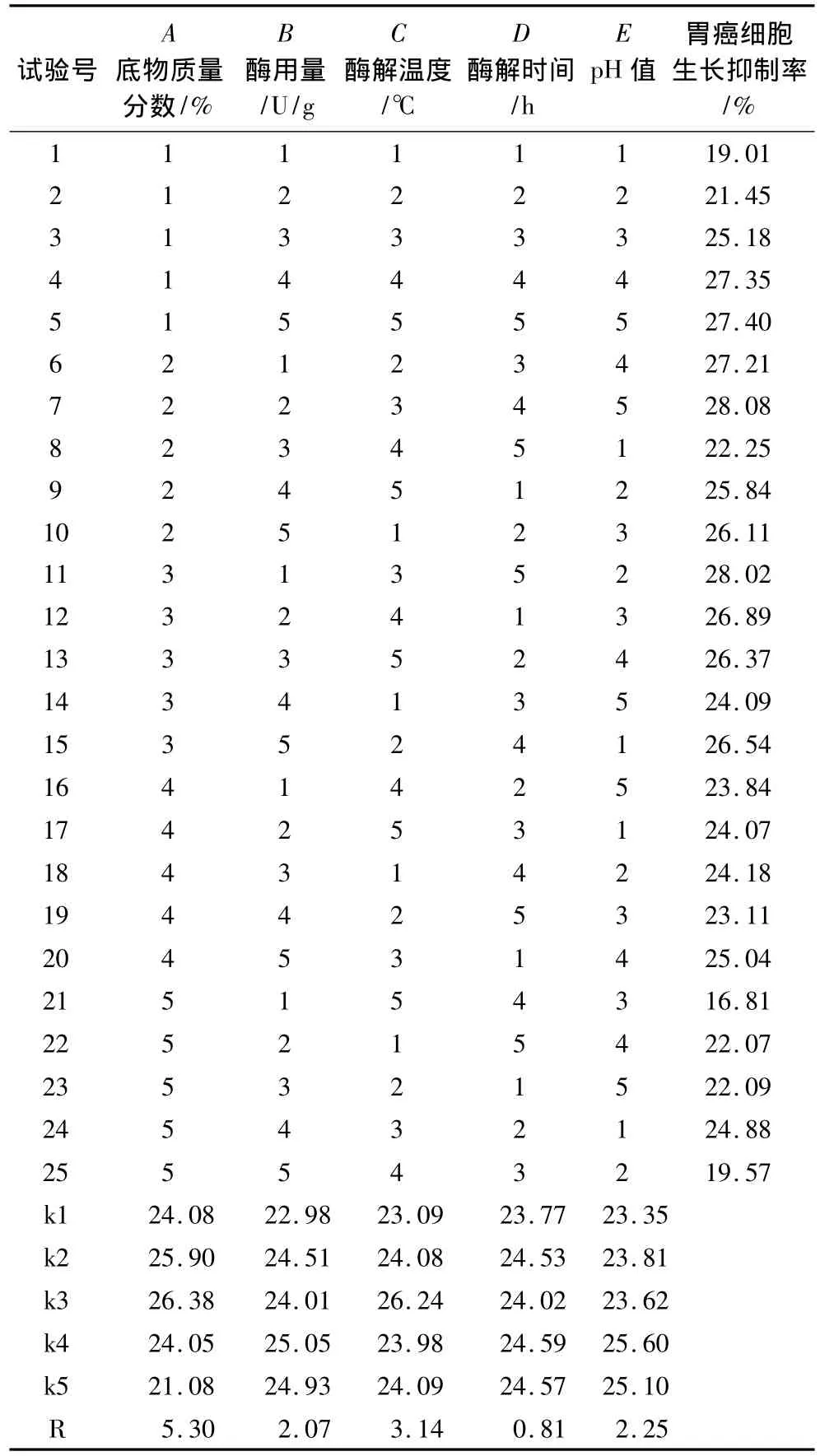
表2 木瓜蛋白酶制备大豆抗癌活性肽的正交试验结果
经过预试验(单因素)考虑确定了其试验因素的范围,对底物质量分数、酶用量、酶解温度、酶解时间和pH值,进行5因素5水平的正交试验设计,确定木瓜蛋白酶制备大豆抗癌活性肽的最优条件,试验结果见表2。
从表2正交试验的极差分析可以看出,各因素对木瓜蛋白酶水解大豆分离蛋白的影响次序依次是:底物质量分数>酶解温度>酶用量>反应pH>酶解时间。反应条件最佳组合为A3B4C3D4E4,即木瓜蛋白酶制备大豆抗癌活性肽的最优作用条件为:酶解温度55℃、酶添加量7 000 U/g、反应pH 7.5、酶解时间4 h、底物质量分数6%。
2.4 大豆抗癌活性肽的细胞生长抑制率与水解度之间的关系
在木瓜蛋白酶的不同酶解时间下,测定水解度和大豆肽的细胞生长抑制率,结果见图1。
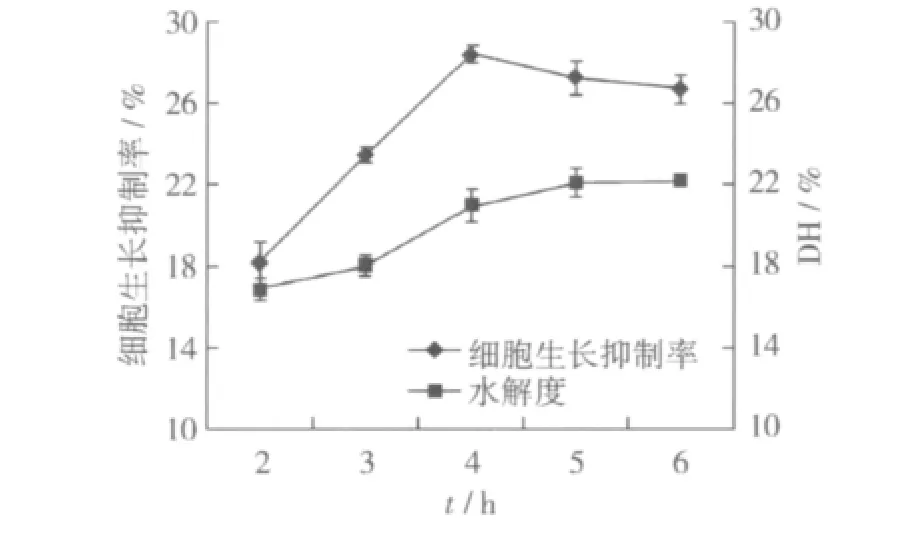
图1 细胞生长抑制率与水解度之间的关系
由图1可以看出,细胞生长抑制率与水解度之间并不呈线性关系,当水解度为20.95%时,有最大的细胞生长抑制率28.34%;当水解度继续增大时,细胞生长抑制率有所下降,而后趋于平稳。原因是随着酶解反应的进一步发生,可与酶反应的底物逐渐减少,酶切位点也逐渐减少,同时酶活性也有所降低,产物的积累对酶的作用也会产生竞争性抑制,而且已产生的有活性肽段会被进一步水解,所以,酶解产物的活性有所下降。
2.5 超滤分离大豆抗癌活性肽
将酶解液进行超滤,获得分子质量大于10 000 u、分子质量在10 000~5 000 u之间和分子质量小于5 000 u的3种大豆肽。测定其细胞生长抑制率,结果见图2。
比较分子质量大于10 000 u、10 000~5 000 u、小于5 000 u和未超滤的4种组分的癌细胞生长抑制率,结果表明,分子质量小于5 000 u的组分的癌细胞生长抑制率最高,为32.58%。通过差异性分析可知,分子质量小于5 000 u组分的癌细胞生长抑制率与其他组分的癌细胞生长抑制率差异显著。因此,选择5 000 u的超滤膜来分离木瓜蛋白酶的酶解产物。
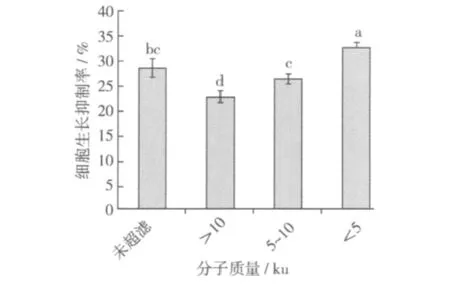
图2 超滤获得的不同分子质量大豆肽的细胞生长抑制率比较
3 结论
3.1 以蛋白质90.33%、水分3.72%、灰分3.04%的大豆分离蛋白为底物,用活力为23 106.34 U/g的木瓜蛋白酶水解,制备大豆抗癌活性肽。木瓜蛋白酶的最佳酶解条件为:温度55℃、酶添加量7 000 U/g、反应pH 7.5、底物质量分数6%、酶解时间4 h。
3.2 水解度与大豆肽的抗癌活性不呈线性关系。水解度在4 h内上升,然后趋于稳定,而细胞生长抑制率在达到最高值后有下降的趋势。
3.3 用超滤膜处理木瓜蛋白酶制备的大豆抗癌活性肽,获得分子质量大于10 000 u、分子质量在10 000~5 000 u之间和分子质量小于5 000 u的3种组分。其中,分子质量小于5 000 u组分的癌细胞生长抑制率最高,达32.58%。
[1]李里特.大豆加工与利用[M].北京:化学工业出版社,2003:55-59
[2]吴建中.大豆蛋白的酶法水解及产物抗氧化活性的研究[D].广州:华南理工大学,2003
[3]张国胜,孔繁东,祖国仁,等.大豆蛋白抗高血压活性肽的研究[J].中国乳品工业,2004,32(8):12 -14
[4]张晓梅.降血压和降胆固醇大豆肽的分离纯化[D].无锡:江南大学,2006
[5]禚同友,丛建民.大豆生物活性肽的制备及其生物活性研究[J].中国酿造,2007(8):6-9
[6]吴非,于胜男,葛锡娟,等.大豆蛋白酶解物的抗癌活性研究[J].东北农业大学学报,2010,41(12):98-102
[7]孙权,徐俊萍,许惠仙,等.大豆异黄酮抗肿瘤作用的研究[J].食品科技,2009,34(8):60 -62
[8]单厚昌,马伟光,高中祖.我国天然抗肿瘤药物的研究进展[J].现代中西医结合杂志,2005,14(6):825 -827
[9]左青.我国大豆加工走势探讨[J].中国油脂,2007,32(8):16-19
[10]Gabor M,Marilena M,Annam A J.Synthesis and structural characterization ofbioactive peptide conjugates using thioether linkage approaches[J].J Peptide Science,2004,10(5):701-713
[11]Adler Nissen.Enzymatic hydrolysis of food protein[M].Essex:Elsevier Applied Science Publishers LTD,1986:122-144
[12]盛新华,卿三华,李镏洋.MTT、WST-8法测定细胞生长抑制率的结果比较[J].山东医药,2006,46(6):20-21
[13]吴显荣.木瓜蛋白酶的开发与应用[J].中国农业大学学报,2005,10(6):11 -15.
Research on Preparation of Soybean Anti-cancer Bioactive Peptide by Papain
Wu Fei Yu Shengnan Ge Xijuan Wang Peng Li Liang
(Food College,Northeast Agricultural University,Harbin 150030)
In this paper, the soybean protein isolate was used as a raw material and treated by papain to obtain soybean anti- cancer bioactive peptide,of which cell growth inhibitory value was regarded as an index.The optimal treating conditions of papain were:hydrolysis temperature 55 ℃,protease dosage 7 000 U/g,pH value 7.5,substrate concentration 6%and enzymolysis time 4 h.The relationship between degree of hydrolysis and anti- cancer activity was studied in the preparation of anti- cancer peptide.The results showed that cancer cell growth inhibitory value had no linear relationship with the hydrolysis degree.The hydrolysate was separated by the 10 000 u and 5 000 u ultrafiltration membrane.The part of molecular weight less than 5 000 u had the highest anti-cancer activity,up to 32.58%.
soybean anti- cancer bioactive peptide,preparation,papain
TS214
A
1003-0174(2011)11-0094-04
哈尔滨市科技创新人才基金(2008RFQXN016)
2010-12-30
吴非,女,1968年出生,教授,博士生导师,大豆产品精深加工
