间歇低氧小鼠胰腺β细胞凋亡及其机制的实验研究
2011-11-20柴文戍
李 光, 柴文戍, 康 健
(1辽宁医学院附属第一医院呼吸科,辽宁 锦州 121000; 2中国医科大学附属第一医院呼吸科,辽宁 沈阳 110001)
间歇低氧小鼠胰腺β细胞凋亡及其机制的实验研究
李 光1, 柴文戍1, 康 健2△
(1辽宁医学院附属第一医院呼吸科,辽宁 锦州 121000;2中国医科大学附属第一医院呼吸科,辽宁 沈阳 110001)
目的探讨间歇低氧对小鼠胰腺β细胞凋亡的影响及其可能机制。方法将30只雄性C57BL/6J小鼠随机分为间歇低氧组、持续低氧组和正常对照组,每组10只。实验结束后测定各组小鼠的胰岛素耐量;采用化学比色法测定胰腺组织丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性;用real-time PCR检测小鼠胰腺组织中锰超氧化物歧化酶(MnSOD)和谷胱甘肽过氧化酶(GPx1) mRNA的表达水平;并用TUNEL染色检测胰腺β细胞凋亡。结果间歇低氧组小鼠胰岛素抵抗水平及胰腺组织中MDA水平显著高于正常对照组和持续低氧组 (Plt;0.01);胰腺组织SOD活性显著低于正常对照组和持续低氧组(Plt;0.01);抗氧化酶MnSOD和GPx1 mRNA的表达水平显著低于正常对照组和持续低氧组 (Plt;0.01);而胰腺β细胞凋亡率显著高于正常对照组和持续低氧组(Plt;0.01)。持续低氧组与正常对照组上述各种指标的比较均无显著差异(均Pgt;0.05)。结论间歇低氧可导致胰腺组织氧化应激状态和胰腺β细胞凋亡,这可能是阻塞性睡眠呼吸暂停低通气综合征患者胰岛素抵抗及2型糖尿病的病理生理基础之一。
间歇低氧; 胰岛素抵抗; β细胞; 细胞凋亡
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hyponea syndrome,OSAHS)是临床上常见的综合征,在美国等西方国家,其发病率男性约为4%,女性约为2%[1]。越来越多的证据表明OSAHS与胰岛素抵抗/2型糖尿病相关,且独立于肥胖的程度,这提示OSAHS可能是胰岛素抵抗/2型糖尿病一种新的风险因子。β细胞功能受损对于糖尿病的形成是必要的,因此为了更好地理解OSAHS与2型糖尿病的关系,需要探讨是否OSAHS或间歇低氧(intermittent hypoxia,IH)通过氧化应激损害胰腺β细胞,进而导致胰岛素抵抗/2型糖尿病。为此,我们选用间歇低氧小鼠模型,模拟OSAHS患者存在的低氧/再氧合病理生理过程,观察胰岛素抵抗、氧化应激状态与胰腺β细胞凋亡的关系。
材 料 和 方 法
1材料
1.1材料 30只8-12周的雄性健康清洁级C57BL/6J小鼠(中国医科大学实验动物中心提供),体重为(22±2)g,间歇低氧造模设备(Oxycycler Model A84XO; BioSpherix Instruments),氧气和氮气(沈阳沈标气体有限公司),诺和灵R(诺和诺德公司),丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(南京建成生物工程研究所),Trizol试剂(Invitrogen Life technologies),荧光定量PCR试剂盒(大连宝生物),缺口末端标记(terminal deoxynucleotidyl transferase biotin-dUTP nick end labeling,TUNEL)法试剂盒(武汉博士德生物工程公司),PCR扩增仪(Biometra)。
1.2间歇低氧动物模型的制备 用随机数字表法将大鼠分为间歇低氧组(intermittent hypoxia group,IH)、持续低氧组(sustained hypoxia group, SH)和正常对照组(control group,CON),每组各10只。间歇低氧组小鼠置于间歇低氧造模设备中,使氧浓度变化于5%-21%,每天持续8 h,共2周;持续低氧组大鼠置于常压低氧箱中,每天持续8 h,调节充入的氮气流量,维持箱内氧浓度为(5±1)%,共2周;正常对照组置于相同培养箱中,空气条件下饲养2周。以上各组动物均于实验2周后取材。
2方法
2.1胰岛素耐量试验 各组小鼠于实验的最后8 h空腹,实验结束后立即按0.75 U/kg剂量腹腔注射短效胰岛素,于注射前(0 min)和注射后15、30、60、90 min时剪尾尖采血以罗氏(Roche)优越型血糖仪测定血糖水平。以0 min时血糖水平作为参比基础,测定在此基础上每一时点血糖比率。
2.2氧化应激指标的检测 采用化学比色法测定胰腺组织MDA含量和SOD活性。
2.3Real-time PCR检测小鼠胰腺组织中锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)和谷胱甘肽过氧化酶(glutathione peroxidase,GPx1) mRNA的表达 采用Trizol从胰腺组织块中抽提总RNA,操作按说明书进行,并行RNA的纯度及定量检测,并将RNA逆转录成 cDNA,用PCR扩增仪进行基因扩增。PCR反应条件为:95 ℃预变性 30 s;95 ℃ 5 s,60 ℃ 34 s,42个循环扩增。β-actin作为内参照。所用β-actin、MnSOD和GPx1引物序列用Primer 5.10软件设计,由北京华大基因公司合成。β-actin 上游引物5’-CTGTCCCTGTATGCCTCTG -3’,下游引物5’-TGTCACGCACGATTTCC-3’ ,PCR产物长度217 bp。MnSOD上游引物5’-GAGCACGCTTACTACCTTC-3’ ,下游引物5’-AACATTCTCCCAGTTGATTAC-3’,PCR产物长度84 bp。GPx1 上游引物5’-GCTCACCCGCTCTTTACC-3’,下游引物5’-GCCGCCTTAGGAGTTGC-3’ ,PCR产物长度255 bp。ABI Prism 7300SDS软件记录数据并分析,将目的基因的Ct用小鼠β-actin的Ct值进行标准化,根据比较法计算基因表达相对量,采用2-ΔΔCt计算基因表达的相对倍数变化。
2.4胰腺β细胞凋亡的检测 使用TUNEL评估胰腺切片β细胞死亡,TUNEL染色方法根据厂商说明书使用。简单地说,胰腺切片通过20 mg/L蛋白酶K预处理15 min,且用正常驴血清和BAS溶液所阻滞,平衡后,TdT酶在37 ℃时加入切片中1 h,在应用Stop溶液后用10 mmol/L PBS溶液冲洗切片,在室温下滴加抗地高辛配基轭合物0.5 h。然后切片采用胰岛素双重染色。TUNEL染β细胞核(绿色),胰岛素染细胞浆(红色)。每个胰岛TUNEL染色阳性的β细胞平均数×1 000(计数每组5只小鼠,每只小鼠15个切片所有胰岛上的TUNEL染色阳性β细胞数后,再计算每个胰岛TUNEL染色阳性的β细胞平均数),比较3组小鼠胰腺β细胞凋亡率,图像原始放大倍数为×200。
3统计学处理
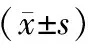
结 果
1各组小鼠胰岛素耐量试验的测定
小鼠间歇低氧暴露2周后,与对照组相比,胰岛素敏感性降低,即胰岛素抵抗增加(Plt;0.01);SH组与对照组胰岛素敏感性无显著差异(Pgt;0.05),见图1。
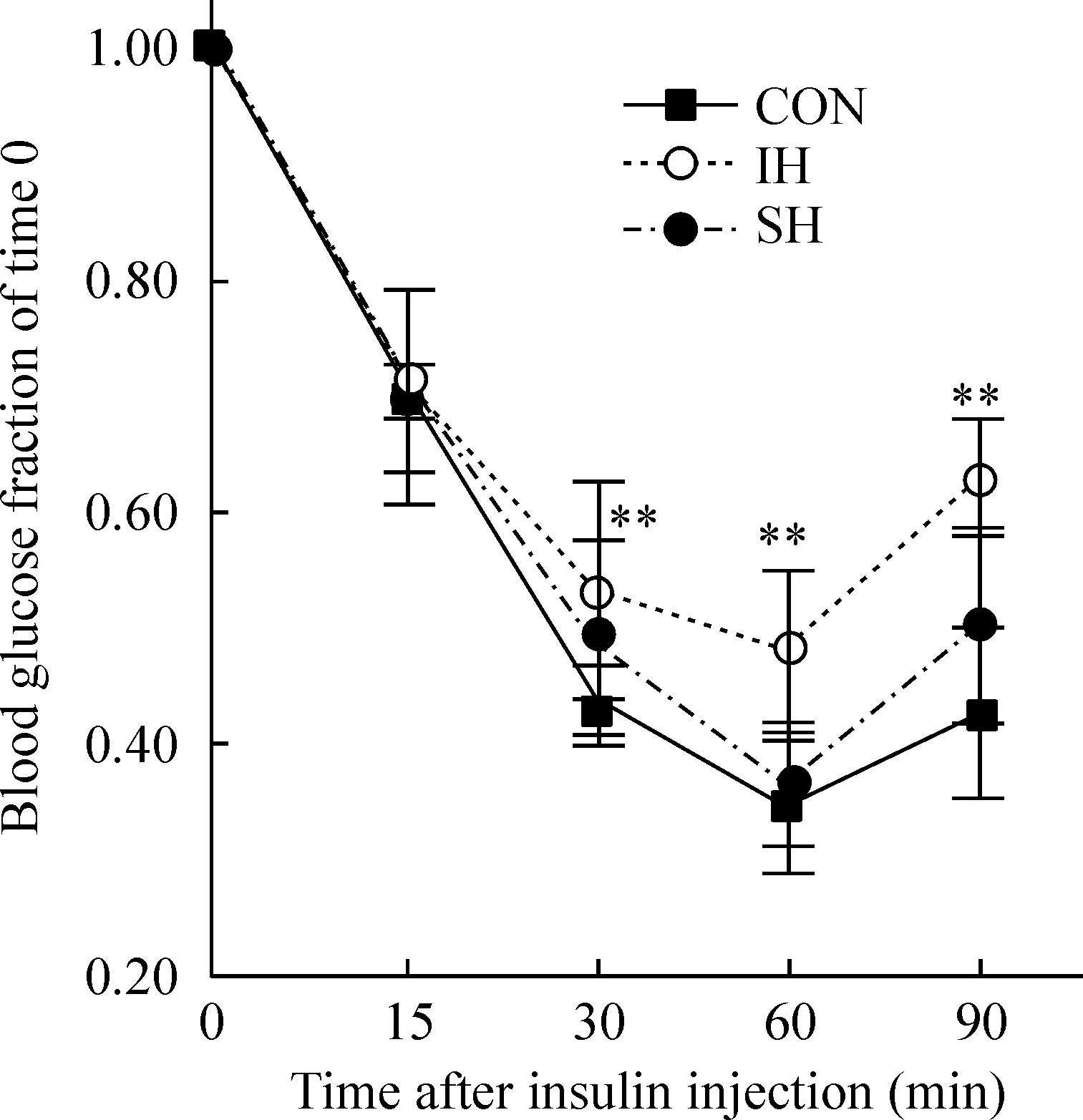
Figure 1. Insulin tolerance test for mice in all groups. ±s.n=5.**Plt;0.01 vs CON group.
2各组小鼠胰腺氧化应激指标的比较
间歇低氧暴露后,小鼠胰腺组织MDA水平较对照组明显增高,而SOD水平较对照组显著降低(Plt;0.01);SH组与对照组氧化应激指标的比较无显著差异(Pgt;0.05),见表1。

表1 各组小鼠胰腺组织氧化应激指标的比较
3各组小鼠胰腺组织中MnSOD和GPx1的mRNA水平表达
间歇低氧暴露后,小鼠胰腺组织MnSOD和GPx1 mRNA表达水平较对照组明显降低(Plt;0.01);SH组与对照组MnSOD和GPx1的mRNA表达水平比较无显著差异(Pgt;0.05),见图2。
4各组小鼠胰腺β细胞凋亡的比较
间歇低氧后胰腺β细胞凋亡率增加4倍多,显著高于对照组和SH组(Plt;0.01),对照组和SH组胰腺β细胞的凋亡率比较无显著差异(Pgt;0.05),见图3。

Figure 2. The expression of MnSOD and GPx1 mRNA of the mouse pancreatic tissues in all groups±s.n=5.**Plt;0.01 vs CON group.

Figure 3. Mouse pancreatic β-cell apoptosis in all groups[insulin-staining(red)and TUNEL staining(green),×200]. A:islet from a CON mouse; B:islet from an IH mouse;C:islet from a SH mouse;D: apoptotic rate in all groups±s.n=5.**Plt;0.01 vs CON group.
讨 论
目前众多人类和动物的实验研究证实间歇低氧或OSAHS对糖代谢产生负面影响,与胰岛素抵抗/2型糖尿病独立相关[2]。OSAHS病人出现糖代谢异常的机制是多重的,其中氧化应激可能是其中重要的一种,即OSAHS病人胰腺损伤可能与IH诱导的氧化应激有关[3]。
MDA是自由基攻击生物膜中的多不饱和脂肪酸、引发脂质过氧化作用而产生的脂质过氧化物;SOD为自由基清除剂,在清除自由基的同时本身被消耗。故测定MDA和SOD水平可反应机体的氧化应激状态。本研究结果表明,间歇低氧组小鼠胰腺组织存在明显的氧化应激状态,MDA水平明显增高,SOD水平显著降低。与间歇低氧不同,持续低氧并没有引起小鼠胰腺组织明显的氧化应激状态,其原因可能为:(1)持续低氧状态下,胰腺组织血流灌注再分布,胰腺组织血流供应充分[4];(2)持续低氧增加了血液红细胞SOD活性,增加了胰腺组织抗氧化能力[5]。而间歇低氧类似于心梗或脑中风时的缺血再灌注损伤,产生大量氧自由基,导致氧化应激状态。氧化应激诱导的微血管内皮损伤可能引起外周胰岛素抵抗增加[6],我们的胰岛素耐量实验研究证实小鼠IH暴露后胰岛素抵抗明显增加,而持续低氧后小鼠胰岛素抵抗则没有明显增加。氧化应激能调节抗氧化酶活性和表达[7-9],本研究表明间歇低氧可降低小鼠抗氧化酶MnSOD 和GPx1的mRNA表达水平。有研究证实抗氧化酶表达的下降可能是氧化应激导致细胞凋亡的内在机制之一[10];另外,β细胞对氧化应激非常敏感[11,12],有报道表明褪黑素(松果体分泌的一种抗氧化剂)能几乎完全逆转β细胞的凋亡,提示氧化应激可能是IH诱导β细胞凋亡的主要原因[6],本实验IH时β细胞的凋亡增加4倍多。
总之,IH或OSAHS时氧化应激增加,使抗氧化酶的表达下降,进而导致β细胞的凋亡增加,这可能是OSAHS患者并发胰岛素抵抗及2型糖尿病的病理生理机制之一。
[1] Young T, Palta M, Dempsey J, et al. The occurrence of sleep-disordered breathing among middle-aged adults[J].N Engl J Med, 1993, 328 (17):1230-1235.
[2] Punjabi NM, Shahar E, Redline S,et al. Sleep-disordered breathing, glucose intolerance, and insulin resistance: the sleep heart health study[J]. Am J Epidemiol,2004,160 (6):521-530.
[3] Furukawa S, Fujita T, Shimabukuro M,et al. Increased oxidative stress in obesity and its impact on metabolic syndrome[J].J Clin Invest,2004,114 (12) :1752-1761.
[4] Ramanathan L,Gozal D,Siegel JM.Antioxidant responses to chronic hypoxia in the rat cerebellum and pons[J].J Neurochem,2005,93(1):47-52.
[5] Vij AG,Dutta R,Satija NK.Acclimatization to oxidative stress at high altitude[J].High Alt Med Biol,2005,6 (4):301-310.
[6] Bertuglia S, Reiter RJ. Melatonin reduces microvascular damage and insulin resistance in hamsters due to chronic intermittent hypoxia[J]. J Pineal Res,2009,46(3):307-313.
[7] Ramanathan L, Gozal D, Siegel JM. Antioxidant responses to chronic hypoxia in the rat cerebellum and pons[J]. J Neurochem,2005, 93(1):47-52.
[8] Jesudason EP, Baben B, Ashok BS,et al. Anti-inflammatory effect of melatonin on Abeta vaccination in mice[J]. Mol Cell Biochem,2007,298(3):69-81.
[9] Veasey SC, Davis CW, Fenik P,et al. Long-term intermittent hypoxia in mice: protracted hypersomnolence with oxidative injury to sleep-wake brain regions[J]. Sleep,2004,27(2):194-201.
[10]Hung MW, Tipoe GL, Poon AM,et al. Protective effect of melatonin against hippocampal injury of rats with intermittent hypoxia[J]. J Pineal Res,2008,44(2):214-221.
[11]Tiedge M,Lortz S,Drinkgern J,et al. Relation between antioxidant enzyme gene expression and antioxidative defense status of insulin-producing cells[J]. Diabetes, 1997,46(11):1733-1742.
[12]Lenzen S, Drinkgern J,Tiedge M. Low antioxidant enzyme gene expression in pancreatic islets compared with various other mouse tissues[J]. Free Radic Biol Med, 1996,20(3):463-466.
Apoptosisinmousepancreaticβcellsexposedtointermittenthypoxia
LI Guang1, CHAI Wen-shu1, KANG Jian2
(1DepartmentofRespiratoryDiseases,TheFirstAffiliatedHospitalofLiaoningMedicalCollege,Jinzhou121000,China;2DepartmentofRespiratoryDiseases,TheFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China.E-mail:kangjian58@163.com)
AIM: To investigate the effect of intermittent hypoxia on the apoptosis of mouse pancreatic β cells and its possible mechanism.METHODSThirty healthy male C57BL/6J mice were randomly divided into 3 groups: control group, sustained hypoxia (SH)group and intermittent hypoxia (IH)group. Insulin tolerance test was performed immediately after experiment. The level of malondialdehyde (MDA) and superoxide dismutase (SOD) were detected by chemical colorimetry. Real-time PCR was used to measure the mRNA expression of manganese superoxide dismutase(MnSOD) and glutathione peroxidase(GPx1). The apoptosis of pancreatic β cells was determined by the method of TUNEL.RESULTSThe levels of insulin resistance and content of MDA in the pancreatic tissue in IH group were significantly higher than those in control group and SH group (Plt;0.01). The activity of SOD and the mRNA expression of MnSOD and GPx1 in IH group were significantly lower than those in control group and SH group (Plt;0.01). The apoptotic rate of IH group was significantly elevated as compared with control group and SH group (Plt;0.01). No significant difference of all above indexes between control group and SH groups was observed (allPgt;0.05).CONCLUSIONApoptosis of pancreatic β cells induced by oxidative stress associated with IH in the pancreatic tissue may be involved in the pathogenesis of obstructive sleep apnea hyponea syndrome with insulin resistance and type 2 diabetes.
Intermittent hypoxia; Insulin resistance; β cells; Apoptosis
1000-4718(2011)04-0794-04
R363
A
10.3969/j.issn.1000-4718.2011.04.034
2010-10-08
2011-01-24
△ 通讯作者 Tel:024-83282532;E-mail:kangjian58@163.com
