p38 MAPK参与千金藤素诱导的心肌细胞凋亡*
2011-11-20李素芳张幼怡
李素芳, 林 森, 张幼怡, 袁 谷, 徐 明△
(1北京大学第三医院血管医学研究所,分子心血管教育部重点实验室,北京 100191;2北京大学化学与分子工程学院化学生物学系,北京分子科学国家重点实验室,生物有机与分子工程教育部重点实验室,北京 100871)
p38 MAPK参与千金藤素诱导的心肌细胞凋亡*
李素芳1, 林 森2, 张幼怡1, 袁 谷2, 徐 明1△
(1北京大学第三医院血管医学研究所,分子心血管教育部重点实验室,北京 100191;2北京大学化学与分子工程学院化学生物学系,北京分子科学国家重点实验室,生物有机与分子工程教育部重点实验室,北京 100871)
目的探讨千金藤素(CEP)致Sprague-Dawley(SD)乳大鼠心肌细胞的凋亡作用及其信号途径。方法应用MTT法检测千金藤素对心肌细胞活性的抑制作用;利用Hoechst 33342染色及Western blotting方法检测凋亡相关信号分子caspase-3,观察CEP致心肌细胞凋亡的作用;采用Western blotting法观测 CEP对有丝分裂原活化蛋白激酶(MAPKs)家族3个主要信号分子c - Jun氨基端激酶(JNK)、细胞外信号调节激酶(ERK)、p38 MAPK磷酸化水平的影响,并利用ERK和p38 MAPK的特异性抑制剂,分别验证两种分子所介导的信号通路在CEP致心肌细胞凋亡中的作用。结果(1)CEP能够剂量依赖和时间依赖地抑制心肌细胞的活性。(2)CEP作用于心肌细胞,出现细胞核碎裂现象和caspase-3激活。(3)CEP作用下p38 MAPK和ERK磷酸化水平显著增强,JNK的磷酸化状态未发生显著改变。(4)p38 MAPK磷酸化抑制剂SB203580显著减轻CEP对心肌细胞活性的抑制作用;ERK磷酸化抑制剂PD98059不能影响CEP对心肌细胞活性的抑制作用。结论p38 MAPK参与CEP致心肌细胞凋亡作用。
千金藤素; 心肌细胞; 细胞凋亡; 有丝分裂素激活蛋白激酶类
千金藤素(cepharanthine,CEP) 是从防己科植物头花千金藤和地不容中分离提取的双苄基异喹啉生物碱[1]。在我国,临床研究发现CEP具有升高白细胞的作用[2]。国外学者的实验研究发现,CEP具有促进肿瘤细胞凋亡的作用[3,4]:CEP作用于HuH-7细胞(人肝细胞癌细胞系)从15μmol/L到20mmol/L,均明显抑制细胞活性;10 μmol/L的CEP明显引起Jurkat细胞(人类T细胞白血病细胞系)、K562细胞(人类慢性髓性白血病细胞系)凋亡。但是目前关于CEP对其它类型细胞的毒副作用缺少相关报道。我们的实验结果表明,10 μmol/L浓度的CEP可以显著抑制心肌细胞活性,提示其可能具有潜在的心脏毒副作用。本文通过体外培养乳大鼠心肌细胞,观察CEP致心肌细胞凋亡的作用,并进一步探讨其可能的药物作用途径。
材 料 和 方 法
1材料
Dulbecco’s modified Eagle’s medium (DMEM) 高糖培养基、胎牛血清(fetal bovine serum, FBS)和胰酶均购自Hyclone;II型胶原酶、ERK磷酸化抑制剂PD98059、p38 MAPK磷酸化抑制剂SB203580和Hoechst 33342均购自Sigma;抗ERK1(K-23)抗体、抗p38 MAPK抗体、抗GAPDH抗体和辣根过氧化物酶标记的IgGⅡ抗均购自Santa Cruz;抗phospho-ERK1/2抗体、抗phospho-SAPK/JNK (Thr183/Tyr185)抗体、抗phospho-p38MAPK抗体和抗caspase-3抗体均购自Cell Signaling;千金藤素购自中国药品生物制品检定所;二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑兰[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]和Triton X-100均购自北京鼎国生物技术有限公司;Hanks BSS购自Decent Biotech;二喹林甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒和化学发光底物(SuperSignal West Pico enhanced-chemiluminescent substrate,ECL)试剂盒均购自Pierce;硝酸纤维素膜购自Pall。
2方法
2.1新生大鼠心肌细胞培养 取出生1-2 d的Sprague-Dawley(SD)新生大鼠(北京大学医学部实验动物科学部提供)进行新生大鼠心肌细胞的分离和培养,方法同前[5]。心肌细胞悬液,接种于直径100 mm的培养皿中, 37 ℃、5% CO2培养。在含10% FBS的DMEM培养液中培养48 h 后,更换为无血清的DMEM培养液,继续培养24 h。细胞处理分为3组:对照组、CEP处理组、CEP + 磷酸化抑制剂处理组(CEP + SB203580 、CEP + PD98059 )和磷酸化抑制剂处理组(SB203580、PD98059)。提前30 min分别加入SB203580或PD98059,终浓度为10 μmol/L。
2.2细胞活性检测 采用MTT法,方法同前[6]。细胞种到96孔板,5×104cells/well,药物处理后,换为含5 g/L MTT的1×PBS溶液。继续在培养箱内(37 ℃、2%CO2)培养4 h后,将溶液吸弃,每孔加入15 μL DMSO溶解结晶,15 min后待结晶完全溶解,在波长570 nm处读取吸光值,间接反映活细胞数量。
2.3细胞凋亡检测 采用Hoechst 33342染色法。约2×105cells/well心肌细胞接种于6孔板,处理组给予10 μmol/L CEP孵育48 h 。吸弃培养液,PBS溶液(37℃温浴)洗2遍。每孔加入4%多聚甲醛(37 ℃温浴)200μL,室温固定15 min, PBS溶液洗3次,每次5 min,加入0.2% Triton X-100,37 ℃破膜15 min,0.3% Triton X-100室温洗3次,每次5 min。每孔加入200 μL Hoechst 33342室温染色15 min,终浓度为40 mg/L。0.3% Triton X-100室温洗3次,每次5 min,在倒置荧光显微镜下采集观察细胞核的形态。
2.4蛋白表达检测 采用Western blotting法。106cells/well,细胞经过相应处理后,吸弃培养液,每孔加入65 μL裂解液[含20 mmol/L Tris-HCl (pH 7.4),100 mmol/L NaCl,10 mmol/L sodium pyrophosphate, 5 mmol/L EDTA,50 mmol/L NaF,1 mmol/L sodium vanadate,0.1% SDS,10% glycerol,1% Triton X-100,1% sodium deoxycholate,0.1 mmol/L aprotinin,1 mmol/L PMSF]。将细胞样本超声裂解,超声强度为40 W,每个样本超声3次,每次10 s。4 ℃ 12 000×g离心15 min,收取上清。蛋白浓度测定采用BCA法。取50 μg蛋白上样、10%聚丙烯酰胺凝胶电泳并转移到硝酸纤维素膜上,5%脱脂奶或5%BSA粉室温封闭1 h。抗caspase-3抗体、抗p-ERK1/2抗体、 抗ERK1/2抗体、抗p-JNK抗体、抗p-p38 MAPK抗体、抗p38 MAPK抗体、GAPDH抗体,按照1∶1 000稀释的浓度杂交,4 ℃过夜。1∶2 000稀释的辣根过氧化物酶标记的IgGⅡ抗室温杂交1 h,采用ECL试剂显色并曝光成像。
3统计学处理
结 果
1MTT法检测CEP对心肌细胞活性的影响
CEP可以剂量和时间依赖性抑制心肌细胞的活性。与对照组相比, 3 μmol/L、5 μmol/L 、10 μmol/L CEP孵育心肌细胞,细胞活性明显减低。CEP孵育48 h,3 μmol/L细胞活性减低至61.3% ± 8.3%(Plt;0.01),5 μmol/L细胞活性减低至50.5%±9.7%(Plt;0.01),而10 μmol/L细胞活性降至2.2% ± 0.8%(Plt;0.01);10 μmol/L CEP 孵育心肌细胞,12 h 细胞活性显著下降,细胞活性降至80.8%±0.3%(Plt;0.01),24 h细胞活性降至55.1% ± 9.0%(Plt;0.01),见图1。
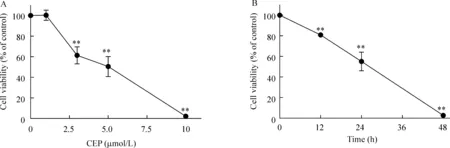
Figure 1. Effects of CEP on myocardial cell viability. A: the cardiomyocytes were exposed to different concentrations of CEP (0-10 μmol/L) for 48 h; B: the cells were exposed to 10 μmol/L of CEP for 12 h, 24 h and 48 h. Cell viability was determined by MTT assay. ±sE.n=3. **Plt;0.01 vs control group(0 μmol/L or 0 h).
2CEP诱导心肌细胞凋亡
与对照组相比,10 μmol/L CEP作用心肌细胞48 h后,细胞核皱缩、核碎裂现象明显,箭头所指处为发生核碎裂的细胞,见图2A。检测caspase-3的激活情况,可以见到剪切体caspase-3即激活的caspase-3增多,见图2B。

Figure 2. Effects of CEP on apoptosis in neonatal rat cardiomyocytes. A: the Hoechst staining for the detection of cardiomyocytes with the apoptotic morphology. Cardiomyocytes were treated with CEP (10 μmol/L) for 48 h,and then fixed and stained with Hoechst 33342. The fragmented nucleus of apoptotic cells were observed under fluorescence microscope;B: Western blotting analysis of CEP-induced expression of cleaved caspase-3.Cleaved caspase-3 increased in cardiomyocytes incubated with CEP(10 μmol/L) for 48 h. Con:control.
3CEP对p38MAPK、EKR1/2和JNK1/2活性的影响
CEP分别孵育心肌细胞3 h、6 h、12 h和24 h。Western blotting结果显示, p38 MAPK磷酸化水平在各时点均较对照组明显增高;ERK1/2磷酸化水平在3 h、6 h和12 h较对照组明显增强,24 h磷酸化水平无明显变化;而JNK1/2的活性未受到显著影响,见图3。实验结果表明CEP可显著激活p38 MAPK和ERK1/2,提示p38 MAPK和ERK1/2可能与CEP的致细胞凋亡作用相关。
4抑制p38MAPK和ERK1/2的磷酸化对CEP致心肌细胞凋亡作用的影响
CEP + SB203580组细胞活性较高于CEP组[(74.0 ± 4.7)%vs(45.5± 4.1)%,Plt;0.01],见图4A;CEP + PD98059组细胞的活性与CEP组无明显差异[(52.8± 4.8)%vs(53.7± 4.8)%],见图4B。
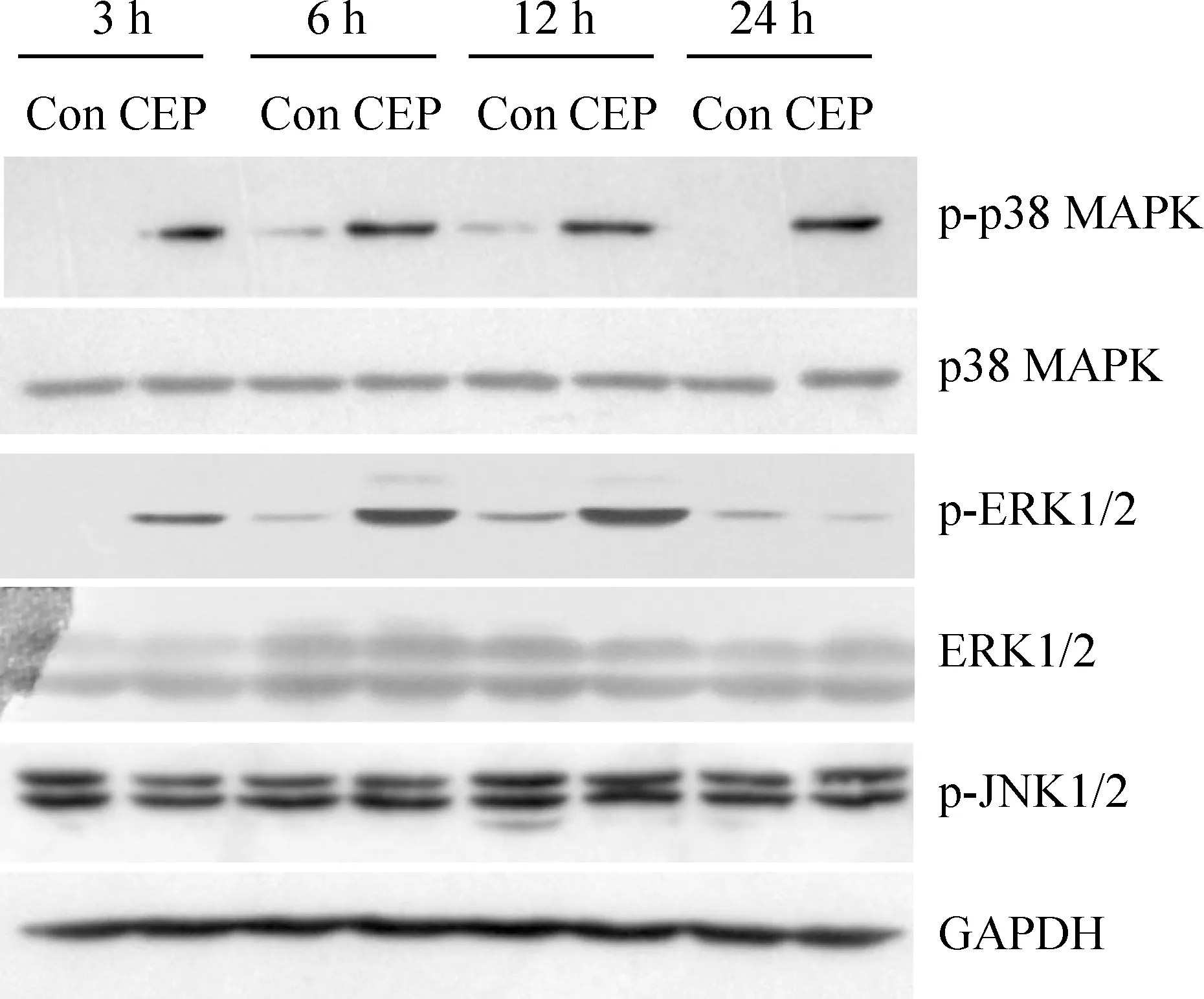
Figure 3. Effects of CEP on p38 MAPK, ERK1/2 and JNK1/2 activation. The cells were exposed to 10 μmol/L CEP for 3 h, 6 h, 12 h and 24 h. The phosphorylation levels of p38 MAPK, ERK1/2 and JNK1/2 were determined by Western blotting.Con:control.
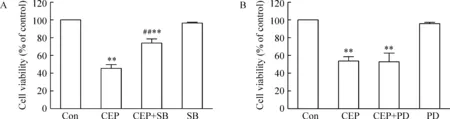
Figure 4. Effects of p38 MAPK inhibitor SB203580 (SB,10 μmol/L) (A) and ERK1/2 inhibitor PD98059 (PD,10 μmol/L) (B) on the apoptosis induced by CEP (10 μmol/L). ±sE. n=3. **Plt;0.01 vs Con group; ##Plt;0.01 vs CEP group.Con:control.
讨 论
本实验研究发现CEP孵育心肌细胞,可以剂量和时间依赖地降低心肌细胞活性。这一发现亦在肿瘤细胞Jurkat(人类T细胞白血病细胞系)、K562 (人类慢性髓性白血病细胞系)、HuH-7(人类肝细胞癌细胞系)等细胞观察到相同现象[3,4,7]。这种对细胞活性的抑制作用均是因为诱导了细胞的凋亡。凋亡是细胞常见的死亡方式之一,但因为存在“凋亡引起的继发性坏死”这一现象,而使凋亡和坏死变的不易区分。在本实验中, CEP孵育心肌细胞后,对细胞的形态进行观察,发现心肌细胞随着CEP孵育时间的延长逐步出现“皱缩”现象,并未出现“肿胀”等坏死所具有的特征(图2)。在此基础上,通过Hoechst核染色,观察到细胞核的碎裂,利用Western blotting亦观察到caspase-3的明显激活,上述结果提示细胞处于凋亡状态,而非坏死。但是这并不能排除凋亡引起的继发性坏死,因为继发性坏死也存在caspase-3的激活,要确定本实验中心肌细胞是否存在继发性坏死,有待于通过流式细胞分析术和透射电子显微镜等实验[8]进一步鉴定。
近几年关于CEP致细胞凋亡作用的信号转导研究主要集中在肿瘤领域。研究提示其作用机制主要涉及MAPKs家族的3个蛋白质分子:JNK1/2、ERK1/2、p38 MAPK[3,4,7]。那么CEP致心肌细胞凋亡的效应是否与MAPKs家族这3个信号分子相关,每个信号途径的作用是否存在差异呢?本实验研究发现,CEP作用下ERK1/2和p38 MAPK的磷酸化水平明显升高,提示CEP可能通过ERK1/2和p38 MAPK发挥重要的生物学效应。但是进一步实验发现,ERK1/2的抑制剂未能显著抑制CEP引起的心肌细胞活性下降,究竟CEP介导的ERK1/2的激活存在何种作用,有待进一步的实验证实。p38 MAPK的抑制剂明显减低了CEP诱导的心肌细胞活性下降,提示p38 MAPK在CEP诱导的心肌细胞凋亡中具有重要作用。研究表明CEP可以使细胞内活性氧簇(reactive oxygen species,ROS)水平显著升高[9],而ROS又可以激活p38 MAPK,由此我们推测CEP致心肌细胞凋亡可能经由ROS-p38 MAPK信号途径。JNK和p38 MAPK激活的通路基本上是一致的[10],但本实验中未检测到JNK的磷酸化变化,一方面,可能与JNK的激活窗口和模式有关,另一方面,可能与脚手架蛋白的作用有关[11,12],如JIP、SKRP1、β-arrestin-2等,它们的存在使CEP的信号转导有了相对特异性,这还有待进一步的实验验证。
目前,CEP主要被用于治疗因肿瘤化疗造成的白细胞减少症。CEP药物代谢动力学的研究表明[13],血浆内浓度为1-2 mg/L (1.35 μmol/L-2.70 μmol/L) 不会对人体产生任何副作用。但是本实验研究发现,3 μmol/L CEP即可显著抑制心肌细胞活性,所以提示我们使用CEP时需要注意CEP的潜在心脏毒副作用。总之,本研究为CEP的心肌细胞生物学效应提供了新的线索。
[1] 李 红,周东海,黄丽春,等. 千金藤素在家兔体内的药物动力学研究[J]. 工业卫生与职业病, 1997, 23(5): 313 -314.
[2] 肖 怀,刘光明,王 卓,等. 千金藤素片含量测定方法改进[J]. 中成药, 2005, 27 (3): 362 -364.
[3] Biswas KK, Tancharoen S, Sarker KP, et al. Cepharanthine triggers apoptosis in a human hepatocellular carcinoma cell line (HuH-7) through the activation of JNK1/2 and the downregulation of Akt[J]. FEBS Lett, 2006, 580(2): 703 -710.
[4] Wu J, Suzuki H, Zhou YW, et al. Cepharanthine activates caspases and induces apoptosis in Jurkat and K562 human leukemia cell lines[J]. J Cell Biochem, 2001, 82(2): 200 -214.
[5] Feng W, Song Y, Zhang Y, et al. Stimulation of adenosine A2Breceptors induces interleukin-6 secretion in cardiac fibroblasts via the PKC-δ-P38 signalling pathway[J]. Br J Pharmacol, 2010, 159(8): 1598 -1607.
[6] Liu X, Gai Y, Xu M, et al. Trimetazidine inhibits pressure overload-induced cardiac fibrosis through NADPH oxidase-ROS-CTGF pathway[J]. Cardiovasc Res, 2010, 88(1): 150 -158.
[7] Wu J, Suzuki H, Akhand AA, et al. Modes of activation of mitogen-activated protein kinases and their roles in cepharanthine-induced apoptosis in human leukemia cells[J]. Cell Signal, 2002, 14(6): 509 - 515.
[8] Krysko DV, Vanden-Berghe T, D’Herde K, et al. Apoptosis and necrosis: detection, discrimination and phagocytosis[J]. Methods, 2008, 44(3): 205 -221.
[9] Furusawa S, Wu J, Fujimura T, et al. Cepharanthine inhibits proliferation of cancer cells by inducing apoptosis[J]. Methods Find Exp Clin Pharmacol, 1998, 20(2): 87 -97.
[10]Muslin AJ. MAPK signalling in cardiovascular health and disease: molecular mechanisms and therapeutic targets[J]. Clin Sci (Lond), 2008, 115(7): 203 -218.
[11]Morrison DK, Davis RJ. Regulation of MAP kinase signaling modules by scaffold proteins in mammals[J]. Annu Rev Cell Dev Biol, 2003, 19: 91-118.
[12]Whitmarsh AJ. The JIP family of MAPK scaffold proteins [J]. Biochem Soc Trans, 2006, 34( 5): 828 -832.
[13]Furusawa S, Wu J. The effects of biscoclaurine alkaloid cepharanthine on mammalian cells: implications for cancer, shock, and inflammatory diseases[J]. Life Sci, 2007, 80(12): 1073-1079.
p38MAPKinvolvesincepharanthine-inducedapoptosisincardiomyocytes
LI Su-fang1, LIN Sen2, ZHANG You-yi1, YUAN Gu2, XU Ming1
(1InstituteofVascularMedicine,PekingUniversityThirdHospitalandKeyLaboratoryofMolecularCardiovascularSciences,MinistryofEducation,Beijing100191,China;2DepartmentofChemicalBiology,CollegeofChemistryandMolecularEngineering,PekingUniversity,BeijingNationalLaboratoryforMolecularSciences,KeyLaboratoryofBioorganicChemistryandMolecularEngineering,MinistryofEducation,Beijing100871,China.E-mail:xuminghi@bjmu.edu.cn)
AIM: To investigate the apoptotic effect of cepharanthine (CEP) on neonatal rat cardiomyocytes(NRCMs) and the underlying mechanisms.METHODSMTT assay was used to detect the viability of the cells. CEP-induced apoptosis in NRCMs was evaluated by Hoechst 33342 staining and the expression of activated caspase-3. The phosphorylation levels of mitogen-activated protein kinases (MAPKs),such as extracellular signal-regulated kinase (ERK), c-jun N-terminal kinase (JNK) and p38 MAPK,were examined by Western blotting. The specific inhibitors of ERK and p38 MAPK were applied for identifying the roles of the corresponding signal pathways in CEP-induced apoptosis of cardiomyocytes.RESULTSCEP inhibited the viability of NRCMs in a dose-and time-dependent manners. Positive nuclear fragmentation and activated caspase-3 were found in CEP-treated NRCMs. The phosphorylation levels of ERK and p38 MAPK were significantly elevated in CEP-treated NRCMs, but the change of JNK was not obvious. SB203580, an inhibitor of p38 MAPK, significantly alleviated the apoptotic effect induced by CEP. However, PD98059, an inhibitor of ERK1/2, did not significantly reduce the apoptotic effect.CONCLUSIONp38 MAPK is involved in CEP-induced apoptosis in NRCMs.
Cepharanthine; Cardiomyocytes; Apoptosis; Mitogen-activated protein kinases
1000-4718(2011)04-0638-05
R34
A
10.3969/j.issn.1000-4718.2011.04.003
2010-12-30
2011-02-25
国家自然科学基金资助项目(No.30821001;No.90913004;No.81070196); 北京市自然科学基金资助项目(No.7082101);教育部新世纪优秀人才和北京市优秀人才项目资助项目(No. BMU20100012)
△通讯作者 Tel:010-82265519;E-mail: xuminghi@bjmu.edu.cn
