改良CTAB法提取大戟属药用植物叶片总DNA试验
2011-11-18魏胜华孟娜
魏胜华 孟娜
摘要:由于大戟属(Euphorbia Linn)植物叶片中含大量的多糖、酚类等次生代谢物质,严重影响总DNA的提取,因此,以大戟属药用植物叶片为材料,对常用的CTAB(Hexadecyltrimethy ammonium bromide)法进行了改良,并通过琼脂凝胶电泳法对所提DNA样品进行了检测。结果表明,改良CTAB法提取的植物总DNA纯度很高,较适合提取大戟属植物的总DNA。
关键词:大戟属;药用植物;CTAB法;总DNA提取
中图分类号:Q949.753.5;Q503文献标识码:A文章编号:0439-8114(2011)16-3418-03
A Modified CTAB Method for Total DNA Extraction from the Medicinal Herb Leaves of Euphorbia Linn
WEI Sheng-hua,MENG Na
(College of Biology and Chemical Engineering, Anhui Polytechnic University,Wuhu 241000,Anhui, China)
Abstract: The cells in Euphorbia Linn leaves were rich in amylose and hydroxybenzene. These substances provided some seriously adverse effects on extraction of DNA from Euphorbia. Using the leaves of Euphorbia as material, the DNA were extracted by a modified CTAB(Hexadecyltrimethy ammonium bromide) method and detected by means of agarose gel electrophoresis. The results showed that the modified CTAB method was suitable for extraction of its DNA and it was a goodmethod for total DNA extraction from Euphorbia.
Key words: Euphorbia Linn; medicinal herb; hexadecyltrimethy ammonium bromide(CTAB) method; total DNA extraction
DNA的提取與纯化是进行分子标记试验最关键的一步,获得高质量的DNA样品是进行PCR扩增的首要步骤[1]。从植物材料中提取基因组DNA的质量受到多种因素的影响,在不同植物或同种植物不同时期组织中存在着不同数量的多糖、色素以及种类繁多的次生物质,特别是多糖、酚类在提取过程中可与DNA产生沉淀,形成包裹DNA的黏稠胶状物,其难以溶解或产生褐变,使得DNA提取质量较低,获得的DNA溶液常常黏度大乃至呈胶状,这些物质如果清除不净则会影响后续的试验研究[2-4]。大戟属(Euphorbia Linn)为大戟科(Euphorbiaceaec)植物中最大的一属,全世界有2 000余种[5],其中不少种具有很高的药用价值,李忠国[6]调查发现,安徽省琅琊山药用植物资源中有22种大戟科药用植物;李惠等[7]通过研究华东地区大戟属药用植物资源后,整理出了26种大戟属药用植物,并且药用部位明确,疗效确切,具有较高的药用价值。大戟属药用植物的医药价值使得其研究开发成为了热点,尤其是对大戟属药用植物在分子水平上的探讨方兴未艾。目前在大戟属药用植物进行分子标记试验中,由于本属植物具有白色或黄白色乳汁,含酚类、黄酮类等次生物质较多,若提取方法不当,不仅提取出来的DNA容易降解,而且会影响PCR扩增反应的稳定性和重复性。因此,如何高效简便地去除多糖、多酚等次生物质,对提取纯化大戟属植物DNA至关重要。目前,大戟属药用植物总DNA提取方法的研究在国内外尚未见报道,所以在前期研究的基础上[8,9],结合本属植物特点,以经典提取植物DNA的CTAB(十六烷基三乙基溴化铵,Hexadecyltrimethy ammonium bromide)法为基础[10],并加以改进,筛选出一种比较适合大戟属植物DNA提取的方法,为大戟属药用植物进一步开发利用提供技术支持。
1材料与方法
1.1材料
1.1.1供试材料试验所用植物材料为采自安徽省琅琊山的大戟(E. pekinensis Rupr.)、月腺大戟
(E. ebracteolata Hayata);采自芜湖市的乳浆大戟(E. esula L.)、斑地锦(E. supina Rafin)、地锦(E. humifusa Willd.)、一品红(E. pulcherrima Willd. et Klotzsch.),原植物均经安徽师范大学周守标教授鉴定。用于提取DNA的材料为各供试植物的新鲜叶片,采后迅速置于冰盒中,带回实验室后,除去主叶脉,在电子天平上精确称取0.5 g,于-20 ℃冰箱保存3 d。
1.1.2主要试剂①DNA抽提缓冲液,NaCl 500 mmol/L,Tris-HCl 100 mmol/L、pH值8.0和EDTA 20 mmol/L、pH值8.0。②DNA裂解缓冲液,NaCl 700 mmol/L, Tris-HCl 50 mmol/L、 pH值8.0和
EDTA 20 mmol/L、pH值8.0,CTAB 5%(m/V),β-巯基乙醇1%(用前加)[11]。③TE缓冲液,Tris-HCl 10 mmol/L、pH值8.0和EDTA 1 mmol/L、pH值8.0。④50×TAE缓冲液,Tris 242 g,冰乙酸57.1 mL,EDTA(0.5 mol/L、pH值8.0)100 mL。⑤氯仿-异戊醇混合液(体积比为24∶1,下同)。配制药品用的水均为双蒸馏水。将以上缓冲液分装后,密封、灭菌,置于冰箱4℃保存。
1.1.3主要仪器试验中的主要仪器有凝胶成像仪、微波炉、离心机、超低温冰箱、电泳槽、电泳仪、手掌型离心机、恒温水浴锅、电热恒温鼓风干燥箱、超净工作台等。
1.2方法
1.2.1改良CTAB法提取植物总DNA①提取前将裂解缓冲液放至65 ℃水浴中。②称取0.5 g植物材料,用液氮速冻后,迅速研磨成细粉,分装于1.5 mL的Eppendorf管中。③在Eppendorf管中加入1 mL DNA提取缓冲液,用力摇动使其充分混匀后,于15 ℃、8 000 g离心5 min。④静止后弃上清,再加入1 mL DNA提取缓冲液,充分混匀,于15 ℃、
8 000 g离心5 min。⑤静止后弃上清,加入1 mL 65 ℃预热的DNA提取缓冲液,悬浮沉淀,充分混匀,放入65 ℃水浴30 min。⑥于15 ℃、12 000 g离心5 min,取上清,加入等体积的氯仿-异戊醇混合液,轻轻颠倒混匀,静置10 min。⑦于15 ℃、12 000 g离心5 min,取上清,加入等体积的异丙醇,充分混匀,4 ℃静置30 min 。⑧于15 ℃、12 000 g离心10 min,静止后弃上清,加入75 %(V/V)乙醇洗数次。⑨于15 ℃、12 000 g离心3 min,静止后弃上清,自然风干直至无酒精味。⑩加入100 μL TE缓冲液,放入4 ℃环境待用,或-20 ℃储存。
1.2.2电泳检测对所提取的DNA取3~5 μL于0.8%的琼脂糖凝胶上,以5 V/cm电泳1 h左右,EB染色20~25 min,在凝胶成像系统(AlphaImager)中观察和拍照。
2结果与分析
2.1DNA电泳结果
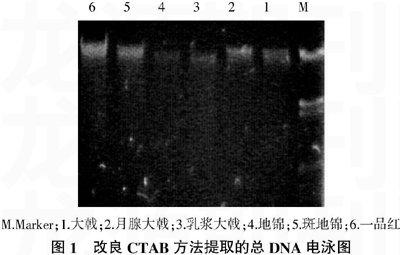
将叶片各部位提取的DNA进行琼脂糖凝胶电泳,检测结果见图1。DNA电泳结果显示,改良CTAB法所提取的大戟属植物叶片的DNA为一条清晰完整的条带,DNA片段大小较一致,条带后面没有明显的拖尾,证明所提叶片的总DNA含杂质较少。
2.2總DNA纯化
加入等体积的氯仿-异戊醇混合液,轻缓颠倒混匀,室温静置10~15 min;于12 000 g离心10 min;重复前面步骤。取上清液,加入终浓度0. 2~0. 4 mol/L的NaAc、12倍体积的无水乙醇,放置1 h。12 000 g离心10 min,弃上清液。用70 %乙醇洗涤沉淀2~3次,自然干燥后,溶于50~100 μL TE中,-20 ℃保存备用。
3讨论
虽然植物DNA的提取是一项常规的分子生物学实验技术,但由于大戟属植物组织细胞中含有大量的酚类、多糖及其他次生代谢产物,使得用传统的CTAB方法难以分离出高质量的DNA,如果提取方法选择不当,会干扰后续的操作。作者对大戟属植物叶片总DNA的提取过程经过反复的改进,最后提取出了质量较高的总DNA,并在提取中总结出以下操作事项,以期为大戟属药用植物的分子生物学研究提供技术支撑。
1)首先,用于DNA提取的植物材料是从远离实验室的野外采集获得,新鲜材料在旅途中容易枯萎、腐烂,特别是一些离体材料极易受到DNA酶的作用,导致DNA的降解。因此采集后必须迅速置于冰盒中,带回实验室。
2)植物材料在研磨时,一定要使材料处于低温状态,而且所用研钵应该是预先在-20 ℃冰箱冷冻过夜、待其彻底冷却后再放入植物材料。在研磨过程中,确保不要让液氮挥发干净,以防止植物材料回温,否则会造成DNA的严重降解;研磨叶片时,粉末研得越细越好,研磨好的材料非常容易变褐,宜迅速转入Eppendorf管中,不要使之融化,以免造成DNA的降解。
3)在提取DNA的过程中,所有的操作均需要动作轻柔,避免剧烈振动,以免DNA断裂降解。
4)在用氯仿-异戊醇混合液抽提时,离心温度应保持不低于15 ℃;若温度太低,可能导致CTAB沉淀,从而损失DNA;在离心前增加氯仿-异戊醇混合液和提取缓冲液的接触时间,让杂质更好地被分离,减少用氯仿-异戊醇混合液的抽提次数,避免操作过程中DNA的污染。
5)CTAB是一种阳离子去污剂,既能有效裂解植物的细胞壁,又能去除多糖类物质,还可以溶解细胞膜,较好去除多糖的干扰。在加入CTAB缓冲液进行温浴时,将时间延长至2 h能更好地处理多糖、酚类及其他杂质,所获得的DNA质量也将较高。
6)在提取过程中,采用常规CTAB法常出现多酚类物质的褐化现象,使DNA溶液颜色产生浑浊。β-巯基乙醇具有抗氧化作用,在改良CTAB法中,提取液中加入1% β-巯基乙醇可以有效地去除植物组织内的多糖物质和多酚类物质,防止酚类物质造成褐化现象。
7)PCR技术对DNA样品量和纯度的要求均不高,但因PCR具有很高的灵敏度,为防止试剂交叉污染,应尽量减少提取步骤;采用改良的CTAB法提取大戟属植物DNA,能够获得高质量的DNA样品。
8)在DNA提取过程中,用异丙醇沉淀时,若异丙醇未挥发尽,会直接影响Taq DNA聚合酶的活性,试验中应该让异丙醇沉淀离心后充分挥发。
9)在DNA提取过程中,氯仿是蛋白的有效沉淀剂,对Taq DNA聚合酶有变性作用。
10)DNA沉淀出现后,絮状沉淀不一定全是DNA沉淀,判断絮状沉淀的标准是看其是否易溶于TE,若易溶则说明其杂质含量较少,若难溶则说明其杂质含量较高,纯度较差。而TE溶解是一个比较缓慢的过程,为了充分溶解,通常在4℃条件下溶解1 d。
参考文献:
[1] 刘塔斯,林丽美,龚力民,等. 分子标记中植物DNA提取方法的研究进展[J]. 中南药学,2005,3(6):370-373.
[2] 黄晓丹,张云贵,应铁进. 高质量植物基因组DNA的提取[J]. 植物生理学通讯,2006,4(2):311-314.
[3] 周凤,张东旭,吕洪飞. 4种金丝桃属植物基因组DNA提取及RAPD分析[J]. 山西大同大学学报(自然科学版),2001,26(4):64-67.
[4] 桂腾琴,乔爱民,孙敏. 果梅基因组DNA提取方法的比较及ISSR分析[J]. 北方园艺, 2008(4):212-215.
[5] 钱啸虎. 安徽植物志(第三卷)[M]. 北京:中国展望出版社,1988.256-257.
[6] 李国忠. 安徽琅琊山药用植物资源调查[J]. 中草药,1997,28(8):495-499.
[7] 李惠,赵志礼,倪梁红. 华东地区大戟属药用植物资源调查研究[J]. 时珍国医国药, 2010,21(4):990-991.
[8] 蒋继宏, 孟娜, 曹小迎. 苏皖产大戟属药用植物rDNA的ITS序列分析[J]. 中草药, 2005,36(6):900-902.
[9] 孟娜,周守标,蒋继宏. 五种大戟属植物nrDNA的ITS序列分析及其叶的比较解剖学研究[J]. 广西植物,2006,26(1):18-21.
[10] AUSUBEL F M,BRENT R, KINGSTON R E, et al. 精编分子生物学实验指南[M]. 颜子颖,王海林,译. 北京:科学出版社, 2002. 37-38.
[11] 黄小英,刘瑛,赖小萍. 用CTAB法提取苎麻总DNA试验[J]. 江西农业学报,2001,13(4):40-42.
