一株犬细小病毒的分离及VP2基因序列分析
2011-11-16杨龙峰,李英杰,艾萍萍等
一株犬细小病毒的分离及VP2基因序列分析
杨龙峰①李英杰①艾萍萍①肖胜南①韩 柳②焦万亮①王建芬①张延光①刘月焕③*(①北京市延庆县农业局 102100 ②北京诚安动物医院 ③北京市农林科学院畜牧兽医研究所)
采集病犬的粪便,经处理后接种狗肾传代细胞系(MDCK),培养96h无任何细胞病变,盲传到第3代时细胞系出现明显的细胞脱落,核圆缩,形成CPE (cytopathic effect)。继续传代到第7代。第1、2代的细胞培养物不能凝集猪的红细胞,第3代以后的细胞培养物可以凝集猪的红细胞。采用PCR技术,在各代次的培养物中均能扩增得到特异性的DNA片断,经序列测定后鉴定为犬细小病毒,定名为BJY06。为进一步研究该分离株的遗传演化情况,扩增得到了VP2基因的全序列。经序列测定,用DANStar软件分析表明BJY06毒株为CPV-2a亚型,所得到的VP2基因全长1755bp,含有完整的阅读框架,编码584个氨基酸。与其它亚型的毒株相比较核苷酸的同源性为98.3%~99.6%。氨基酸同源性为97.1%~100%。
犬细小病毒 病毒分离 鉴定 PCR VP2 序列分析
1978年,犬细小病毒(canine parvovirus,CPV)同时从加拿大(Thomson等)、澳大利亚(Kelly)患肠炎的病犬中分离获得[1]。CPV可引起犬的出血性肠胃炎和心肌炎,并使白细胞大量减少,在幼犬中的发病率和死亡率都很高,症状与猫泛白细胞减少症相似。本病虽出现的时间不长,但目前已扩散到世界各地,几乎所有养犬的地方都有本病的存在[2]。1982年10月,我国报道在暴发传染性出血性腹泻的病犬的粪便提取物中发现细小病毒,随后,在我国各地陆续有本病发生的报道。
本试验从临床发病犬的粪便中分离到一株犬细小病毒,定名为BJY2006。对其VP2基因进行了扩增测序,初步确定为2a亚型。对该病毒的遗传特性与演化进行了研究,以期为更好地为预防和控制犬细小病毒病提供资料。同时为大范围的对CPV进行流行病学调查提供可行的方法。
1 材料和方法
1.1 材料
病料采自于北京市某动物医院的病犬。狗肾传代细胞(MDCK)购于中国兽医药品监察所。D-MEM营养液、UNIQ-10柱式病毒DNA抽提试剂盒、EZ-10 Spin Column DNA Gel Extration Kit 等购买于上海生物工程有限公司。犬细小病毒快速诊断试纸条购买于军事医学科学院实验动物中心。参考GeneBank中的已发表的CPV的VP2核酸序列,使用primer5.0软件设计了两对引物,由上海生物工程有限公司合成。
主要仪器 PCR仪(PTC-200)、CO2培养箱(SANYO)、高速冷冻离心机(SIGMA)。
1.2 方法
1.2.1 病毒分离培养 将病犬粪便用PBS缓冲液10倍稀释,再加1/5量的氯仿混和均匀,静置2min后4000rpm,离心10min,取上清,经0.22μm的微孔滤膜过滤,收取滤液-30℃保存。生长成单层的MDCK细胞消化,传代,37℃培养6h后,观察细胞贴壁完全,再加入1/20量的病料滤液,37℃继续培养,每天2次观察细胞病变。96h进行传代培养,共传7代。每代细胞培养96h收获,反复冻融3次,3000rpm,离心10min,收取上清-30℃保存。
1.2.2 HA试验和金标试纸条检测 取病料滤液、各代次的细胞培养物根据文献介绍的方法做HA试验[3]。根据金标试纸条使用说明书检测并记录结果。
1.2.3 病毒DNA的提取 根据UNIQ-10柱式病毒DNA抽提试剂盒说明书进行操作。
1.2.4 PCR扩增 反应体系为50μL,同时设立阴性、阳性对照。退火温度为55℃进行PCR反应,1.0%琼脂糖凝胶电泳,在显像仪中观察结果并拍照。
1.2.5 DNA的纯化 按照EZ-10 Spin Column DNA Gel Extration Kit 试剂盒的说明书进行,纯化的DNA送大连宝生物工程公司进行测序。
2 结果
(1)接种病料的MDCK细胞在传到第3代时出现明显的细胞病变,病变发生在接种后50h,表现为细胞圆缩、颗粒增多,胞核浓缩,脱落,拉网,病变逐日严重。对照细胞生长正常,表明细胞系中有病毒生长。
(2)粪便滤液、各代次培养物的HA、试验结果及PCR扩增结果如表1。

表1 不同方法检测CPV的结果
(3)PCR扩增及序列测定结果:使用引物F2,R2扩增到了小于500bp的DNA片断(图1),与预期的大小相符。经纯化后进行序列测定,碱基数为426bp,与GeneBank中的已发表序列比对同源性为100%。表明分离得到了犬细小病毒毒株。使用引物F1、R1扩增到了2000bp左右大小的DNA片段与预期大小相符(图2)。

图1 CPV特异性PCR结果
M.DNA Marker DGL2000; 1.BJY06 PCR扩增产物(426bp) 2.CPV疫苗株的PCR扩增产物(426bp)。3.阴性对照。

图2 CPV VP2基因PCR结果
M. DNA Marker DGL2000; 1.BJY06 PCR扩增产物(1955bp) 2. CPV疫苗株PCR阳对照(1955bp)。3.阴性对照。

表2 犬细小病毒VP2核酸和氨基酸变异位点比较
(4)序列测定结果:用引物F1、R2扩增的产物长度为1955个核苷酸,包含完整的VP2全基因,由1755个核苷酸组成,编码584个氨基酸。发生有意义突变的核苷酸及相应的氨基酸(表2)进行比较分析,BJY06分离株为CPV-2a亚型。
3 讨论
从本试验结果可以看出,同HA、金标试纸条检测方法相比较,PCR方法能检出更少量的CPV,即PCR方法更敏感,特异性更强。HA方法并不能准确检出CPV,HA阳性只能非特异地表明有病毒生长,灵敏度也不高,而且观察结果也带有较大主观性;金标试纸条方法特异性比HA方法好,但灵敏度也不高,只有在病毒含量达到一定浓度时,有效反应才能发生。相比较认为PCR方法可作为MDCK细胞中病毒繁殖的一种特异、敏感的检测方法。
本试验把PCR检测技术与病毒分离培养技术相结合,成功的对犬细小病毒进行了分离。PCR检测方法的高敏感性可以检测到在MDCK中生长的微量病毒,能够在MDCK细胞未发生明显病变前检测出CPV的存在,从而提高CPV分离的成功率。同时随着宠物疾病诊断条件的提高,PCR诊断方法在临床工作中的应用也将逐渐成为现实。
2005年邱薇等[4]对我国不同地区分离到的9株细小病毒毒株进行了VP2基因的扩增和序列分析,并与CPV的参考毒株进行了比较,依据图3所示的氨基酸的变化规律,进行了亚型鉴定,9株CPV中有6株属CPV-2a,3株属CPV-2b,未检测到CPV-2c变异株,表明我国目前仍以CPV-2a流行为主。本次试验分离到的毒株经序列比对也是CPV-2a亚型。该分型方法与使用单克隆抗体进行犬细小病毒亚型鉴定相比具有经济、方便的特点,国内外的研究者已逐渐认可并使用该分型方法。为今后进行大范围的CPV的流行病学调查提供了依据。
BJY06毒株的VP2基因序列进行遗传演化分析(图3)表明,BJY06与另2个中国分离株B-2004和CH-GN同在一个分支内,但亲缘关系最近的是日本株FPV-31、台湾株T37和中国株B-2004。中国2005年毒株CPV-GN虽然与BJY06仍有较近的进化关系,但为CPV-2b亚型。BJY06与其它亚型的毒株相比较核苷酸的同源性为98.3%~99.6%。与FPV~377的氨基酸同源性最低,为97.1%,与V129、V120、T4、T37、Taiwan 9的同源性最高,为100%。
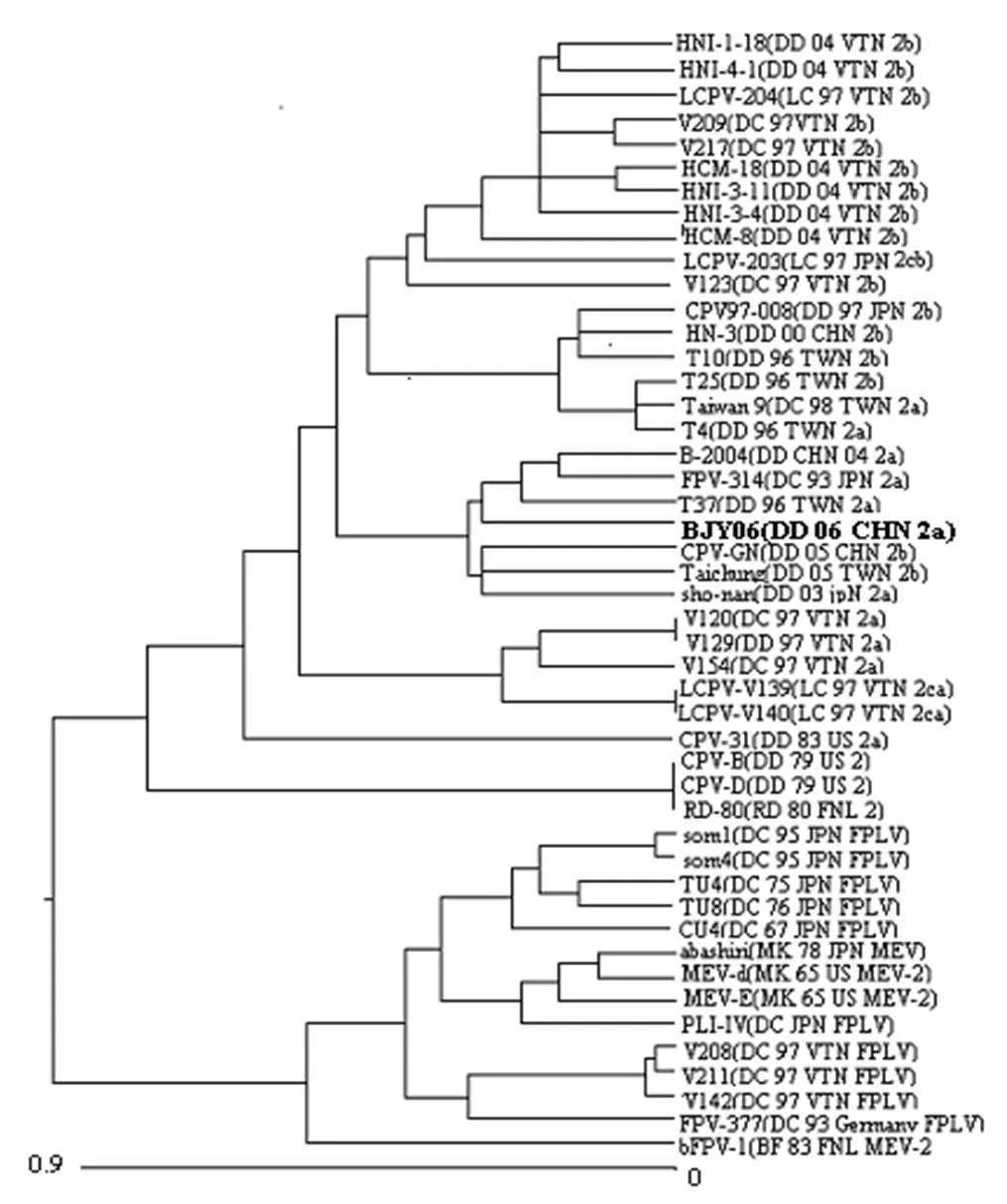
图3 .VP2基因遗传进化树DC, domestic cat; DD, domestic dog; MK, mink; BF, blue fox. JPN, Japan; TWN, Tai wan; CHN, China; VTN, Vietnam; FNL, Finland.
与其它的CPV-2a亚型毒株相比较,在遗传进化关系上与日本毒株sho-nan在同一个分支内,与V154的距离最远。核苷酸同源性在99.3%~99.6%。BJY06与CPV-31的氨基酸同源性最低为99.7%,与V129、V120、T4、T37、Taiwan 9的氨基酸同源性均为100%。表明在该亚型内的氨基酸变异很小,几乎是没有变化。在297和555位氨基酸美国株CPV-31为S(丝氨酸)和I(亮氨酸)而BJY06和其它的中国、日本毒株为A(丙氨酸)和V(缬氨酸)。这两个位点的不同究竟有何意义需要进一步研究。
[1]殷震,刘景华.动物病毒学: 第2版[M].北京:科学出版社,1997:1145-1173.
[2]董江丽,李淑芬,张鹤龄。犬细小病毒中国内蒙株VP2基因克隆及序列分析[J]。中国病毒学,2000,15(4):379-387.
[3]蔡宝样, 殷震. 动物传染病诊断学[M]. 南京: 江苏科学技术出版社, 1993: 418- 422.
[4]邱薇,范泉水,李作生.犬细小病毒VP2基因的比较及分型研究[J].动物医学进展,2005,26 (5):69-72。
[5]Ikeda Y, Mochizuki M, Naito R,Predominance of canine parvovirus in unvaccinated cat population and emergence of new types of CPVs in cats. Virology, 2000:278:13-19.
S852.65+5
A
1007-1733(2011)01-0006-03
(2010–10–27)
