AC-NP:一种具有利尿钠、舒血管作用的新型钠尿肽
2011-11-15张栋梁孙皆绅陈健康陈宝莹第四军医大学基础医学教学实验中心西安7003第四军医大学唐都医院放射科通讯作者mailyujunbyfmmueducn
张栋梁,孙皆绅,陈健康,铁 茹,曲 萍,陈宝莹 (第四军医大学基础医学教学实验中心,西安 7003;第四军医大学唐都医院放射科;通讯作者,E-mail:yujunby@fmmu.edu.cn)
NPs是一个结构相似但基因不同的肽类家族,包括ANP、BNP和CNP。它们在维持心血管和肾脏的稳态方面扮演着重要的角色[1]。ANP是一种由28个氨基酸构成的肽,而BNP含32个氨基酸,CNP含22个,它们都具有一个由17个氨基酸组成、对于药理作用所必需的环结构[2]。NPs的药理作用大多是通过与耦联有鸟苷酸环化酶微粒的钠尿肽受体(NPR-A或NPR-B)结合后,介导细胞内cGMP水平的升高实现的。ANP和BNP主要与NPR-A结合,而CNP则主要与NPR-B结合[3]。
与ANP和BNP相比,CNP缺少C末端,导致其在促尿钠排泄功能上的不足[4,5]。因此,尽管有扩张静脉上的优势,CNP在治疗伴有水钠潴留的疾病(如急性心衰)时还是受到了限制[5,6]。为了优化NPs的结构,我们采取的蛋白设计策略是:将一种肽类的独特有效结构与另一肽类的活性结构进行组合,合成一种同时具有两个亲代优势药理作用的嵌合体[7]。基于此策略,我们设计合成了由CNP的环结构和ANP的C-端、N-端所构成的新钠尿肽AC-NP,并对其药理活性进行评估。
1 材料和方法
1.1 材料 ANP、CNP、VNP和 AC-NP均由江南大学医药学院提供。NE(去甲肾上腺素)和ACh(乙酰胆碱)系美国Sigma公司产品。[125I]-cGMP放射免疫试剂盒购自上海中医药大学。
♂SD大鼠(体重250-350 g,6-8周龄)在室温为(23±1)℃、相对湿度为60%-70%的环境下饲养,每天6:00至18:00给予光照。整个实验阶段,大鼠在标准的实验室清洁环境中饲养,并给予自由饮食饮水。
1.2 方法
1.2.1 AC-NP的设计 将具有6个氨基酸的ANP的C末端、5个氨基酸的ANP的N末端整合到具有17个氨基酸的CNP环结构上,设计合成具有28个氨基酸的新型钠尿肽AC-NP。
1.2.2 腹主动脉环制备和舒血管活性测定 正常SD大鼠5只经腹腔注射40 mg/kg戊巴比妥钠麻醉后,剪取腹主动脉,置于盛有冷的Krebs液(mmol/L:115 NaCl,4.7 KCl,25 NaHCO3,1.2 MgCl2,1.2 KH2PO4,2.5 CaCl2,10 glucose;pH 7.4)中,去掉血管表面结缔组织,制备成3 mm长的血管环。其中一半血管环用浸有对照液的棉花拭子轻轻摩擦内皮表面以去除内皮。将血管环悬挂于盛有37℃ Krebs液的浴槽中,通入含95%O2和5%CO2的混合气体[8],连接张力传感器。重复给予 0.1 mol/L KCl,以每次100 mg递增直至找到最佳基础张力为500 mg,用于后面的药理学实验。经平衡30 min后,用ACh(10-6mol/L)对经过 NE(10-6mol/L)预收缩的血管环是否产生舒张效应判断血管内皮活性。然后反复冲洗使血管张力恢复至基线,稳定30 min后重复给予NE(10-6mol/L),使血管环收缩达稳定值(80%最大收缩幅度),分别逐渐增加ANP、CNP、VNP或 AC-NP的浓度(10-10-10-6mol/L),以制作累积浓度-舒张反应曲线,求出最大舒张反应值(Emax)。
1.2.3 在体心肾活性测定 实验大鼠分成5个组:ANP组、CNP组、VNP组、AC-NP组和生理盐水对照组,每组6只。腹腔注射40 mg/kg戊巴比妥钠麻醉后,按每小时1 ml/100 mg经左颈静脉输注0.9%NaCl溶液,手术完成后稳定30 min,接着给予15 min的基础期。之后,各组分别静脉推注0.1 ml NPs(ANP、CNP、VNP 或 AC-NP,50 μg/kg)或生理盐水,紧接着依次是15 min的给药期、30 min的清除期、15 min的恢复期。
在各个实验阶段,经左颈动脉插管,采用BL-420F生物信号采集系统(成都泰盟公司)记录平均动脉压(mCAP)。在基础期和给药期的中间时间点取血于EDTA管中,离心(4℃,2 500 r/min)并分离上层血清,在-20℃条件下保存直至用于cGMP的测定。整个基础期和给药期收集尿液并加热至90℃,保存直至用于尿量、尿钠、尿cGMP水平的分析。尿钠的测定采用塞曼原子吸收光谱分析法,血浆及尿cGMP水平通过前面提及的[125I]-cGMP检测试剂盒进行放射免疫测定[9]。
1.3 统计分析 采用SPSS13.0软件统计分析,结果以±s表示,组间比较采用单因素方差分析法(ANOVA),若存在差异,再用LSD法进行多组样本均数两两之间的比较。P<0.05表示有统计学差异。
2 结果
新合成AC-NP结构见图1所示,含有28个氨基酸,包括来自CNP的17个氨基酸组成的环结构和ANP的C末端及N末端。AC-NP和VNP都是ANP与CNP的嵌合体。从结构上看,ANP与CNP是AC-NP的“双亲”,而VNP和AC-NP则是“兄弟”关系。考虑到四者结构上的相似性,我们比较研究了AC-NP与ANP、CNP及VNP的药理活性。

图1 人ANP(h-ANP)、人CNP(h-CNP)、嵌合体 VNP及新型嵌合体AC-NP的氨基酸序列和结构Fig 1 Amino acid sequences and structures of human ANP(h-ANP),human CNP(h-CNP),chimeric VNP and novel chimeric AC-NP
2.1 离体腹主动脉舒血管活性 收缩反应曲线结果显示,在以10-6mol/L的NE预收缩后,AC-NP对腹主动脉环呈浓度依赖性的舒张作用,见图2A。AC-NP对去内皮和内皮完整的血管环作用相当(图2B),表明 AC-NP呈非内皮依赖性的舒张作用。ANP、CNP、VNP、AC-NP 对腹主动脉环的最大舒张作用(图2C)。相对于对照组,10-6mol/L的ANP、CNP、VNP、AC-NP均引起显著的舒血管作用,舒张效力为CNP>AC-NP>VNP>ANP,但差异无统计学意义。
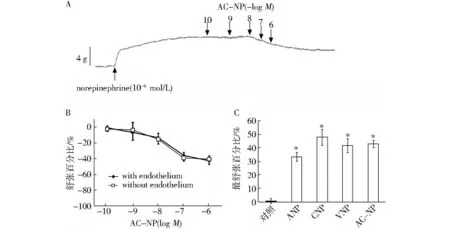
A.NE预收缩后,AC-NP对腹主动脉环的舒张作用;B.AC-NP对去内皮和内皮完整的血管环的舒张作用(数据表示为AC-NP在由浓度为10-6mol/L的NE引起最大收缩反应基础上所引起的舒张百分比);C.ANP、CNP、VNP、AC-NP对腹主动脉环的最大舒张作用。与对照组比较,*P<0.05
2.2 在体心肾活性 与离体实验相同,相对于生理盐水对照组,10-6mol/L 的 ANP、CNP、VNP、AC-NP均显著降低大鼠mCAP(P<0.05,n=6),其降低百分比依次为24%,15%,29%,44%,表明AC-NP具有潜在的降血压效应(图3)。

图3 AC-NP降低平均颈动脉压的作用Fig 3 Effect of AC-NP on mean carotid arterial pressure(mCAP)in rats
ANP、CNP、VNP、AC-NP 在正常大鼠的利尿利钠作用见表1。除了 CNP无明显作用外,ANP、VNP、AC-NP均显著增加尿量和尿钠排泄量(P<0.05,n=6),且 AC-NP 的作用最强,其利钠利尿效力为AC-NP>ANP>VNP>CNP。
表1 ANP、CNP、VNP及AC-NP对经静脉注射的大鼠尿量及尿钠排泄水平的影响(±s,n=6)Tab 1 Effects of intravenous injection of AC-NP,ANP,CNP and VNP on urine volume and urine Na volume in anesthetized rats(±s,n=6)
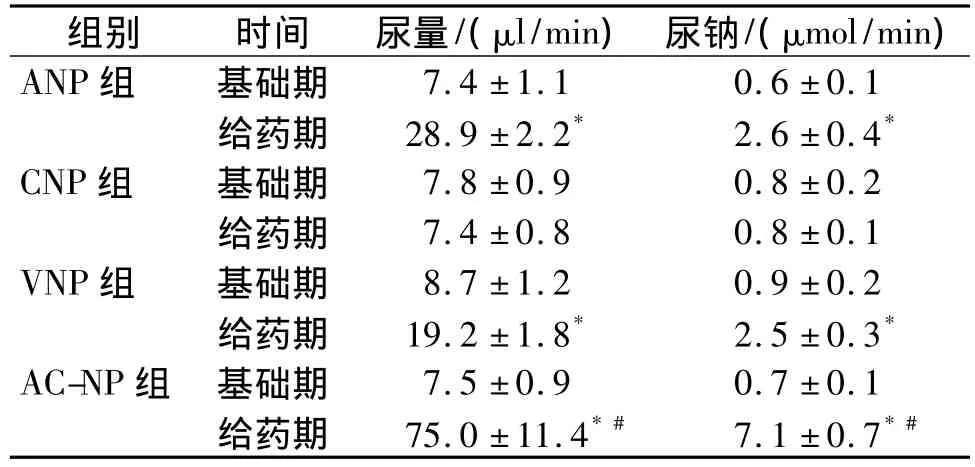
表1 ANP、CNP、VNP及AC-NP对经静脉注射的大鼠尿量及尿钠排泄水平的影响(±s,n=6)Tab 1 Effects of intravenous injection of AC-NP,ANP,CNP and VNP on urine volume and urine Na volume in anesthetized rats(±s,n=6)
与基础期比较,*P<0.05;与 ANP组、CNP组、VNP组比较,#P <0.05
组别 时间 尿量/(μl/min) 尿钠/(μmol/min)ANP组 基础期7.4 ±1.1 0.6 ±0.1给药期 28.9 ±2.2* 2.6 ±0.4*CNP组 基础期 7.8±0.9 0.8±0.2给药期 7.4 ±0.8 0.8 ±0.1 VNP组 基础期 8.7±1.2 0.9±0.2给药期 19.2 ±1.8* 2.5 ±0.3*AC-NP组 基础期 7.5±0.9 0.7±0.1给药期 75.0 ±11.4*# 7.1 ±0.7*#
NPRA/B/cGMP/PKG是钠尿肽家族参与对心血管及肾脏系统生物活性调节的传统信号传导通路[3]。因此,我们对钠尿肽给药前后大鼠尿液和血浆中cGMP的水平进行检测,结果见图4。与其他钠尿肽相比,AC-NP对血浆cGMP水平的升高作用最强。对于尿cGMP的水平,AC-NP的升高作用也明显强于 CNP、VNP(P<0.05,n=6)。

图4 ANP、CNP、VNP、AC-NP对血浆及尿cGMP水平的影响Fig 4 Responses of plasma cGMP levels(PcGMP)and urine cGMP excretion(UcGMP)to ANP,CNP,VNP and AC-NP
3 讨论
本研究首次报道了ANP和CNP的新型嵌合体AC-NP的心血管活性和肾活性。该新型钠尿肽包含CNP的17个氨基酸组成的环结构及ANP的C末端和N末端。实验证明,AC-NP为一强有力的舒血管肽,作用与ANP、CNP、VNP相当。特别的是,相对于先前报道的 CNP 缺乏明显的肾脏活性[5,6,10],AC-NP具有显著的利尿利钠作用,且效力比ANP、VNP更强,其利尿作用可促进降血压作用。AC-NP显著升高血浆及尿cGMP水平,且尿cGMP水平的升高作用比CNP、VNP更强。
199 3年,Wei等[11]将具有22个氨基酸的 CNP环结构与ANP的C末端组合,设计合成了一种新型钠尿肽嵌合体—VNP。其不仅具有CNP的扩张静脉和ANP的促尿钠排泄作用,还具有与两者无关的动脉血管舒张作用。此外,Lisy等[12]将DNP(dendroaspis natriuretic peptide)的C末端整合到CNP的结构中,得到一种新型钠尿肽-AD-NP。在体实验证明,AD-NP具有利尿利钠、提高肾小球滤过率、降低心脏负荷及抑制肾素的作用。然而,DNP是从树眼镜蛇体内提取分离出来的,其非人类来源可能对其在人体的安全带来潜在的危险。最近,Kilic等[13]报道了一种由CNP的环结构和利尿钠素(urodilatin,URO)的C末端、N末端嵌合而成、不具有血管舒张作用的钠尿肽分子-CU-NP。CU-NP对暴露于苯肾上腺素的新生大鼠心室肌细胞具有直接的抗肥大作用。URO含32个氨基酸,是表达于肾脏的ANP选择性拼接的产物[14]。受以往所报道的在合成钠尿肽嵌合体方面的研究工作所启发,我们设计合成了由CNP的环结构和ANP的C-端、N-端所构成的新钠尿肽AC-NP,并对其药理活性进行了评估。
从结构上看,ANP在环的C末端有氨基酸,而CNP在环的C末端没有延伸于环外的氨基酸。ACNP与VNP一样,均将ANP的C末端整合到CNP的环结构上,而两者在结构上的区别是:前者N末端来自ANP,后者的N末端则来自CNP(图1)。我们的研究(图4)和之前的研究[11]均证明,将ANP的C末端整合到CNP的环结构可获得利尿利钠功能。重要的是,在ANP末端和CNP环结构上设计出的AC-NP证明C末端和N末端都是钠尿肽生物活性的重要功能性结构。因此,与母体ANP、CNP相比,嵌合体 AC-NP、VNP[11]及最近报道的 AD-NP[12]、CU-NP[13]具有功能上的优势。以上表明,设计合成新型钠尿肽嵌合体,以优化钠尿肽结构对于钠尿肽的临床应用是可行的策略。
目前,我们只对AC-NP的心肾活性进行检测,而其作用机制还处于未知状态。鉴于cGMP是NPs/NPR/cGMP/PKG信号转导通路的经典第二信使[3],加上AC-NP具有提高血浆和尿cGMP水平的作用提示:cGMP参与了AC-NP的作用机制。由于ANP、BNP主要与NPR-A结合,而CNP则通过NPRB作用,作为ANP和CNP的嵌合体,AC-NP可能通过与NPR-A或NPR-B结合发挥药理作用。据报道[15],ANP和CNP的另一嵌合体VNP在肾小球和肾动脉通过NPR-A发挥药理作用。考虑到AC-NP与VNP的同源性,AC-NP更有可能通过NPR-A起作用。然而我们目前的研究未能排除NPR-B参与AC-NP的作用机制,这还有待于下一步研究证实。
综上所述,作为新型人工合成的钠尿肽,AC-NP在舒血管和利尿钠作用上的优势提示它也许能够在临床上治疗伴有水钠潴留的心血管和肾脏疾病中发挥作用。
[1] Boerrigter G,Costello-Boerrigter LC,Burnett JC Jr.Natriuretic peptides in the diagnosis and management of chronic heart failure[J].Heart Fail Clin,2009,5:501-514.
[2] Potter LR,Yoder AR,Flora DR,et al.Natriuretic peptides:their structures,receptors,physiologic functions and therapeutic applications[J].Handb Exp Pharmacol,2009,191:341-366.
[3] Duda T.Atrial natriuretic factor-receptor guanylate cyclase signal transduction mechanism[J].Mol Cell Biochem,2010,334:37-51.
[4] Hunt PJ,Richards AM,Espiner EA,et al.Bioactivity and metabolism of C-type natriuretic peptide in normal man[J].J Clin Endocrinol Metab,1994,78:1428-1435.
[5] La Villa G,Mannelli M,Lazzeri C,et al.Different effects of atrial and C-type natriuretic peptide on the urinary excretion of endothelin-1 in man[J].Clin Sci(Lond),1998,95:595-602.
[6] Igaki T,Itoh H,Suga SI,et al.Effects of intravenously administered C-type natriuretic peptide in humans:comparison with atrial natriuretic peptide[J].Hypertens Res,1998,21:7-13.
[7] Foran SE,Carr DB,Lipkowski AW,et al.A substance P-opioid chimeric peptide as a unique nontolerance-forming analgesic[J].Proc Natl Acad Sci USA,2000,97:7621-7626.
[8] Warshaw DM,Mulvany MJ,Halpern W.Mechanical and morphological properties of arterial resistance vessels in young and old spontaneously hypertensive rats[J].Circ Res,1979,45:250-259.
[9] Chen BY,Qu P,Tie R,et al.Protecting effects of vasonatrin peptide against carbon tetrachloride-induced liver fibrosis[J].Regul Pept,2010,164:139-143.
[10] Clavell AL,Stingo AJ,Wei CM,et al.C-type natriuretic peptide:a selective cardiovascular peptide[J].Am J Physiol,1993,264:R290-295.
[11] Wei CM,Kim CH,Miller VM,et al.Vasonatrin peptide:a unique synthetic natriuretic and vasorelaxing peptide[J].J Clin Invest,1993,92:2048-2052.
[12] Lisy O,Huntley BK,McCormick DJ,et al.Design,synthesis,and actions of a novel chimeric natriuretic peptide:CD-NP[J].J Am Coll Cardiol,2008,52:60-68.
[13] Kilic A,Rajapurohitam V,Sandberg SM,et al.A novel chimeric natriuretic peptide reduces cardiomyocyte hypertrophy through the NHE-1-calcineurin pathway[J].Cardiovasc Res,2010,88:434-442.
[14] Yandle TG.Biochemistry of natriuretic peptides[J].J Intern Med,1994,235:561-576.
[15] Woodard GE,Li X,Brown J,et al.Receptor subtypes for vasonatrin peptide in renal glomeruli and arteries[J].Regul Pept,2005,129:183-189.
