电刺激对废用状态下腓肠肌肌电及酶活性的影响
2011-11-15山西医科大学细胞生理学省部共建教育部重点实验室太原03000山西医科大学生理学系通讯作者mailvividmail63com
张 浩,杨 威 (山西医科大学细胞生理学省部共建教育部重点实验室,太原 03000;山西医科大学生理学系;通讯作者,E-mail:vividmail@63.com)
骨骼肌具有快速适应外界环境变化的特点,在较强机械力的作用下表现为相应的肥大,而在长期卧床、肢体制动及失重状态下则表现为相应的肌肉萎缩,即废用性肌肉萎缩[1]。这不仅会影响航天员在太空的飞行时间、工作效率以及航天员返回地面后的再适应能力,还会影响临床许多需要长期卧床或制动(如瘫痪、骨折等)患者的预后情况,因此探明废用性肌萎缩的发生机制,进而找出治疗和预防肌肉萎缩的有效措施,是航天医学、临床医学、运动医学及康复医学等领域亟待解决的一个重大课题。
功能性电刺激是一种安全、有效的治疗方式,主要利用电流的作用来防治骨骼肌萎缩。本研究将观察经皮电刺激对废用状态下肌肉的肌电及酶组织化学的影响,为更好地发挥功能性电刺激对废用性肌萎缩的防治作用提供实验依据。
1 材料和方法
1.1 动物分组和试剂 本实验采用健康活泼、无呼吸道感染、无运动障碍及无皮肤病的Sprague-Dawley品系雌性大鼠,体重250-260 g,由山西医科大学实验动物中心提供,许可证号SYXK(晋)2009-0004。按随机配对原则分为3组:下肢去负荷14 d组(Hu,n=5)、电刺激组(Hu+St,n=10)及正常同步对照组(Con,n=5)。ATP酶测试盒购自南京建成生物科技公司。
1.2 废用性肌萎缩模型的建立 采用大鼠尾部悬吊法,使大鼠下肢去负荷(hindlimbunloading,Hu),以建立废用性肌萎缩模型。大鼠单笼饲养,尾部悬吊,前肢着地,后肢悬空,身体长轴与水平面成30°角。大鼠在笼中可自由活动、进食和饮水。室温控制在25℃左右,12 h光照与黑暗循环交替。
1.3 观察指标及方法
1.3.1 经皮电刺激 在电刺激组大鼠下肢去负荷14 d内,用T90-Ⅱ电脑电刺激肌肉力量训练器给予大鼠左下肢皮肤电刺激。电刺激时,先将大鼠浅麻醉后俯卧位固定四肢,左下肢腓肠肌部位硫化钡脱毛,以双层生理盐水湿纱布包裹,将电极固定于皮肤表面,刺激频率2 Hz,刺激电压20-25 V,每次刺激时间15 min,上下午各1次。每次持续20 min。
1.3.2 肌电记录 给实验大鼠腹腔注射戊巴比妥钠麻醉(45 mg/kg),行常规气管插管和颈静脉插管术。暴露腓肠肌和坐骨神经。体温和下肢温度维持在(37±1)℃。持续监测动物心电。膝关节和踝关节角度大概90°。将双极银电极作为刺激电极置于坐骨神经上,刺激引发直接运动反应(M response)和反射(H reflex)。同心针电极作为记录电极刺入腓肠肌肌腹处记录肌电(EMG)。以波宽0.3 ms、逐级递增0.2 mA的一系列方波电流刺激坐骨神经,刺激间隔10 s。每个刺激强度重复测5次H反射和M波幅值(波峰至波谷的距离)。记录电极所引导的腓肠肌肌电变化经生物信号处理系统输入计算机(PowerLab/4SP,AD Instruments,Australia)进行分析处理。测量最大H反射和M反应的幅度值,计算二者之比(Hmax/Mmax)。
1.3.3 称量肌重 H反射记录结束后,迅速取出腓肠肌称量其湿重,为了消除大鼠体重不同所造成的影响,我们把所得数据以100 g体重标化,作为腓肠肌的湿重体重比,与正常对照组作显著性检验。
1.3.4 肌肉 Na+-K+-ATP酶及 Ca2+-ATP酶活性测定 腓肠肌称重后按比例加入9倍蒸馏水,在冰浴中剪碎后用XHF-I型高速分散器打成匀浆,取0.1 ml匀浆加入1.0 ml孵育液,于37℃恒温箱中保温15 min。Na+-K+-ATP酶孵育液的配制参考改良的Goldberg法[2]。Ca2+-ATP酶孵育液的配制参考改良的赵卫国法[3]。酶活性测定选用960型全自动酶标仪,改良Lowry法测定蛋白。ATP酶活力单位以每小时分解每毫克组织蛋白(pr)产生无机磷(pi)的微摩尔数来表示:即 μmol·pi/(mg·pr·h)。
2 结果
2.1 H反射 用脉冲电流刺激坐骨神经,当刺激强度达一定时,可发现1次电刺激可引导出2个动作电位,一个是大约经3 ms的潜伏期后出现的M波,另一个是经8-10 ms的潜伏期而出现的H波,系电流刺激了坐骨神经干中肌梭Ⅰa类传入纤维,冲动传至脊髓前角,兴奋α运动神经元产生的反射性肌肉收缩,即H反射。图1显示当刺激强度为0.2 mA,H反射和 M波均未出现;当刺激强度为1.4 mA,出现M波和H反射。
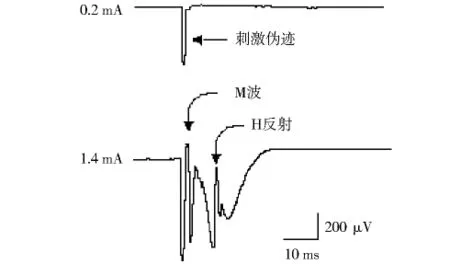
图1 电刺激坐骨神经后大鼠腓肠肌M波和H反射Fig 1 A typical example of M response and H reflex recorded from the gastrocnemius muscle evoked by stimuli to the sciatic nerve
下肢去负荷14 d后大鼠腓肠肌Mmax由正常对照组的(6.53 ±0.93)mV 减小到(4.63 ±0.52)mV,经统计学检验均有显著性差异(P<0.05)。下肢去负荷期间左侧后肢给予电刺激后,大鼠左侧腓肠肌Mmax与右侧腓肠肌相比显著增加(P<0.05),而与正常对照组相比没有统计学差异(P>0.05,见表1)。
下肢去负荷14 d后大鼠腓肠肌Hmax/Mmax由正常对照组的(22.4 ±8.6)%下降到(10.6 ±3.6)%,经统计学检验差异有统计学意义(P<0.05)。在下肢去负荷期间左侧肢体给予电刺激后,大鼠左侧腓肠肌Hmax/Mmax与右侧腓肠肌相比明显增加(P<0.05),而与正常对照组比较却没有统计学差异(P>0.05,见表1)。
2.2 肌肉湿重体重比 下肢去负荷14 d组大鼠腓肠肌平均湿重体重比正常对照组减少了37.1%,有统计学差异(P<0.05);在下肢去负荷期间左侧肢体给予电刺激后,大鼠左侧腓肠肌湿重体重比与正常对照组相比较仅减少了3.4%,差异没有统计学意义(P>0.05)。而大鼠右侧腓肠肌湿重体重比与正常对照组相比较减少了33%(P<0.05),左、右两侧腓肠肌有统计学差异(P<0.05,见表1)。
表1电刺激对废用状态下腓肠肌的湿重体重比及肌电的影响(±s,n=10)Tab 1Effects of electric stimulation on wet weight and myoelectricity of disused gastrocnemius muscle(±s,n=10)
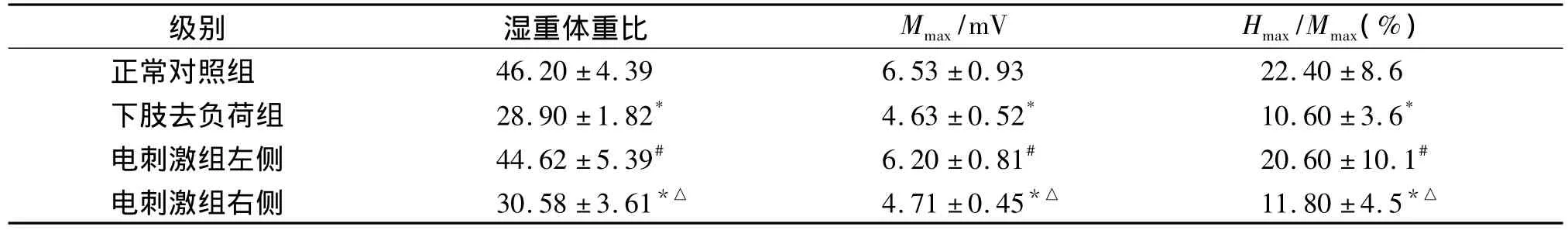
表1电刺激对废用状态下腓肠肌的湿重体重比及肌电的影响(±s,n=10)Tab 1Effects of electric stimulation on wet weight and myoelectricity of disused gastrocnemius muscle(±s,n=10)
与正常对照组比较,*P<0.05;与下肢去负荷组比较,#P<0.05;与电刺激组左侧比较,△P<0.05
级别 湿重体重比 Mmax/mV Hmax/Mmax(%)正常对照组46.20 ±4.39 6.53 ±0.93 22.40 ±8.6下肢去负荷组 28.90 ±1.82* 4.63 ±0.52* 10.60 ±3.6*电刺激组左侧 44.62 ±5.39# 6.20 ±0.81# 20.60 ±10.1#电刺激组右侧 30.58±3.61*△ 4.71±0.45*△ 11.80±4.5*△
2.3 肌肉 Na+-K+-ATP酶及 Ca2+-ATP酶活性变化 下肢去负荷14 d后,腓肠肌Na+-K+-ATP酶活性与正常对照组相比明显降低(P<0.05),在下肢去负荷期间左侧肢体给予电刺激后,腓肠肌Na+-K+-ATP酶活性与右侧肌肉相比明显增加(P<0.05),而与正常对照组相比没有统计学差异(P>0.05)。
下肢去负荷14 d后,腓肠肌Ca2+-ATP酶活性与正常对照组相比明显降低(P<0.05),在下肢去负荷期间左侧肢体给予电刺激后,腓肠肌Ca2+-ATP酶活性与右侧肌肉相比明显增加(P<0.05),而与正常对照组相比没有统计学差异(P>0.05,见图2)。

图2 电刺激对废用状态下腓肠肌Na+-K+-ATP酶及Ca2+-ATP酶活性的影响Fig 2 Effects of electric stimulation on Na+-K+-ATPase and Ca2+-ATPase activity of disused gastrocnemius muscle
3 讨论
大量的动物和人体实验表明,适宜的电刺激可有效地减轻肌肉萎缩,保持肌肉硬度。这表明神经冲动与肌肉萎缩之间似乎也存在着密切的关系。特异性的神经冲动有防止肌肉萎缩的作用[4-6]。本研究结果又进一步提示,经皮低频电刺激对废用肌肉的肌重、肌电、Na+-K+-ATP酶及Ca2+-ATP酶活性都具有较好的保护作用。
Na+-K+-ATP酶和Ca2+-ATP酶是广泛分布在机体内的生物膜酶系统,它们对维持细胞的正常生理功能起着极其重要的作用。众所周知,肌肉中肌球蛋白Ca2+-ATP酶在肌浆钙离子的凋节下,通过肌球蛋白与肌动蛋白的结合/分离而发挥催化活性,使ATP分解,为肌肉收缩提供能量,是控制肌肉收缩性能的主导因素[7]。Na+-K+-ATP酶具有载体和酶活性,维持着细胞膜两侧的膜电位、调节细胞渗透压,也在肌肉细胞的神经冲动传导等方面起着重要的作用。研究表明,当肌肉长期废用时,可使肌浆网Ca2+-ATP酶活性降低,Ca2+转运功能被抑制,导致线粒体Ca2+含量增加,产生钙超载,从而破坏细胞内Ca2+稳态,进一步影响肌肉的收缩特性[8]。另有研究表明,肌肉废用可以降低骨骼肌Na+-K+-ATP酶的活性。如石膏固定后,小鼠下肢肌肉的Na+-K+-ATP酶浓度减少了大约20%-30%[9]。在本研究中,大鼠下肢去负荷14 d后,反映肌肉细胞活力的Na+-K+-ATP酶及Ca2+-ATP酶活性均明显降低,而废用期间给予低频电刺激可有效对抗肌肉Na+-K+-ATP酶及Ca2+-ATP酶活性的降低,提示电刺激对肌肉神经传导和收缩力均具有保护作用。
本研究结果表明,废用期间给予电刺激对肌肉Mmax变化有明显的对抗作用。M波是电刺激直接兴奋α运动神经元轴突所产生的肌电反应,与神经-肌肉接头和骨骼肌纤维的功能状态密切相关[10]。研究表明,废用后肌肉会发生一系列变化,主要表现为:肌纤维横截面积减小,肌重减轻,肌球蛋白重链的表型发生转变和肌纤维的超微结构改变等[11,12],而电刺激则可以有效对抗废用肌肉的这些变化[13,14]。因此电刺激对Mmax变化的对抗作用可能是由于对抗了肌纤维结构或能量代谢(如Na+-K+-ATP酶及Ca2+-ATP酶活性等)的改变。
H反射是一种由肌梭Ia类传入纤维兴奋所引发的单突触脊髓反射。常可通过测量H反射来检测肌肉运动神经元的反射兴奋性[15,16]。废用状态下,本体感受器的传入减少,支配骨骼肌特别是抗重力肌中高氧化活性肌纤维的小型α运动神经元的氧化酶活性降低[17-19],使脊髓运动神经元的兴奋性降低。本研究结果表明,下肢去负荷后腓肠肌Hmax/Mmax明显减小。而给予电刺激后,与正常对照组相比Hmax/Mmax没有明显变化,说明电刺激可对抗废用状态下肌肉H反射的降低,其机制可能是电刺激使外周感觉传入增多,进而使脊髓前角运动神经元的活动增加,改善运动神经元的反射兴奋性。
[1] Machael K.Relationship of skeletal muscle atrophy to functional status:a systematic research review[J].Biol Res Nurs,2002,2(2):117-131.
[2] Goldberg WJ,Watson BD,Busto R,et al.Concurrent measurement of Na+-K+-ATPase activity and lipid peroxide in rat brain following reversible global ischemia[J].Neurochem Res,1984,9(12):1737-1742.
[3] 赵卫国,张天锡.急性缺血性脑水肿的实验研究酶活性的变化[J].中华外科杂志,1990,6(增刊):17-19.
[4] Salmons S,Ashley Z,Sutherland H,et al.Functional electrical stimulation of denervated muscles:basic issues[J].Artif Organs,2005,29(3):199-202.
[5] Dow DE,Dennis RG,Faulkner JA.Electrical stimulation attenuates denervation and age related atrophy in extensor digitorum longus muscles of old rats[J].J Gerontol A Biol Sci Med Sci,2005,60(4):416-424.
[6] Katada A,Nonaka S,Adachi M,et al.Functional electrical stimulation of laryngeal adductor muscle restores mobility of vocal fold and improves voice sounds in cats with unilateral laryngeal paralysis[J].Neurosci Res,2004,50(2):153-159.
[7] 臧广悦.Na+-K+-ATP酶与运动和人体健康[J].沈阳体育学院学报,2006,25(4):59-62.
[8] Green HJ,Barr DJ,Fowles JR,et al.Malleability of human skeletal muscle Na+-K+-ATPase pump with short-term training[J].J Appl Physiol,2004,97(1):143-148.
[9] 黄丽英,翁锡全,林文凯,等.间歇低氧训练对抗氧化酶系统及其适应能力的影响[J].广州体育学院学报,2007,27(2):111-115.
[10] Zehr PE.Considerations for use of the Hoffmann reflex in exercise studies[J].Eur J Appl Physiol,2002,86(6):455-468.
[11] Takahash M,Hood DA.Chronic stimulation-induced changes in mitochondria and performance in rat skeletal muscle[J].J Appl Physiol,1993,74(2):934-941.
[12] Papakonstantinou KC,Kamin E,Terzis JK.Muscle preservation by prolonged sensory protection[J].J Reconstr Microsurg,2002,18(3):173-182.
[13] Picquet F,Falempin M.Compared effects of hindlimb unloading versus terrestrial deafferentation on muscular properties of the rat soleus[J].Exp Neurol,2003,182(1):186-194.
[14] Yu SM,Chen SF,Lau YT,et al.Mechanism of extracellular ATP-induced proliferation of vascular smooth muscle cells[J].Mol Pharmacol,1996,53(2):346-350.
[15] Gozariu M,Roth V,Keime F,et al.An electrophysiological investigation into the monosynaptic H-reflex in the rat[J].Brain Res,1998,782:343-347.
[16] De-Doncker L,Kasri M,Falempin M.Soleus motoneuron excitability after rat hindlimb unloading using histology and a new electrophysiological approach to record a neurographic analogue of the H-reflex[J].Exp Neurol,2006,201(2):368-374.
[17] Kawano F,Ishihara A,Stevens JL,et al.Tension-and afferent input-associated responses of neuromuscular system of rats to hindlimb unloading and/or tenotomy[J].Am J Physiol Regul Integr Comp Physiol,2004,287(1):76-86.
[18] Ishihara A,Ohira Y,Roy RR,et al.Comparison of the response of motoneurons innervating perineal and hind limb muscles to spaceflight and recovery[J].Muscle Nerve,2000,23(5):753-762.
[19] Ishihara A,Ohira Y,Roy RR,et al.Succinate dehydrogenase activity in rat dorsolateral ventral horn motoneurons at L6 after space flight and recovery[J].J Grav Physiol,2002,9(2):39-48.
