曲古菌素A对胃癌耐药细胞SGC-7901/ADR的作用
2011-11-15杨晓丹孙红坤西安交通大学医学院第一附属医院消化科西安710061
杨晓丹,王 丹,孙红坤,唐 青,乔 文 (西安交通大学医学院第一附属医院消化科,西安 710061;
*通讯作者,E-mail:qiaowen1202@126.com)
胃癌(gastric carcinoma)是最常见的恶性肿瘤之一,死亡率居消化道肿瘤的首位。目前胃癌的治疗主要有手术治疗和化学药物治疗,由于部分患者确诊时已失去手术治疗机会,化疗就成为治疗胃癌的主要方法。目前临床上综合化疗缓解率较低,大多数学者认为多药耐药是其治疗效果差的主要原因。肿瘤多药耐药可分为原发性多药耐药和获得性多药耐药。胃癌多药耐药的机制与多种因素相关,研究较多的是P-gp高表达的药物泵作用,它可促使药物外排,降低细胞内药物浓度;细胞解毒系统如GST-π能力增强,灭活药物增多。阿霉素是常用的抗胃癌药物,解决阿霉素的耐药可以提高胃癌的缓解率。曲古菌素A(trichostatin A,TSA)是组蛋白去乙酰基酶抑制剂,来源于链霉素菌属的抗真菌抗生素,能够抑制哺乳动物的组蛋白去乙酰基酶,诱导肿瘤细胞分化和凋亡,抑制肿瘤细胞增殖。已有相关文献表明TSA可以抑制多种肿瘤细胞的生长、促进细胞凋亡。本文旨在研究TSA对人胃癌SGC-7901/ADR细胞的逆转作用,为胃癌的临床治疗提供理论基础。
1 材料和方法
1.1 材料
1.1.1 主要试剂的配制 TSA药液的配制:TSA购自Sigma公司,500 μg TSA溶解于1 ml二甲基亚砜后,再用不含血清DMEM培养液32 ml稀释至50 μmol/L储备液,过滤除菌后-20℃冷藏备用。实验前用不含血清的DMEM培养液稀释TSA储备液至50,100,200,300,400,500 nmol/L 不同浓度的工作液。空白对照组为0 nmol/L。
阿霉素配制:将10 mg阿霉素用50 ml生理盐水溶解后,滤器过滤除菌,配成0.25 mg/ml储备液分装置于-20℃冰箱备用。
1.1.2 人胃癌SGC-7901/ADR细胞 人胃癌SGC-7901/ADR细胞由第四军医大学消化内科实验室惠赠,常规复苏、传代和培养。
1.2 方法
1.2.1 MTT比色法测定胃癌细胞增殖 将5×104个/ml的SGC-7901/ADR细胞悬液接种于96孔细胞培养板内,每孔100 μl,同时加入阿霉素,工作液浓度为0.5 μg/ml,使细胞维持耐药性。37 ℃,含5%CO2的培养箱内培养,待细胞贴壁后,分为7组,依次为空白对照组(0 nmol/L TSA),50,100,200,300,400,500 nmol/L TSA作用组,每组5个复孔。依次作用24,48,72,96 h后,每孔加入新鲜配制的5 mg/ml的MTT储存液20 μl。继续孵育4 h后,弃去培养液,每孔加入150 μl二甲基亚砜(DMSO)。震荡5-10 min后,490 nm酶标测定仪测定吸光度(A)值。生长抑制率=(对照孔A490-实验孔A490)/对照孔A490×100%。
1.2.2 流式细胞术检测胃癌细胞凋亡 将5×106个/ml的SGC-7901/ADR细胞悬液,吹打均匀后接种于6孔细胞培养板内,每孔2 ml,同时加入阿霉素,工作液浓度为 0.5 μg/ml,置于37 ℃,含5%CO2的培养箱内培养。待细胞贴壁后,分为4组,依次为空白对照组(0 nmol/L TSA),100,200,300 nmol/L TSA,每组3个复孔,继续培养48 h后,用0.25%的胰酶消化后制成单细胞悬液,1 500 r/min离心10 min,弃去上清。用PBS重悬细胞,1 500 r/min离心10 min,弃去上清。重复1次后,各离心管中加入500 μl 1 × Binding Buffer,充分混匀,再依次加入 5 μl Annexin Ⅴ-FITC,10 μl PI,充分混匀,室温下避光反应15 min后,流式细胞仪观察,激发波长488 nm,分析软件CellQuest计算凋亡率。
2 结果
2.1 TSA对人胃癌细胞SGC-7901/ADR生长的影响
2.1.1 TSA作用前细胞的生长状态 在光学显微镜下人胃癌SGC-7901/AD R细胞呈长梭形,细胞之间接触紧密,细胞质透亮,细胞核圆形,可见分裂期细胞象(图1)。
图1 光学显微镜下TSA干预前人胃癌SGC-7901/ADR细胞 (×20)Fig 1 The morphology of drug-resistant stomach carcinoma cell line SGC-7901/ADR under light microscopy(×20)
2.1.2 TSA作用后人胃癌SGC-7901/ADR细胞的生长状态 不同浓度TSA作用于人胃癌SGC-7901/ADR细胞后,细胞生长受到抑制,呈剂量依赖性。96 h内动态观察发现,TSA低浓度组中细胞贴壁生长较多,随着药物浓度增加细胞脱落明显增加,至高浓度组,大多数细胞脱落,细胞界限不清,胞质内颗粒增多,培养液中有连接成片或者单个细胞漂浮在表面,培养板底可见碎渣样物质;SGC-7901/ADR细胞呈不规则形伸展(图2)。

图2 光学显微镜下500 nmol/L TSA干预96 h后人胃癌SGC-7901/ADR细胞 (×20)Fig 2 The morphology of drug-resistant stomach carcinoma cell line SGC-7901/ADR after intervened by 500 nmol/L TSA for 96 h(×20)
2.1.3 TSA对人胃癌SGC-7901/ADR细胞生长的作用 采用MTT比色法检测人胃癌SGC-7901/ADR细胞在TSA各作用组中的生长情况,490 nm酶标测定仪来测定吸光度(A)值。根据吸光度值分别计算24,48,72 h和96 h不同浓度TSA对 SGC-7901/ADR胃癌细胞的生长作用(见表1)。
表1TSA对胃癌细胞SGC-7901/ADR生长抑制率的影响(±s,%)Tab 1The inhibitive rate of SGC-7901/ADR cell growth after intervened by TSA(±s,%)
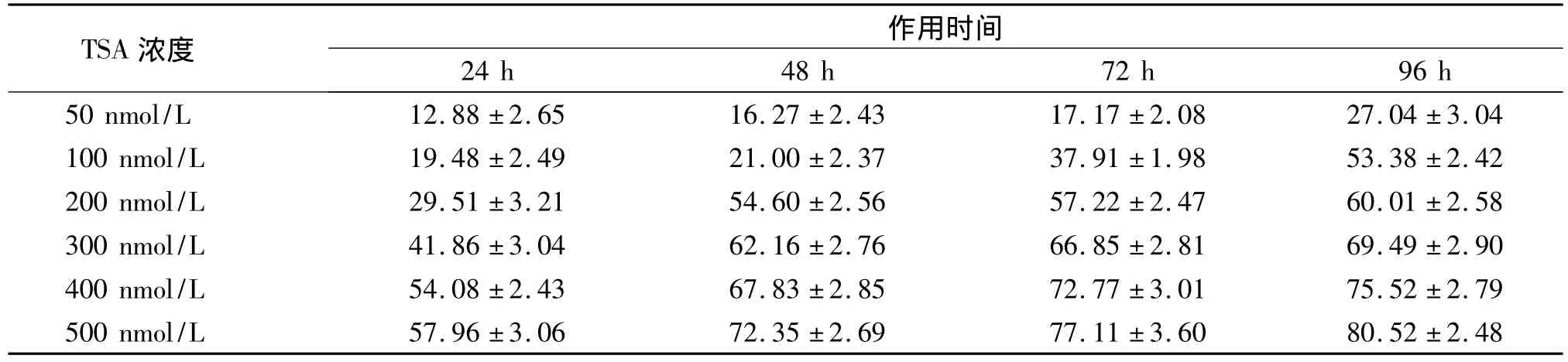
表1TSA对胃癌细胞SGC-7901/ADR生长抑制率的影响(±s,%)Tab 1The inhibitive rate of SGC-7901/ADR cell growth after intervened by TSA(±s,%)
相同时间点不同浓度TSA组间比较,均P<0.05
TSA浓度作用时间24 h 48 h 72 h 96 h 50 nmol/L 12.88 ±2.65 16.27 ±2.43 17.17 ±2.08 27.04 ±3.04 100 nmol/L 19.48 ±2.49 21.00 ±2.37 37.91 ±1.98 53.38 ±2.42 200 nmol/L 29.51 ±3.21 54.60 ±2.56 57.22 ±2.47 60.01 ±2.58 300 nmol/L 41.86 ±3.04 62.16 ±2.76 66.85 ±2.81 69.49 ±2.90 400 nmol/L 54.08 ±2.43 67.83 ±2.85 72.77 ±3.01 75.52 ±2.79 500 nmol/L 57.96 ±3.06 72.35 ±2.69 77.11 ±3.6080.52 ±2.48
2.2 TSA对人胃癌SGC-7901/ADR细胞凋亡的影响 采用流式细胞仪法,不同浓度的TSA作用人胃癌SGC-7901/ADR细胞48 h后,发现细胞的凋亡率呈剂量依赖性,与空白对照组比较各处理组均有显著性差异(P<0.05,表2,图3)。
表2 TSA作用人胃癌SGC-7901/ADR细胞48h后的凋亡率(±s)Tab 2 The apoptotic rate of SGC-7901/ADR cells after intervened by TSA for 48 h(±s)

表2 TSA作用人胃癌SGC-7901/ADR细胞48h后的凋亡率(±s)Tab 2 The apoptotic rate of SGC-7901/ADR cells after intervened by TSA for 48 h(±s)
不同浓度TSA组两两比较,均P<0.05
TSA浓度 凋亡率/%0 nmol/L 5.41 ±0.96 100 nmol/L 21.74 ±1.41 200 nmol/L 51.62 ±1.48 300 nmol/L 85.84 ±1.52
3 讨论
胃癌是常见的消化道恶性肿瘤,对人的健康和生命造成了极大的威胁,胃癌在不同性别、不同年龄、不同国家或地区的发病均有很大的差异[1]。胃癌的治疗以手术和化疗为主,因为大多数患者就诊时胃癌的发展多处于中晚期,失去了手术治疗的最佳时期,化疗则成为中晚期胃癌的主要治疗方法。目前临床上联合化疗的疗效较差,有效率仅有30%-50%,完全缓解率仅为10%左右。本文旨在研究曲古菌素A(trichostatin A,TSA)对人胃癌耐药细胞SGC-7901/ADR的逆转作用,探讨TSA能否作为新一代抗肿瘤药物用于治疗那些对多种化疗药物耐药的肿瘤,为胃癌的临床治疗提供理论基础,这也是本文的创新之处。
目前大多数研究认为胃癌的多药耐药(multidrug resistance,MDR)是化疗缓解率低的主要原因[2]。多种因素参与了肿瘤的多药耐药[3],目前研究的主要有:①P170糖蛋白(P-gp)高表达;②多药耐药相关蛋白(MRP);③肺耐药相关蛋白(LRP)高表达;④酶类系统改变;⑤DNA损伤修复能力改变;⑥抑制凋亡,凋亡途径异常;⑦肿瘤细胞特定生化特征的改变;⑧信号转导通路异常改变;⑨细胞外环境改变;⑩其他相关因素等。逆转肿瘤的多药耐药对临床上化疗效果的提高有重要意义,多药耐药逆转剂的研究已经较为深入。MDR逆转方法以药物逆转和基因逆转为主。目前大多数逆转剂是针对P-gp设计的,主要通过下调P-gp表达,抑制MDR1基因的表达来达到逆转肿瘤的多药耐药。
组蛋白去乙酰基酶抑制剂(histone deacetylase inhibitor,HDACI)在细胞的生长、分化、凋亡、DNA的修复和细胞之间的相互作用等方面起重要作用[4-7]。HDACI有多种作用,除了应用于肿瘤的治疗,对其他非恶性疾病的治疗亦有明显效果。其药理作用主要有:抗肿瘤作用;免疫调节作用;抗炎作用;抗原虫、真菌、病毒作用;对心血管的作用;对神经系统的作用等。而其抗肿瘤作用在目前研究最多,主要通过抑制细胞周期、促进细胞分化;促进细胞凋亡;抑制血管生成三种机制发挥其抗肿瘤作用。研究发现HDACI与抗肿瘤药物联合应用可逆转肿瘤细胞对抗肿瘤药物的多药耐药性,提高化疗效果。HDACI对耐药细胞没有交叉耐药性可能是其逆转耐药,可用这一特点来逆转肿瘤的多药耐药性。
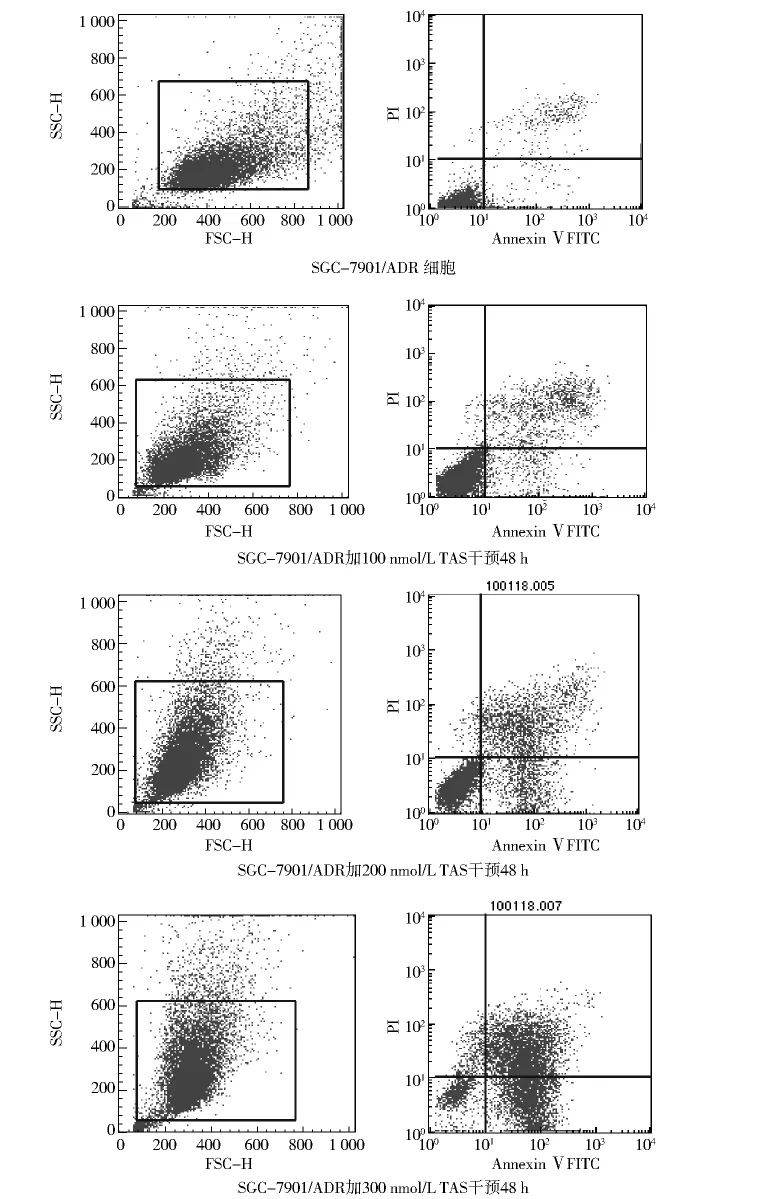
图3 不同浓度TSA作用SGC-7901/ADR细胞48 h细胞凋亡情况Fig 3 The apoptosis of SGC-7901/ADR cells after intervened by TSA for 48 h
曲古菌素A(trichostatin A,TSA)是组蛋白去乙酰基酶(histone deacetylase,HDAC)抑制剂的典型代表[8-13],属于氧肟酸类,是来源于链霉素菌属的抗真菌抗生素,能够抑制哺乳动物的组蛋白去乙酰基酶,使组蛋白乙酰化,抑制肿瘤细胞增殖,诱导肿瘤细胞分化和凋亡,是一种新型、高效的抗肿瘤药物。Suzuki等[14]发现TSA能够抑制胃癌和口腔癌细胞的增殖。吴智群等[15-17]用 Western blot、基因芯片、实时PCR方法检测TSA对胃癌SGC-7901细胞周期相关基因表达发现TSA可上调p53、p21、p27等基因的表达,下调CDK2、CCND1等基因的表达,表明TSA可通过调控细胞周期相关基因的表达,使细胞周期阻滞,抑制胃癌细胞的生长。本实验研究结果与文献报道相一致,TSA对胃癌多药耐药细胞除具有生长抑制作用外,还有促进细胞凋亡的作用。这种结果的形成可能是通过调节细胞周期和增加细胞内阿霉素浓度实现的。
综上所述,曲古菌素 A通过抑制胃癌 SGC-7901/ADR细胞生长和促凋亡作用来逆转多药耐药,可望作为新一代的抗肿瘤药物,用于治疗多次化疗效果不佳,存在多药耐药现象的患者。其作用机制还需进一步研究。
[1] 孙秀娣,牧人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2004,26(1):4-9.
[2] 郝淑兰,刘丽坤,李宜放.胃癌细胞多药耐药机制及耐药性逆转[J].肿瘤研究与临床,2007,19(1):68-72.
[3] El-Osta A,Kantharidis P,Zalcberg JR,et al.Precipitous release of methyl-CpG binding protein 2 and histone deacetylase 1 from the methylated human multidrug resistance gene(MDR1)on activation[J].Mol Cell Biol,2002,22(6):1844-1857.
[4] Chavan AV,Somani RR.HDAC inhibitors-new generation of target specific treatment[J].Mini Rev Med Chem,2010,10(13):1263-1276.
[5] Suzuki T,Miyata N.Non-hydroxamate histone deacetylase inhibitors[J].Curr Med Chem,2005,12(24):2867-2880.
[6] Monneret C.Histone deacetylase inhibitors[J].Eur J Med Chem,2005,40(1):1-13.
[7] Kim H,Kim SN,Park YS,et al.HDAC inhibitors downregulate MRP2 expression in multidrug resistant cancer cells:implication for chemosensitization[J].Int J Oncol,2011,38(3):807-812.
[8] Dowdy SC,Jiang S,Zhou XC,et al.Histone deacetylase inhibitors and paclitaxel cause synergistic effects on apoptosis and microtubule stabilization in papillary serous endometrial cancer cells[J].Mol Cancer Ther,2006,5(11):2767-2776.
[9] Zou XM,Li YL,Wang H,et al.Gastric cancer cell lines induced by trichostatin A[J].World J Gastroenterol,2008,14(30):4810-4815.
[10] 杨艳娜,王艳,王星光,等.曲古抑菌素A和紫杉醇对子宫内膜癌Ark2细胞凋亡和线粒体膜电位的影响[J]?癌症,2008,27(8):816-821.
[11] 姜淑娟,张嵩,牟晓燕,等.曲古抑菌素A和紫杉醇对子宫内膜癌细胞凋亡和微管稳定性的影响[J].中华医学杂志,2008,88(34):2427-2431.
[12] Park H,Lee YJ,Kim TH,et al.Myung CS.Effects of trichostatin A,a histone deacetylase inhibitor,on the regulation of apoptosis in H-ras-transformed breast epithelial cells[J].Int J Mol Med,2008,22(5):605-611.
[13] Tamannai M,Farhangi S,Truss M,et al.The inhibitor of growth 1(ING1)is involved in trichostatin A-induced apoptosis and caspase 3 signaling in p53-deficient glioblastoma cells[J].Oncol Res,2010,18(10):469-480.
[14] Suzuki T,Yokozaki H,Kuniyasu H,et al.Effect of trichostatin A on cell growth and expression of cell cycle and apoptosis-related molecules in human gastric and oral carcinoma cell lines[J].Int J Cancer,2000,88(6):992-997.
[15] 吴智群,张远强.TSA对人胃癌细胞 SGC-7901基因表达的影响[J].现代肿瘤医学,2007,15(4):502-505.
[16] 吴智群,张瑞,张远强.曲古抑菌素A诱导胃癌细胞细胞周期阻滞及其机制[J].中国现代医学杂志,2008,18(12):1660-1662.
[17] 李亚洲,宫卫东,张瑞,等.组蛋白去乙酰化酶抑制剂诱导人胃癌细胞 SGC-7901凋亡及其机制[J].介入放射学杂志,2010,19(3):220-223.
