原子力显微镜在食品组分研究中的应用进展
2011-11-14张丽芬刘东红叶兴乾
张丽芬,刘东红,叶兴乾
(浙江大学生物系统工程与食品科学学院,浙江杭州310229)
原子力显微镜在食品组分研究中的应用进展
张丽芬,刘东红*,叶兴乾
(浙江大学生物系统工程与食品科学学院,浙江杭州310229)
原子力显微镜因其分辨率高,样品预处理简单且可在空气和水溶液环境中连续成像等诸多优点,而被广泛应用于食品科学研究领域。本文就原子力显微镜在食品主要组分中的研究进行了综述,旨在为原子力显微镜在食品科学研究领域的应用和发展提供参考。
原子力显微镜,食品,组分,应用
原子力显微镜(AFM)是20世纪80年代中期由Binning等人在扫描隧道显微镜(STM)的基础上发展起来的一种具有原子级高分辨率的新型显微工具,其利用细微的探针感知针尖端和样品表面原子之间的相互作用力,通过原子力的变化反映样品表面的起伏变化[1]。原子力显微镜与普通显微镜相比,具有以下优势:高分辨率,能够观察从微米到纳米范围的微观结构,观察范围覆盖了从光学显微镜到电子显微镜所能观察的领域,且有很高的垂直方向的分辨率(0.1nm);原子力显微镜观察时几乎不用对样品进行预处理,使样品保持在天然或接近天然状态,可分析导体、半导体及绝缘体;样品可在空气和水溶液环境中连续成像,无需在真空条件下操作;由于原子力显微镜的针尖可以是不参与电化学反应的非导体,所以它对反应过程无扰动,可以得到更准确的数据和信息。原子力显微镜因其上述优势目前已被广泛应用于材料科学、生物科学、化工、食品和医药研究等领域。本文综述了原子力显微镜在食品主要组分中的应用研究。
1 原子力显微镜工作原理、工作模式及特点
1.1 原子力显微镜工作原理
原子力显微镜由扫描探头、电子控制系统、计算机控制及软件系统、步进电机和自动逼近控制电路四部分构成。原子力显微镜与传统的显微镜不同,其工作原理非常类似于盲人在读盲文时,用手指来感受表面起伏,是对样品表面的一种感知。
原子力显微镜使用一端固定而另一端装有针尖的弹性微悬臂作为力传感器。当针尖在样品上扫描时,针尖和样品间的作用力会引起微悬臂的形变,后者导致反射激光束在检测器中的位置发生改变,检测器中不同象限间所接收到的激光强度差代表悬臂形变量的大小,在反馈电路的作用下,样品表面起伏引起的微悬臂形变通过压电管对Z方向的伸缩进行补偿,计算机采集每个坐标点对应的反馈输出值,再转化为灰度级,在显示屏上表示出样品的表面形貌[2]。原子力显微镜的基本工作原理如图1所示。
1.2 原子力显微镜工作模式及特点
根据探针与样品之间的力-距离关系可将原子力显微镜的工作模式分为三大类型:接触模式(contact mode)、非接触模式(non-contact mode)和轻敲模式(tapping mode)。
1.2.1 接触模式 接触模式又称DC模式,在这种模式中,针尖与样品始终相互接触,扫描过程中,由于样品表面的高低起伏使得针尖与样品之间的作用力发生变化,从而使悬臂梁形变发生改变。这种方式由于针尖对样品的直接作用力容易使样品发生变形,导致成像效果不好。
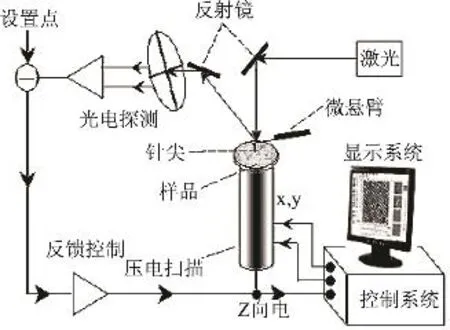
图1 原子力显微镜工作示意图
1.2.2 非接触模式 非接触模式又称AC模式,针尖在样品表面的上方振动,始终不与样品表面接触,悬臂以略高于其共振频率的某一频率振荡,其振幅一般为几纳米(<10nm),在这种模式中,由于针尖距样品较远,与样品表面的相互作用较小,因此对样品造成破坏或发生移动的可能性较小,适用于研究疏水性液体表面,但同时由于针尖距样品较远的原因,导致以此模式工作的原子力显微镜图象横向分辨率降低,此种工作模式的扫描速率较低,工作效率不高。
1.2.3 轻敲模式 轻敲模式是一种介于接触式与非接触式之间的工作模式,克服了非接触式扫描造成的显微像分辨率较低的缺点,这种模式扫描时,悬臂梁上下振动,使固定其上的针尖周期性地点触样品表面,有效降低了接触模式中针尖与样品表面的摩擦力,减小了对样品表面的破坏程度,适合于较软的食品和生物样品,由于是半接触式,其成像分辨率和工作效率都高于非接触式。
2 原子力显微镜在食品组分研究中的应用
食品中的蛋白质、糖类、脂质是食品的典型营养组分,具有独特的化学与物理性质以及营养功能,在食品生产加工过程中,这些组分的变化,会影响到食品体系色泽、风味、营养、质构和安全等,随着人们对食品品质要求的提高,目前,从组分的微观结构上探索其对食品品质的影响越来越引起研究者的重视。
2.1 原子力显微镜在蛋白质研究中的应用
蛋白是食品中的结构和营养物质之一,1993年,原子力显微镜作为一种先进的工具首次应用于食品中蛋白质的检测[3]。原子力显微镜可用以分析蛋白质单体,Schneider等利用原子力显微镜研究了蛋白质单体的分子量和蛋白质体积之间的关系,蛋白质分子量随着蛋白质体积的增加而增加,两者之间具有很好的相关性(相关系数0.994);利用原子力显微镜所测蛋白质体积可与所评估的蛋白质体积进行很好的比较,测量所达到的分辨率取决于蛋白质与云母表面接触的牢固程度[4]。原子力显微镜可对蛋白质单体进行三维成像并测量其分子体积,这种方法可以检测多体蛋白中蛋白单体的数目,并可在分子水平上研究蛋白单体。Hallet等利用原子力显微镜首次在溶液状态下研究了肌球蛋白和肌联蛋白的结构,使原子力显微镜在溶液状态下测量分子之间的相互作用成为可能[5]。Wang等利用原子力显微镜研究了类胡萝卜素含量高低对玉米蛋白结构的影响以及氯乙酸和油酸对玉米蛋白自组装结构的影响。结果显示:低类胡萝卜素含量玉米蛋白有球形(直径约为20nm)、棒状(约为170nm)和分支形状(约为200nm);高类胡萝卜素含量玉米蛋白只有球形(直径约为20~200nm);低类胡萝卜素含量玉米蛋白添加氯乙酸和油酸后形成两种类型的表面[6]。
当蛋白质聚集形成网状结构时即形成凝胶,因此,蛋白质聚集在凝胶过程中起着重要作用。原子力显微镜因分辨率高而成为研究蛋白质聚集体的一种强有力的工具,可用于蛋白质颗粒和聚集体的成像。Tay等利用原子力显微镜研究了大豆蛋白的聚集和凝胶过程,以更好地了解豆腐的质地特性,原子力显微镜检测了11S、7S和2S蛋白质的聚合过程,结果显示:聚集速率11S>2S>7S,2S蛋白虽然在大豆蛋白质中含量最少,但是在聚集过程中起了关键作用。Tay等接着研究了大豆蛋白中2S片段结构与功能的关系,阐明了2S大豆蛋白和其他蛋白质片段的功能和结构特性[7-8]。原子力显微镜不仅可直接对单个分子和聚集体成像,也可用于生物聚集体之间相互作用的研究。Roesch等利用原子力显微镜研究了角叉胶和乳球蛋白体系所形成的多糖-蛋白凝胶,原子力显微镜结果显示:天然蛋白质的高度在2~6nm之间,蛋白质会影响角叉胶的聚集;在固体接触条件下研究混合物凝胶则可观察到相分离;样品的表面形貌研究显示角叉胶和乳球蛋白之间缺少相互作用[9]。
近年来,研究者还利用原子力显微镜对蛋白膜的表面形貌及特性进行研究。Shi等利用原子力显微镜研究了玉米蛋白膜的表面形貌,结果显示:玉米蛋白膜浇注乙酸后要比浇注乙醇溶液后表面更加光滑[10]。Wang等利用原子力显微镜研究了玉米蛋白吸附于亲水和疏水表面后玉米蛋白层的形貌,提出玉米蛋白膜的表面特性取决于其所吸附的表面,在亲水性表面,其粗糙度值要高且具有明显环形结构,在疏水性表面,玉米蛋白膜表面没有明显特征[11]。
原子力显微镜除应用于研究蛋白质结构及蛋白凝胶等外,还可应用于对蛋白质和表面活性剂以及不同蛋白质之间在界面处相互作用的研究。Gunning等利用原子力显微镜研究了表面活性剂的类型对空气/水界面表面活性剂-蛋白质交互作用的影响,破坏蛋白质网络结构的表面压力的大小取决于表面活性剂的性质,离子型表面活性剂所需的表面压力要大于非离子型表面活性剂,离子型表面活性剂和蛋白质之间的相互作用改变了蛋白质网络结构的力学特性[12]。Morris等利用原子力显微镜研究了空气/水和油/水界面分子之间的交互作用[13]。原子力显微镜也可用于蛋白质吸附于表面后对蛋白质结构的测定,Touhami等利用原子力显微镜观察了在不同pH条件下β-乳球蛋白吸附于云母表面后结构和形貌的改变,结果表明:在不同pH条件下,原子力显微镜探针可以拉伸和展开吸附的β-乳球蛋白分子,在中性和酸性条件下,β-乳球蛋白分子维持了其固有的构造,在碱性条件下,原子力显微镜探针和吸附蛋白层之间巨大的静电排斥力与β-乳球蛋白分子的变形状态相一致。原子力显微镜在探测单个分子在不同条件下结构的改变上是一种强有力的工具[14]。
蛋白质广泛应用于各种食品中,它不仅具有提高营养价值的功能,而且具有改善各种食品品质、质构的功效。原子力显微镜已应用于对蛋白质结构的分析,将其应用于对蛋白质物理和化学性质的分析是今后的一个研究方向。
2.2 原子力显微镜在多糖研究中的应用
原子力显微镜在多糖方面的研究比较多。果胶是与食品特性密切相关的一种多糖,但由于果胶结构的不均一性,很难研究其结构,原子力显微镜因其高分辨率,则可直接观察单个果胶分子和聚集体,并可表征果胶分子的不均一结构。Yang等对气调贮藏条件下黄桃中果胶微观结构的变化进行了一系列研究,系统地分析了果实中水溶性果胶、螯合性果胶和碱溶性果胶片段,并利用原子力显微镜得出了黄桃中这些果胶片段定性和定量方面的结构特征,果胶作为细胞壁的主要成分,其分子结构与果实的硬度等密切相关,气调贮藏可以延长果实的贮藏期,并可抑制这些果胶的降解[15-16]。接着,Zhang等利用原子力显微镜研究了冷藏条件下两种硬质桃中碱溶性果胶微观结构与其质地的关系,结果显示:果实硬度与其碱溶性果胶含量和纳米结构密切相关[17]。Zhang等还利用原子力显微镜研究了不同成熟度和品种对樱桃果实细胞壁中碱溶性果胶结构的影响,提出不同品种不同成熟度樱桃果实细胞壁中碱溶性果胶含量与结构的差异是导致其质地特性差异的重要原因[18]。Fishman等利用原子力显微镜研究微波辅助萃取甜菜渣果胶的结构并同时与柑桔果胶结构进行了比较,原子力显微镜结果揭示甜菜渣果胶是线性单片段和球状颗粒结合成的网状结构,且其比柑桔果胶含有更多的球状颗粒结构[19]。
近年来,多数研究都集中在原子力显微镜对食品原料中多糖的测定上。淀粉是一种重要的食品成分并被广泛应用于食品工业。An等利用原子力显微镜研究了微波加热对淀粉分子纳米结构的影响,通过对淀粉分子定性和定量分析,结果显示微波加热与对流加热相比会引起淀粉的不完全凝胶;加热模式对土豆淀粉的影响要比玉米淀粉大[20]。Sujka等利用原子力显微镜观察了经α-淀粉酶水解后土豆和玉米淀粉颗粒表面,结果显示:天然的土豆和玉米淀粉颗粒是由直径为20~40nm的颗粒组成的复杂表面,这些颗粒排列成较大的聚集物且在玉米淀粉中的排列更加规律;淀粉颗粒表面具有含凹陷和孔隙(玉米淀粉颗粒)的脊状结构,α-淀粉酶水解导致碳水化合物链缩短和表面粗糙度增加,使得组成表面的颗粒更加明显[21]。
原子力显微镜在多糖凝胶体系的研究上具有其独特的优点,可直接观察未染色的生物聚集体,提供成像物体在高度上的定量参数,且在轻敲模式下观察时不会破坏软样品。Fishman等利用原子力显微镜研究了高甲氧基糖酸凝胶(HMSAG),得到了凝胶高度和相移的图像,这些凝胶中的孔会随着时间的作用而流动且变平坦;他们首次提出水化天然凝胶中糖吸附于果胶上的结构以及这些凝胶内果胶的结构框架[22]。Ptaszek等利用原子力显微镜研究了玉米淀粉亲水性凝胶体系的结构,结果显示:在20℃时,瓜尔豆胶溶液和玉米淀粉凝胶体系呈同质性,所有浓度下所观察的凝胶体系的结构一致;只在玉米淀粉-瓜尔豆胶混合物中观察到了化合物之间的不相容现象,提高亲水胶体的浓度将会使化合物之间的不相容性增加[23]。
食品亲水胶体领域进展的一个巨大推动力是生物技术和发酵技术的发展,这两种技术的发展使微生物多糖成为了食品胶体领域的新成员,微生物多糖与传统的材料像淀粉和果胶在特性上并不完全相同[24]。Ikeda等利用原子力显微镜研究了阳离子对微生物多糖-结冷胶网络结构的影响,结果显示:添加四甲基盐后,结冷胶具有分支的棒状结构;添加KCl、CsCl和CaCl2后会促进螺旋间的聚集。Ikeda等同时研究了另一种微生物多糖-热凝胶,热凝胶在溶液中呈纤丝状,当加热时则形成交联的微凝胶体,对这些微凝胶体的成像表明:加热诱导凝胶形成的初始阶段微纤丝中单链部分解离,接着通过疏水相互作用形成交联微纤丝[25-26]。
原子力显微镜还可用以操纵多糖分子,大多数食品大分子具有缠绕结构,单个线性分子的聚合和缠绕将会导致对分子的潜在特性观测不清晰,分子操纵可直接观察食品大分子之间的反应。操纵和展宽单个食品分子有益于大分子间的交互作用和链长的测定。Yang等利用分子梳和流体固定技术操纵并展宽了单个果胶分子,将果胶分子固定于云母片表面,利用原子力显微镜在空气中测量,通过分子梳和流体固定技术排列和伸展。结果显示:与流体固定技术相比,分子梳技术在分子操纵方面更加有效;通过分子梳效应螯合性果胶可被伸展为向同一方向伸展的线性,碱溶性果胶显示V形结构,作者还指出不同的果胶具有不同的变化结果[27]。
2.3 原子力显微镜在脂质研究中的应用
原子力显微镜可直接在液体介质中观察碰撞颗粒,原子力显微镜探针和液滴之间的力曲线可以研究单个液滴的力学特性,从力曲线所得的表面张力和液滴大小的倒数可以判断乳液的稳定性。Wackerbarth等利用原子力显微镜记录涂有酪蛋白和果胶的单个油滴的力曲线,通过力曲线和横向膨胀反映油滴的形变,提出力体积成像可用于探测油滴的力学特性的横向分布[28]。通过原子力显微镜力-距离测量可得到脂质晶体结构和力学特性之间的关系。
Patino等利用原子力显微镜研究了二棕榈酰磷脂酰胆碱和二油酰磷脂酰胆碱在水-空气界面处的结构特性,布如斯特角显微镜(BAM)和原子力显微镜分别从微观水平和纳米水平上观察了磷脂膜单分子层的结构特征,两者虽然原理不同,但是所得单分子层的结构相似且相互补充,并验证了在空气-水界面二棕榈酰磷脂酰胆碱结构的多态性,原子力显微镜结果显示了磷脂单分子层在纳米水平上具有不均一性结构,提出磷脂单分子层的结构、形貌等对烃链和溶液的pH较敏感。原子力显微镜在检测支持物、平坦基质纳米水平上的表面信息方面是一种强有力的工具,并可以直接提供结构高度和形貌方面的信息[29]。
3 总结及展望
原子力显微镜作为一种强有力的纳米研究工具已被应用于食品领域。原子力显微镜可在纳米水平上研究食品分子结构和分子之间的交互作用;可定性和定量分析分子结构、分子的交互作用以及操纵分子。利用原子力显微镜研究食品组分是当前和今后的一个研究热点。原子力显微镜应用于食品组分研究具有自己的优缺点和特殊应用,如原子力显微镜针尖容易污染或损坏,成像结果会受针尖的形状和尺寸等因素的影响,扫描面积小等,但随着研究的不断进展,新的成像方式和制样方法的不断改进,将使原子力显微镜技术日趋成熟。原子力显微镜作为一种先进的技术,可与其它技术相结合应用于食品品质的研究。
[1]Binnig G,Quate C F,Gerber C H.Atomic Force Microscope[J].Physical Review Letters,1986,56(9):930-933.
[2]白春礼.来自微观世界的新概念[M].北京:清华大学出版社,2000:35-36.
[3]Yang H S,Wang Y F,Lai S J,et al.Application of atomic force mciroscopy as a nanotechnology tool in food science[J]. Journal of Food Science,2007,72(4):65-75.
[4]Schneider S W,Larmer J,Henderson R M,et al.Molecular weights of individual proteins correlate with molecular volumes measured by atomic force microscope[J].Pflügers Archiv European Journal of Physiology,1998,435:362-367.
[5]Hallet P C,Tskhovrebova L,Trinick J,et al.Improvements in atomic force microscopy protocols for imaging fibrous proteins[J].Journal of Vacuum Science Technology B,1996,14:1444 -1448.
[6]Wang Q,Yin L L,Padua G W.Effect of Hydrophilic and Lipophilic Compoundson Zein Microstructures[J].Food Biophysics,2008(3):174-181.
[7]Tay S L,Xu G Q,Perera C O.Aggregation profile of 11S,7S and 2S coagulated with GDL[J].Food Chemistry,2005,91:457-462.
[8]Tay S L,Kasapis S,Perera C O,et al.Functional and structural properties of 2S soy protein in relation to other molecular protein fractions[J].Journal of Agriculture and Food Chemistry,2006,54:6046-6053.
[9]Roesch R,Cox S,Compton S,et al.k-Carrageenan and β-lactoglobulin interactions visualized by atomic force microscopy[J].Food Hydrocolloids,2004,18:429-439.
[10]Shi K,Kokini J L,Huang Q R.Engineering zein films with controlled surface morphology and hydrophilicity[J].Journal of Agricultural and Food Chemistry,2009,57:2186-2192.
[11]Wang Q,Crofts A R,Padua G W.Protein-lipid interactions in zein films investigated by surface plasmon resonance[J]. Journal of Agricultural and Food Chemistry,2003,51:7439-7444.
[12]Gunning P A,Mackie A R,Gunning A P,et al.The effect of surfactant type on protein displacement from the air-water interface[J].Food Hydrocolloids,2004,18:509-515.
[13]Morris V J.Probing molecular interactions in foods[J]. Trends in Food Science and Technology,2004,15:291-297.
[14]Touhami A,Dutcher J R.pH-induced changes in adsorbed β-lactoglobulin molecules measured using atomic force microscopy[J].Soft Matter,2009(5):220-227.
[15]Yang H S,An H G,Feng G P,et al.Atomic force microscopy of the water-soluble pectin of peaches during storage[J]. European Food Research and Technology,2005,220:587-591.
[16]Yang H S,Lai S J,An H G,et al.Atomic force microscopy study of the ultrastructural changes of chelate-soluble pectin in peaches under controlled atmosphere storage[J].Postharvest Biology and Technology,2006,39:75-83.
[17]Zhang L F,Chen F S,Yang H S,et al.Changes in firmness,pectin content and nanostructure of two crisp peach cultivars after storage[J].LWT-Food Science and Technology,2010,43:26-32.
[18]Zhang L F,Chen F S,An H G,et al.Physico-chemical properties,firmness,and nanostructures of sodium carbonatesoluble pectin of two Chinese cherry cultivars at different ripening stages[J].Journal of Food Science,2008,73(6):17-22.
[19]Fishman M L,Chau H K,Cooke P H,et al.Global structure of microwave-assisted flash-extracted sugar beet pectin[J]. Journal of Agricultural and Food Chemistry,2008,56:1471 -1478.
[20]An H G,Yang H S,Liu Z D,et al.Effects of heating modes and sources on nanostructure of gelatinized starch molecules using atomic force microscopy[J].LWT-Food Science and Technology,2008,41:1466-1471.
[21]Sujka M,Jamroz J.α-Amylolysis of native potato and corn starches-SEM,AFM,nitrogen aniodine sorption investigations[J].LWT-Food Science and Technology,2009,42:1219-1224.
[22]Fishman M L,Cooke P H,Coffin D R.Nanostructure of native pectin sugar acid gels visualized by atomic force microscopy[J].Biomacromolecules,2004,5:334-341.
[23]Ptaszek A,Berski W,Ptaszek P,et al.Viscoelastic properties of waxy maize starch and selected non-starch hydrocolloids gels[J].Carbohydrate Polymers,2009,76:567-577.
[24]Shimoni E,Using AFM to explore food nanostructure[J]. Current Opinion in Colloid and Interface Science,2008,13:368-374.
[25]Ikeda S,Nitta Y,Temsiripong T,et al.Atomic force microscopy studies on cation-induced network formation of gellan[J].Food Hydrocolloids,2004,18:727-735.
[26]Ikeda S,Shishido Y.Atomic force microscopy studies on heat -induced gelation of curdlan[J].Journal of Agricultural and Food Chemistry,2005,53:786-791.
[27]Yang H S,An H J,Li Y F.Manipulateand stretch single pectin molecules with modified molecular combing and fluid fixation techniques[J].European Food Research and Technology,2006,223:78-82.
[28]Wackerbarth H,Schön P,Bindrich U.Preparation and characterization of multilayer coated microdroplets:Droplet deformation simultaneously probed by atomic force spectroscopy and optical detection[J].Langmuir,2009,25:2636-2640.
[29]Patino J M R,Caro A L,Niño M R R,et al.Some implicationsofnanoscience in food dispersion formulations containing phospholipids as emulsifiers[J].Food Chemistry,2007,102:532-541.
Application advance of atomic force microscope in food components researches
ZHANG Li-fen,LIU Dong-hong*,YE Xing-qian
(School of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310229,China)
Atomic force microscope is widely used in the research of food science because of its high resolution from material that has undergone minimal preparation under air and aqueous solution environment.This paper reviewed some application of atomic force microscope in food components,which tried to provide references for the application and development of atomic force microscope in food science.
atomic force microscope;food;components;application
TS201.1
A
1002-0306(2011)01-0355-05
2009-12-14 *通讯联系人
张丽芬(1982-),女,在读博士研究生,研究方向:食品科学。
