鸭肝丁酰胆碱酯酶的纯化与酶学性质研究
2011-11-14李想韵付伟丽唐靓婷诰赵伟唐云明
朱 鸿,李想韵,邓 玉,王 松,付伟丽,唐靓婷,诰赵伟,唐云明
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆市甘薯工程研究中心,重庆400715)
鸭肝丁酰胆碱酯酶的纯化与酶学性质研究
朱 鸿,李想韵,邓 玉,王 松,付伟丽,唐靓婷,诰赵伟,唐云明*
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆市甘薯工程研究中心,重庆400715)
目的:获得鸭肝丁酰胆碱酯酶纯品并对其酶学性质进行研究。方法:采用丙酮脱脂、酸沉淀、硫酸铵分级沉淀、DEAE-Sepharose阴离子交换层析和Sephacryl S-200凝胶层析方法,分离纯化鸭肝丁酰胆碱酯酶;采用SDS-聚丙烯酰胺凝胶电泳法进行纯度鉴定和酶相对分子量测定。结果:从鸭肝中分离纯化获得电泳纯的丁酰胆碱酯酶,纯化倍数为156.45倍,酶活回收率为23.60%,比活达17.21U/mg。酶相对分子量为388.85kDa,亚基相对分子量为64.70kDa。推测该酶由六个相同亚基构成。该酶最大紫外吸收为278nm。酶催化碘化硫代丁酰胆碱水解的最适pH为8.0,最适温度为35℃。该酶在pH 3.0~10.0区域较稳定;在40℃以下处理1h,酶活力保持稳定。Zn2+、Mn2+和Cu2+对该酶具有显著的抑制作用。以碘化丁酰硫代胆碱为底物,测定该酶的表观Km为71.15μmol/L,没有过量底物抑制现象。结论:成功分离纯化获得丁酰胆碱酯酶,该酶具有较好的酸碱耐受性。
鸭肝,丁酰胆碱酯酶,分离纯化,性质
胆碱酯酶(cholinestease,ChE)是生物体内一种重要水解酶,一般可分为乙酰胆碱酯酶(acetylcholinesterase,AchE)和 丁 酰 胆 碱 酯 酶(butyrylcholinesterase,BChE)[1]。丁酰胆碱酯酶能与有机磷毒剂和杀虫剂结合,并且具有比乙酰胆碱酯酶灵敏度更高的优点,是有机磷和氨基甲酸酯类杀虫剂的重要作用靶标,它还具有能水解许多酯类、肽类及酰胺类化合物,参与某些药物的代谢过程和促进细胞生长的特点[2-4]。Greig等人对丁酰胆碱酯酶抑制研究表明,抑制丁酰胆碱酯酶可成为治疗阿尔茨海默病的新手段[5-7]。该酶在化学分析、食品安全、农业化工、医药卫生和环境监测等领域具有重要的应用。丁酰胆碱酯酶广泛存在于动植物组织中[8]。我们发现,鸭肝中丁酰胆碱酯酶含量较为丰富。因此,本文以来源广泛的鸭肝为原料,对丁酰胆碱酯酶进行分离纯化和酶学性质研究,为丁酰胆碱酯酶的进一步研究和应用提供参考。
1 材料与方法
1.1 实验材料
家鸭(Anas platyrhynchos)肝脏 取自健康活鸭,杀死后立即取肝脏于-20℃冰箱中冰冻保存备用;牛血清白蛋白、碘化硫代丁酰胆碱、碘化硫代乙酰胆碱、二硫代双硝基苯甲酸(DTNB) Sigma公司;DEAE-Sepharose、Sephacryl S-200、分子量标准品GE公司;三羟甲基氨基甲烷 Farco公司;蛋白质SDS-PAGE标准品 genscript公司;考马斯亮蓝R250、丙烯酰胺、甲叉-双丙烯酰胺 Fluka公司;其余试剂 均为国产分析纯。
1.2 实验方法
1.2.1 丙酮干粉的制备 称取新鲜鸭肝100g,用自来水洗净,再用消毒双蒸水清洗数次。剪碎,然后以1∶10(M∶V)的比例加入已经-20℃预冷的丙酮,匀浆后抽滤脱脂得滤饼。两次丙酮脱脂后将滤饼冷冻干燥至恒重,研磨成干粉备用。
1.2.2 粗提液的制备 将丙酮干粉以1∶15(M∶V)的比例加入已经预冷的0.05mol/L的Tris-HCl缓冲液(pH8.0)。匀浆后,4℃冰箱静置抽提2h,6000×g离心1h,收集上清液即得粗提液。
1.2.3 硫酸沉淀 粗提液加入硫酸调整pH至3.0,4℃冰箱静置2h后,6000×g离心30min,收集上清液得粗酶液。
1.2.4 硫酸铵分级沉淀 粗酶液加入固体硫酸铵至10%饱和度,4℃冰箱静置 2h后,6000×g离心30min,收集上清液。再加入硫酸铵至70%饱和度,4℃冰箱静置 2h,6000×g离心 30min,沉淀用0.05mol/L的Tris-HCl缓冲液(pH8.0)溶解,4℃蒸馏水透析过夜,即得到粗酶液。
1.2.5 DEAE-Sepharose离子交换层析 DEAESepharose离子交换柱按产品说明书要求处理。装柱后,用0.05mol/LTris-HCl缓冲液(pH8.0)平衡4个柱体积,粗酶液样品上 DEAE-Sephrose柱(2.6× 14cm),每次上样为10mL,用0~1.0mol/L线性梯度的NaCl溶液(内含0.05mol/L,pH8.0的Tris-HCl缓冲液)进行梯度洗脱,流速30mL/h,每管收集5mL,紫外监测波长为280nm。最后需测定各管丁酰胆碱酯酶活性和蛋白含量,收集活性较高的各管酶液,4℃透析过夜,冷冻浓缩后进行Sephacryl S-200凝胶层析。
1.2.6 Sephacryl S-200凝胶过滤柱层析 Sephacryl S-200凝胶柱按产品说明书进行装柱(16mm× 835mm)处理后,每次上样3mL。用Tris-HCl缓冲液(0.05mol/L,pH8.0)进行洗脱,流速18mL/h,每管收集3mL。测定每管丁酰胆碱酯酶活性和蛋白质含量;收集活性较高的各管酶液,4℃透析,冷冻干燥,得到丁酰胆碱酯酶纯品。
1.2.7 丁酰胆碱酯酶活性的测定 参照文献[9]略有改动,以碘化硫代丁酰胆碱为底物,采用SDS终止法进行测定。在试管中加入2.55mL 0.05mol/L pH8.0的Tris-HCl缓冲液、100μL 10mmol/L DTNB溶液、50μL 75mmol/L碘化硫代丁酰胆碱,混匀,37℃水浴保温5min,加入200μL丁酰胆碱酯酶液,立即混匀,并开始计时5min,然后加入100μL 3%的SDS溶液终止反应,室温下在波长412nm处测定其OD值。以先加入SDS溶液,再加入酶液为对照。以每分钟催化分解1μmol碘化硫代丁酰胆碱所需的酶量为一个酶活力单位。
1.2.8 蛋白质含量的测定 采用lowery法[10]和分光光度法[11],以牛血清白蛋白为标准样品。
1.2.9 丁酰胆碱酯酶的纯度鉴定 采用SDS-聚丙烯酰胺凝胶电泳进行纯度鉴定[12],分离胶浓度为12%。
1.2.10 丁酰胆碱酯酶的分子量测定 分子量测定采用凝胶过滤法[13-14]。鸭肝丁酰胆碱酯酶亚基分子量的确定采用SDS-聚丙烯酰胺凝胶电泳法测得[15]。
1.2.11 丁酰胆碱酯酶的动力学参数测定 用 pH 8.0,0.05mol/L Tris-HCl缓冲液配制不同浓度的底物溶液(0.05~1mmol/L),按酶活力测定方法测定相应的酶活力,根据Lineweaver~Burk双倒数作图法[16]求出Km值。
2 结果与分析
2.1 鸭肝丁酰胆碱酯酶的分离纯化
鸭肝丁酰胆碱酯酶粗酶液经DEAE-Sepharose柱层析(每管收集5mL)的洗脱图谱如图1所示,丁酰胆碱酯酶的活性峰集中在29~37管之间,其中31~35管酶活性最高;分别收集透析冷冻浓缩后再经Sephacryl S-200凝胶分子筛柱层析(每管收集3mL),洗脱图谱见图2,丁酰胆碱酯酶的活性峰集中在23~29管之间,其中25~28管酶活性最高,分别收集透析冷冻浓缩后备用。整个纯化结果见表1,最终可得到纯化156.45倍,比活力为17.21U/mg的酶制剂。所得丁酰胆碱酯酶经SDS-PAGE鉴定为单一蛋白成分,见图3,说明该酶制剂已达到电泳纯。以该纯品为对象,进行鸭肝丁酰胆碱酯酶性质研究。

图1 DEAE-Sepharose离子交换层析图谱
2.2 鸭肝丁酰胆碱酯酶的性质
2.2.1 鸭肝丁酰胆碱酯酶相对分子量和亚基相对分子量 经Sephacryl S-200凝胶柱层析法测定鸭肝丁酰胆碱酯酶的全酶相对分子量为388.85kDa。经SDS -PAGE测定其亚基相对分子量为64.70kDa,说明鸭肝丁酰胆碱酯酶由六个相同的亚基组成。
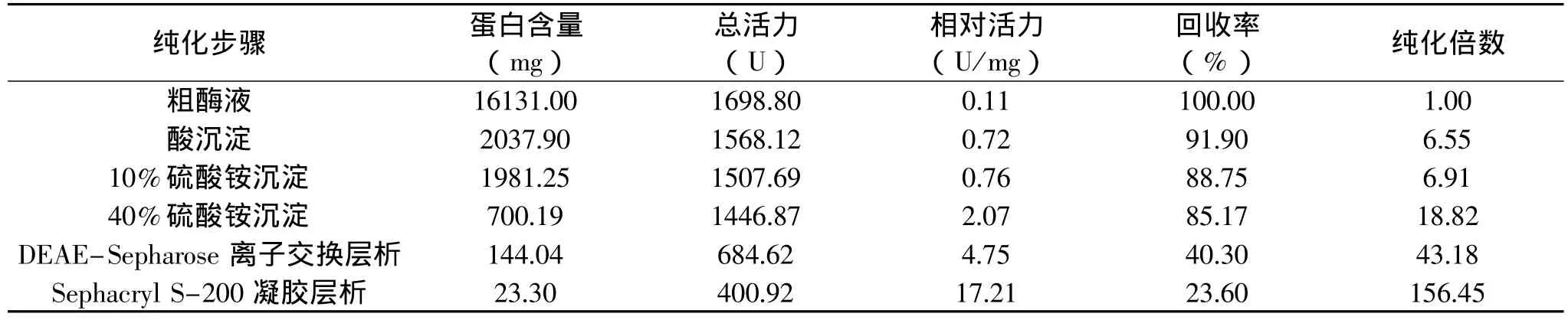
表1 鸭肝丁酰胆碱酯酶的纯化
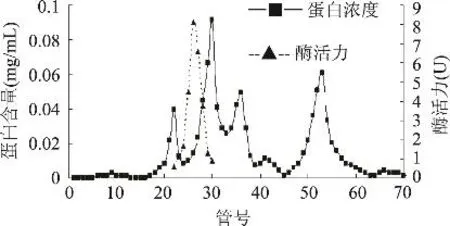
图2 Sephacryl S-200凝胶层析图谱
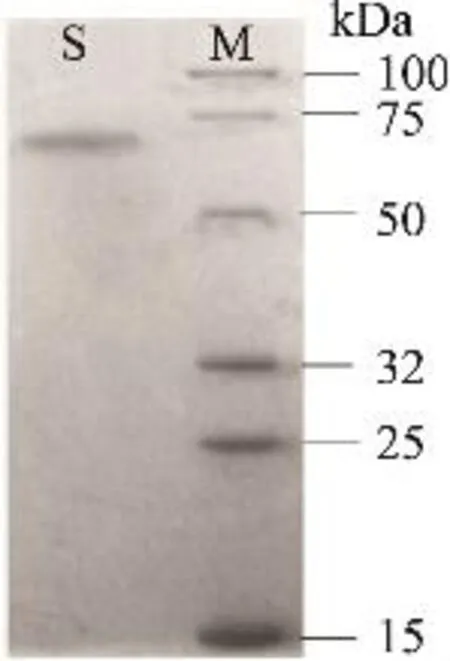
图3 SDS-PAGE电泳图
2.2.2 紫外扫描鸭肝丁酰胆碱酯酶 纯酶在 λ为220~360nm 之间扫描,特征峰的最大吸收 λ =278nm。
2.2.3 鸭肝丁酰胆碱酯酶的最适反应pH pH是影响酶活的主要参数之一,在pH3.0~11.0的缓冲液中测定丁酰胆碱酯酶的酶活力,考察丁酰胆碱酯酶催化反应的最适pH范围。以酶活最高值为100%,对不同pH做图,结果见图4。由图可见,酶的最适pH为8.0,pH在6.5~8.5的范围内丁酰胆碱酯酶的酶活均可达到最高酶活的50%以上,超出该范围,酶活急剧下降。
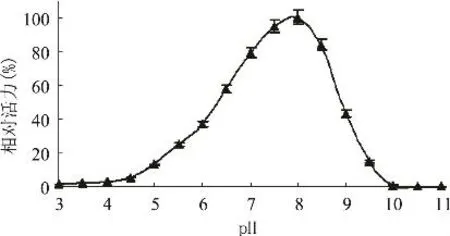
图4 pH对鸭肝丁酰胆碱酯酶活力的影响
2.2.4 鸭肝丁酰胆碱酯酶在不同pH下的稳定性酶在不同pH环境下的稳定性是酶应用的重要指标。将纯化的酶液与pH3.0~11.0的缓冲体系相混合,4℃放置24、48、72h后,取适量酶液在最佳反应条件pH8.0时测定酶活。以酶活最高值为100%,对不同pH作图,结果见图5。该丁酰胆碱酯酶在所测pH范围内能较好地保持其酶活;72h孵育后,酶活有所降低,但仍在最高酶活的40%以上;pH3.0~10.0时,酶活均较稳定,表明该酶的酸碱耐受性很强。

图5 不同pH下鸭肝丁酰胆碱酯酶的储存稳定性
2.2.5 鸭肝丁酰胆碱酯酶的最适反应温度 分别测定丁酰胆碱酯酶在20~70℃下的酶活性,其他条件不变。以酶活最高值为100%,对不同温度下酶活做图,结果见图6,表明该酶的最适温度在35℃左右。
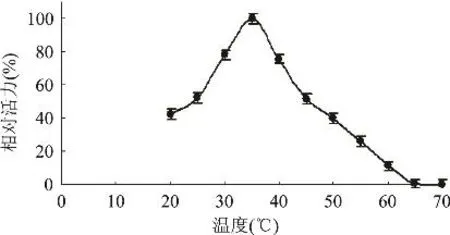
图6 温度对鸭肝丁酰胆碱酯酶活力的影响
2.2.6 鸭肝丁酰胆碱酯酶的热稳定性 酶液在4~70℃温度下分别孵育10、30、60min后测定活性。4℃的酶活力为100%,不同孵育条件下酶的相对酶活见图7。4、20、30℃下,酶活性稳定,保温60min活性保留原有活性的80%以上;40℃保温60min酶活损失50%以上,随着温度的升高,酶活力迅速降低,温度至70℃时,酶完全失活。表明该酶在40℃以下具有一定的热稳定性。
2.2.7 鸭肝丁酰胆碱酯酶的反应动力学性质 用0.05~0.6mmol/L的碘化硫代丁酰胆碱在pH8.0,35℃条件下与酶作用5min,用Lineweaver-Burk双倒数[15]作图法得图8,求得该酶的表观 Km和 Vm分别为71.15μmol/L和7.73mmol/L·min。
2.2.8 底物对鸭肝丁酰胆碱酯酶活力的影响 在最适反应条件下,分别以碘化硫代丁酰胆碱和碘化硫代乙酰胆碱为底物,其他条件不变。改变反应体系中的底物胆碱浓度(0.1~10mmol/L),测定对应酶活力。以最高酶活为100%作图,如图9。发现当以碘化硫代乙酰胆碱为底物时,活力很难检测。以碘化丁酰胆碱为底物,浓度较低时,该酶活力随底物浓度增加而增加;当底物浓度超过3.0mmol/L时,酶活力随底物浓度的增加而基本不变。说明鸭肝丁酰胆碱酯酶不能有效利用碘化乙酰胆碱,以碘化丁酰胆碱为底物时,没有底物过量抑制现象。
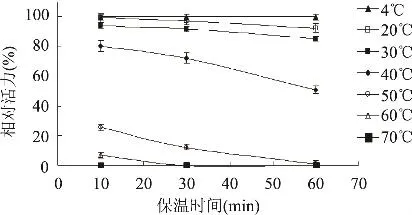
图7 鸭肝丁酰胆碱酯酶的热稳定性
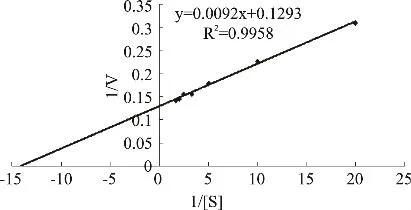
图8 丁酰胆碱酯酶催化碘化硫代丁酰胆碱的Lineweaver-Burk双倒数图
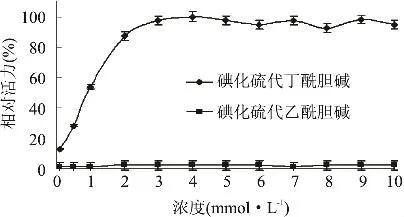
图9 底物对丁酰胆碱酯酶活力的影响
2.2.9 金属离子对鸭肝丁酰胆碱酯酶活力的影响向纯化后的鸭肝丁酰胆碱酯酶酶液中分别加入不同的金属离子,使其终浓度为10mmol/L。同时以不加金属离子的酶液作为对照,测定丁酰胆碱酯酶的活力,结果如图10所示。Ca2+对丁酰胆碱酯酶有激活作用,达到138.1%。Zn2+、Mn2+和Cu2+对酶有显著的抑制作用,尤其Cu2+能完全抑制鸭肝丁酰胆碱酯酶的活力;其他离子对酶活力影响不明显。
3 讨论
酶的分离纯化过程是对其展开全面应用和研究的基础,纯化过程的回收率和纯酶比活是衡量纯化方法可行性的重要指标。本研究通过丙酮脱脂、酸沉淀、硫酸铵分级沉淀、DEAE-Sepharose阴离子交换层析和Sephacryl S-200凝胶层析方法,从鸭肝中获得了总回收率为23.60%,纯化倍数为156.45倍,比活达17.21U/mg的酶制剂,经SDS-PAGE鉴定该酶达到电泳纯,结果肯定了本实验的分离纯化方法是可行的。
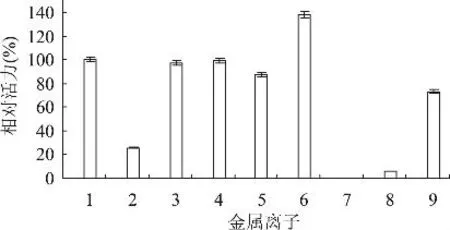
图10 不同盐离子对丁酰胆碱酯酶活力的影响
本实验采用酸沉淀杂蛋白的思路分离目的蛋白。利用目的蛋白在所用pH范围内有较强稳定性的特性,有效去除很大一部分杂蛋白,且该方法简便快速,目的酶活回收高,在本研究中为分离获得高品质丁酰胆碱酯酶打下了基础。
我们发现,鸭肝胆碱酯酶对碘化乙酰胆碱酯酶特异性低,不能以碘化乙酰胆碱为底物,说明该胆碱酯酶可能是丁酰胆碱酯酶。早在上世纪50年代,Augustinsson[17]等人经过全面研究发现,底物抑制现象是区别乙酰胆碱酯酶和丁酰胆碱酯酶的一个重要依据,本实验结果表明鸭肝胆碱酯酶没有过量底物抑制现象,为该胆碱酯酶定性为丁酰胆碱酯酶提供了有力的依据。研究所得胆碱酯酶以碘化硫代丁酰胆碱为底物时表观 Km为71.15μmol/L,高于陈久祯[18]等人以碘化硫代乙酰胆碱为底物时测得乙酰胆碱酯酶表观Km值44μmol/L,低于吴方辉[19]等人以碘化丁酰胆碱为底物时测得丁酰胆碱酯酶表观Km值144μmol/L,说明本实验纯化的胆碱酯酶与碘化硫代丁酰胆碱亲和性很高,能够特异水解硫代丁酰胆碱。由于肝脏是丁酰胆碱酯酶合成和分泌的主要场所[20],且鸭肝胆碱酯酶与丁酰胆碱亲和力高,不能有效水解乙酰胆碱,没有底物过量抑制现象,说明本实验纯化的鸭肝胆碱酯酶是丁酰胆碱酯酶。
金属离子抑制研究表明,10mmol/L Zn2+、Mn2+可显著抑制该酶活性,10mmol/L Cu2+可以完全抑制该酶活性,为该酶抑制剂的研究提供了参考。
本实验纯化的丁酰胆碱酯酶比活高于现市售且价格昂贵的同类产品,并且鸭肝丁酰胆碱酯酶具有较高的酸碱耐受性,40℃以下该酶具有较好的热稳定性,说明该酶具有广泛推广应用的潜力。
4 结论
本研究成功地从家鸭肝脏中纯化出丁酰胆碱酯酶,性质研究表明该酶具有较高的利用价值。我国是农业大国,家禽养殖遍及全国,规模大;鸭肝材料丰富,易于收集,成本低廉,是提取丁酰胆碱酯酶的可靠来源。以鸭肝为材料从中纯化丁酰胆碱酯酶也成为提升家禽附加值,帮助农民增加收入的一条新途径。该酶在农业、食品、医药等领域具有广泛的应用前景。
[1]FournierD,Mutero A.Minireview:modification of acetylcholineterase as a mechanism of resistance to insecticides[J].Comp Biochemphysiol,1994,108c(1):19-311.
[2]Lockridge O.Genetic variants of human serum cholinesterase influence matabolism of the muscle relaxant succinylcholine[J]. Pharmac Ther,1990,47(1):35-60.
[3]Mattes C E,Lynch T J,Singh A,et al.Therapeutic use of butyrylcholineaterase for cocaine intoxication[J].Toxicology and Applied Pharmacology,1997,145(2):372-380.
[4]Alber R,Sporns O,Weikert T,et al.Cholinesterase and peanut agglutinin being related to cell proliferation and axonal growth in embryonic chick limbs[J].Anat Embryol Berl,1994,190(5):429-438.
[5]Greig N H,Lahiri D K,Sambamurti K.Butyrylcholinesterase:an important new target in Alzheimer’s disease therapy[J].Int Psychogeriatrics,2002,14:77-91.
[6]Bullock R,Lane R.Executive dyscontrol in dementia with emphasis on subcortical pathology and the role of butyrylcholinesterase[J].Curr Alzheimer Res,2007,4(3):277-293.
[7]Kamal M A,Klein P,Yu Q S,et al.Kinetics of human serum butyrylcholinesterase and its inhibition by a novel experimental Alzheimer therapeutic,bisnorcymserine[J].J Alzheimers Dis,2006,10(1):43-51.
[8]魏婉丽,孙曼霁.丁酰胆碱酯酶结构研究新进展[J].生物化学与生物物理进展,2000,27(1):37-40.
[9]Ellman G L,Kiane Courtney K,AndresV,et al.A new and rapid colorimetric determination of acetylcholinesterase activity[J].Biochem Pharmacoogyl,1961(7):88-95.
[10]Lowery DH.Protein Measurement with the Folin Phenol Reagent[J].J Biol Chem,1951,193-267.
[11]Layne E.Spectrophotometric and Turbidimetric Methods for Measuring Proteins//Methods in Enzymology[C].New York:Academic Press,1957,3:447.
[12]朱广廉,杨中汉.SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量[J].植物生理学通讯,1982(2):43-47.
[13]杨安钢.生物化学与分子生物学实验技术[M].北京:高等教育出版社,2001:248-252.
[14]陈石根,周润琦.酶学[M].上海:复旦大学出版社,2001:174-175.
[15]LaemmLi UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T 4[J].Nature,1970,227:680-685.
[16]陈钧辉,陶力,朱婉华,等.生物化学实验[M].北京:科学出版社,2004.
[17]AUGUSTINSSON K B.Cholinesterogy[J].Acta Physiol Scand,1948,52:1-182.
[18]陈久祯,王惠芳,李艳军,等.梭曼和沙林对电鳐电器官乙酰胆碱酯酶抑制作用动力学[J].中国生物化学与分子生物学报,1998,12:790-792.
[19]吴方晖,高川,张靖,等.梭曼、沙林对鸭血清丁酰胆碱酯酶的动力学研究[J].第三军医大学学报,2004(6):1058-1060.
[20]张秀明,李健斋,魏明竟,等.现代临床生化检验学[M].北京:人民军医出版社,2001:1086.
Purification and characterization of the butyrylcholinesterase from duck liver
ZHU Hong,LI Xiang-yun,DENG Yu,WANG Song,FU Wei-li,TANG Liang-ting,GAO Zhao-wei,TANG Yun-ming*
(School of Life Science,Southwest University,Southwest University,Key Laboratory of Eco-environments in Three Gorges Reservoir Region Ministry of Education,Chongqing Sweet Potato Engineering Research Center,Chongqing 400715,China)
Objective:To obtain butyrylcholinesterase from duck liver and study on the characterization of the purified product.Methods:The butyrylcholinesterase was extracted by acetone treatment,acid precipitation,ammonium sulfate precipitation,and ion-exchange chromatography on DEAE-Sepharose and gel filtration on Sephacryl S-200.SDS-PAGE was used to identify the purity and relative molecular of the butyrylcholinesterase.Results:The enzyme was purified to electrophoretic homogeneity.lt was purified 156.45-fold and the activity recovery 23.60% was obtained.lts specific activity was 17.21U/mg.The relative molecular weight of this butyrylcholinesterase was 388.85kDa,and the weight of subunit was 64.70kDa.The butyrylcholinesterase consisted of six identical subunits. Ultraviolet spectrum showed a maximum absorption at 278nm.The optimum pH and temperature of the enzyme for the hydrolysis of S-Butyrylthiocholine iodide were 8.0 and 35℃,respectively.The enzyme was stable in the pH ranges of 3.0~10.0 under 35℃and at temperatures below 45℃.Zn2+,Mn2+,Cu2+had significant inhibition on this enzyme and the enzyme could not be inhibited by excess substrate.The apparent Kmof this enzyme was 71.15μmol/L at pH8.0 and 35℃.Conclusion:The butyrylcholinesterase was successfully purified,and this butyrylcholinesterase showed good acid-base tolerance.
duck liver;butyrylcholinesterase;purification;characterization
TS201.1
A
1002-0306(2011)01-0095-05
2010-01-18 *通讯联系人
朱鸿(1985-),男,硕士研究生,主要从事酶与酶工程研究。
重庆市科委资助项目(CSCT,2004AC1012)。
