HPLC测定谷物中玉米赤霉烯酮的不确定度评定
2011-11-14陆美斌李为喜王步军
陆美斌 李为喜 武 力 王步军
(中国农业科学院作物科学研究所农业部谷物品质监督检验测试中心,北京 100081)
HPLC测定谷物中玉米赤霉烯酮的不确定度评定
陆美斌 李为喜 武 力 王步军
(中国农业科学院作物科学研究所农业部谷物品质监督检验测试中心,北京 100081)
依据JJF 1059—1999《测量不确定度评定与表示》和JJF 1135—2005《化学分析中不确定度评定》原理及方法,通过分析谷物中玉米赤霉烯酮的测定过程,确定各个不确定度来源,建立不确定度评定数学模型,对单个不确定度分量进行合成和扩展,最终建立高效液相色谱法测定谷物中玉米赤霉烯酮的不确定度评定方法。结果表明:玉米赤霉烯酮含量=(57.82±2.67)μg/kg,K=2。测量不确定度的主要来源为4个方面,按引入的不确定度分量贡献大小排序,依次为溶液测定、测量重复性、样品定容、称样量。
高效液相色谱法 玉米赤霉烯酮 不确定度
玉米赤霉烯酮(zearalenone,ZEN)又称F-2毒素,是主要由镰刀菌产生的2,4一二羟基苯甲酸内酯类化合物,它是粮食安全卫生的重要理化指标。目前许多国家对玉米赤霉烯酮含量都有严格规定,我国《粮食卫生标准》(GB 2715—2005)也明确要求小麦、玉米中玉米赤霉烯酮含量不能超过60 μg/kg[1]。在分析测试领域中,有效评定玉米赤霉烯酮测量结果质量显得尤为重要。不确定度作为一种科学方法,是实验室工作的重要质量指标,测量结果的可用性很大程度上取决于不确定度的大小。鉴于目前国内几乎没有玉米赤霉烯酮测量不确定度研究的报道,本研究参照国家标准GB/T 5009.209—2008《谷物中玉米赤霉烯酮的测定》[2],以玉米为例,对谷物中玉米赤霉烯酮的测定进行分析评定,建立液相色谱法测定谷物中玉米赤霉烯酮的不确定度评定方法,以期为正确评价和使用检测数据提供科学的依据。
1 材料与方法
1.1 材料、试剂与仪器
样品来源及处理:2009年大田玉米,晾干,手工脱粒,粉碎(20目)。
甲醇(HPLC级)、乙腈(HPLC级):美国Fisher公司;氯化钠:北京化工厂;玉米赤霉烯酮免疫亲和柱:美国Vicam公司;玻璃纤维滤纸:美国Whatman公司、玉米赤霉烯酮标准品(Z2125-10MG):日本Sigma公司。除另有规定外,所用试剂均为分析纯,水为高纯水。
LC-20AB高效液相色谱仪配有荧光检测器:日本Shimadzu公司;1093型粉碎机:瑞典 Vetcator公司;T18 basic均质机:德国IKA公司;BF-2000M型氮吹仪:北京八方世纪科技有限公司;ACO-5503型超静强力气泵:广东海利集团有限公司;玻璃注射器(20 mL):北京中检维康技术有限公司;1702型电子天平(感量0.1mg):西德Sartorius公司。
1.2 测量原理与方法
1.2.1 测量原理
试样中玉米赤霉烯酮用乙腈-水提取,提取液经免疫亲和柱净化、浓缩后,用配有荧光检测器的液相色谱仪进行测定,外标法定量。
1.2.2 测定过程
称取样品40 g,置于250 mL具塞三角瓶中,加入4 g氯化钠和100 mL乙腈-水(9+1),高速搅拌提取2min,用折叠快速定性滤纸过滤,移取10.0 mL滤液并加入40 mL水稀释均匀,经玻璃纤维滤纸过滤1~2次,至滤液澄清。将免疫亲和柱连接20 mL玻璃注射器。准确移取10 mL提取滤液,注入玻璃注射器中,连接空气压力泵与玻璃注射器,调节压力使溶液以1~2滴/s的流速缓慢通过免疫亲和柱,直至有部分空气通过柱体。以5 mL水淋洗柱子1次,弃去全部流出液,并使部分空气通过柱体。准确加入1.5 mL甲醇洗脱,流速为1 mL/min,手机洗脱液于玻璃试管,55℃以下氮气吹干,用1.0 mL流动相溶解残渣,供液相色谱测定。同时做空白试验。
1.2.3 工作曲线绘制
0.1 mg/mL玉米赤霉烯酮标准溶液配制:准确称取10 mg玉米赤霉烯酮标准品,用乙腈溶解定容至100 mL。由0.1 mg/mL玉米赤霉烯酮标准溶液用流动相逐级稀释配置成200、100、50、20、10 ng/mL 系列标准溶液。以空白作参比,同测量步骤选定的仪器条件测定峰面积。以浓度为横坐标、峰面积为纵坐标,绘制工作曲线。
1.3 数据处理
利用极差法、最小二乘法等统计方法计算分析,使用Excel 2003软件进行数据处理。
2 结果与分析
2.1 数学模型
根据测定原理及方法,测定结果和有关参数有如下函数关系:
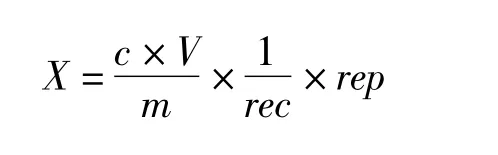
式中:X为试样中玉米赤霉烯酮含量/μg/kg;c为由标准曲线得到的试样溶液中玉米赤霉烯酮的浓度/ng/mL;V为样品最终定容体积/mL;m为样液代表的试样量/g;rec为回收率校正因子,由添加回收试验所得,表示测量结果系统偏差的参数;rep为总重复性因子,由重复性试验所得,表示测量结果间一致性的参数。
从数学模型看出,各影响参数相互独立,各参数的不确定度直接对被测量X的不确定度产生影响,根据JJF1135—2005《化学分析中不确定度评定》[3],合成标准不确定度可用相对标准不确定度进行,公式如下:

2.2 不确定度来源
玉米赤霉烯酮测定的不确定度来源主要包括样品称量引入的不确定度、样品定容体积引入的不确定度、测量用样品溶液中玉米赤霉烯酮含量引入的不确定度、测量重复性引入的不确定度和分析程序的系统偏差引入的不确定度,因果关系如图1所示。
样品称量引入的不确定度与天平称量的最大允许误差和重复性误差有关;样品定容体积引入的不确定度与定容用容量瓶、移液器体积、定容温度与校正温度不同引起体积变动有关;测量用样品溶液中玉米赤霉烯酮含量引入的不确定度与拟合标准工作曲线求玉米赤霉烯酮含量、玉米赤霉烯酮标准溶液和配制标准曲线引入的不确定度有关。

图1 不确定度的因果关系图
重复性引入的不确定度:分析方法本身的变动性通常难以量化,尤其是复杂的分析过程,很难用技术文件数据进行不确定度评定,应尽可能进行重复性实验,将结果进行量化统计得出不确定度。
分析程序的系统偏差引入的不确定度:分析程序的系统偏差可以通过加标回收试验进行研究评定。
2.3 不确定度分量评定
2.3.1 样品称量引入的不确定度U(m)
根据天平鉴定证书,其最大允许误差为0.4 mg,按照矩形分布[1],引入的不确定度为 0.4÷31/2=0.230 9 mg。考虑到天平有去皮操作,称量一次引入的标准不确定度 U(m)为21/2×0.230 9=0.326 5 mg。相对标准不确定度Urel(m)=U(m)÷m=0.326 5 mg÷40 g=8.16 ×10-6。
2.3.2 定容体积引入的不确定度U(V)
按照 JJG646—2006《移液器检定规程》[4]和相关产品证书,用最大允差计算不确定度,假设为三角分布(表1)。
合成相对标准不确定度 Urel(V)=[(3.54×10-3)2+(6.94 ×10-4)2+(2.04 ×10-3)2+(2.04 ×10-3)2]1/2=4.62 ×10-3。

表1 样品定容引入的不确定度
试验室环境温度一般为20℃,由于温度波动引起的液体体积膨胀导致的不确定度忽略不计。
2.3.3 测定样品溶液中玉米赤霉烯酮含量引入的不确定度U(c)
2.3.3.1 拟合标准工作曲线求玉米赤霉烯酮含量引入的不确定度
乙腈溶解玉米赤霉烯酮标准品配制成0.1 mg/mL标准储备液,使用前用流动相稀释成适当质量浓度标准工作溶液,进行2次重复测定,结果如表2所示。

表2 标准工作曲线测定结果
根据表2结果,用线性最小二乘法[3]拟合校准曲线,得回归方程Y=814.0X-810.4,相关系数r=0.999 96,记为 Y=BX+A,其中 B=814.0,A=-810.4。对测定用样品溶液中玉米赤霉烯酮含量进行 2 次测定,结果分别为 44.65、47.87 ng/mL,平均值为46.26 ng/mL。
C的标准不确定度由下式[2]可得:
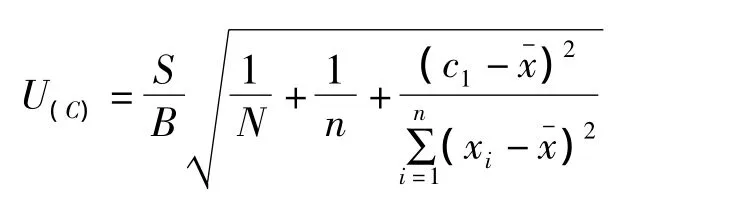
从计算公式可以看出,样品溶液浓度偏离标准工作曲线浓度平均值越大,不确定度就越大,与平均值相等情况下,不确定度值最小。这是由线性最小二乘法本身所决定的。在试验过程中应选择适当浓度梯度的标准工作曲线,有利于减小由此引入的不确定度。
2.3.3.2 配制玉米赤霉烯酮标准工作曲线引入的不确定度
用乙腈溶解10 mg玉米赤霉烯酮标准品定容于100 mL容量瓶,配制成0.1 mg/mL玉米赤霉烯酮标准储备液。玉米赤霉烯酮标准品证书未提供不确定度信息,假定其不确定度为0.100 mL,容量瓶最大允差为 ± 0.01 mL[5],按照三角分布计算不确定度0.01÷61/2=0.004 08 mL,相对标准不确定度为0.004 08 ÷100=4.08 ×10-5。0.1 mg/mL 玉米赤霉烯酮标准储备液相对标准不确定度为[(4.08×10-5)2+(0)2]1/2=4.08 ×10-5。
分别移取5、10、25、50、100 μL 至50 mL 容量瓶,定容,此溶液为玉米赤霉烯酮标准工作溶液。按照JJG 646—2006[4]和 JJG 196—2006[5],用最大允差计算不确定度,假设为三角分布(表3)。合成相对标准不确定度为[(1.22 × 10-2)2+(4.08 × 10-3)2+(2.04 ×10-3)2+(2.45 ×10-3)2+(6.12 ×10-3)2+(9.13 ×10-4)2]1/2=1.47 ×10-2。

表3 配制标准工作曲线时量器校准引入的不确定度
由表3数据得出相对标准不确定度为[(4.08×10-5)2+(1.47 ×10-2)2]1/2=1.47 ×10-2。
2.3.3.3 配制过程温度变化产生的不确定度
实验室温度控制严格,一般为20℃,波动很小,由此引入的不确定度忽略不计。
2.3.3.4 合成相对标准不确定度
测定样品溶液中玉米赤霉烯酮含量引入的相对标准不确定度 U(c)=[(1.25 ×10-2)2+(1.47 ×10-2)2]1/2=1.93 ×10-2。
2.3.4 测量重复性引入的不确定度U(rep)
在重复性条件下,对同一样品进行5次独立观测,测量结果分别为 56.86、58.94、57.79、56.70、58.8 μg/kg,5 次测量的平均值为 57.82 μg/kg,用极差法[6]求得不确定度为 2.24 ÷ 2.33 ÷21/2=0.68 μg/kg,相对标准不确定度为 U(rep)=0.68 ÷57.82=1.18 ×10-2,其中 2.33 为极差系数。
不确定度评定中应尽可能进行重复试验,以取得包括化学反应过程(如本试验中的提取净化过程等)和各测量变动性在内的重复性数据。评定了测量重复性分量,则仪器本身的变动性、器皿和天平读数等的重复性不必再评定。一般情况下,重复性的不确定度分量贡献较大,不容忽视。本研究将空白引入的不确定度放入到重复性引入的不确定度中一并考虑。
2.3.5 分析程序的系统偏差引入的不确定度U(rec)
进行加标回收试验,添加水平为50 μg/kg,11个样品的平均回收率为97.9%,标准偏差4.1%,标准不确定度采用平均值的标准偏差。U(rec)=4.1% ÷(11)1/2=1.24 ×10-2,Urel(rec)=1.24 ×10-2÷97.9%=1.26×10-2。显著性检验是用来确定平均回收率与期望值1是否存在显著性差异[7]:1.694≤tcrit,10=2.228,其中 t是自由度为10时的双边临界值,结果表明差异不显著。所以该方法不存在系统偏差,公式中不需要加入校正因子1/rec。不确定度评定的数学模型修正为:Ur2(X)
若显著性检验结果为存在显著性差异,则结果需要用回收率校正因子进行修正,且在不确定度评定过程中应考虑系统偏差引入的不确定度分量。
2.4 合成标准不确定度
将各个相对标准不确定度分量(见表4)进行合成,则合成相对标准不确定度为 Ucrel(X)=[(8.16×10-6)2+(4.62 ×10-3)2+(1.93 ×10-2)2+(1.18 ×10-2)2]1/2=2.31 ×10-2。

表4 相对标准不确定度一览
2.5 扩展不确定度
取包含因子K=2,扩展不确定度U(X)/X=2×Ucrel(x)=4.62 ×10-2。则 U(X)=57.82 ×4.62 ×10-2=2.67 μg/kg。
2.6 不确定度报告
玉米赤霉烯酮含量 =(57.82 ±2.67)μg/kg,K=2。
2.7 不确定度分量统计直方图
如图2所示,测量不确定度的主要来源为4个方面(其中m所表示的称样量由于数值相对较小按图中比例未能显示出来),按引入的不确定度分量贡献大小排序,依次为溶液测定、测量重复性、样品定容、称样量。

图2 不确定度分量统计直方图
3 结论
液相色谱法测定谷物中玉米赤霉烯酮含量,结果表示为玉米赤霉烯酮含量 =(57.82±2.67)μg/kg,K=2。结果符合国标[3]规定的误差要求,本次评定合理有效。测量不确定度的主要来源为4个方面,按引入的不确定度分量贡献大小排序,依次为溶液测定、测量重复性、样品定容、称样量。称样引入的不确定度贡献很小,基本可以忽略。溶液测定引入的不确定度贡献最大,测定时要引起充分的重视。
[1]GB 2715—2005,粮食卫生标准[S]
[2]GB/T 5009.209—2008,谷物中玉米赤霉烯酮的测定[S]
[3]JJF 1135—2005,化学分析中不确定度评定[S]
[4]JJG 646—2006,移液器检定规程[S]
[5]JJG 196—2006,常用玻璃量器检定规程[S]
[6]JJF 1059—1999,测量不确定度评定与表示[S]
[7]中国试验室国家认可委员会.化学分析中不确定度的评估指南[M].北京:中国计量出版社,2002:66.
Uncertainty Evaluation in HPLC Determination of Zearalenone in Cereals
Lu Meibin Li WeixiWu LiWang Bujun
(Institute of Crop Science,Chinese Academy of Agriculture Sciences,Supervision and Testing Center of Cereal Quality,Ministry of Agriculture,Beijing 100081)
The base of this investigation is the principles and methods of JJF 1059—1999《Evaluation and Expression of Uncertainty in Measurement》and JJF 1135—2005《Evaluation of Uncertainty in Chemical Analysis Measurement》.The sources of uncertainty in determination of zearalenone in cereals by high performance liquid chromatography(HPLC)were established by analyzing the whole determination procedure.Each uncertainty component was modeled,synthesized and expanded to develop an evaluation method of the uncertainty in HPLC determination of zearalenone in cereals.Results:The zearalenone content in cereals determined is(57.82 ± 2.80)μg/kg,K=2.There are four main sources of uncertainty attributed,which rank in decreasing order of uncertainty contribution as solution determination,measurement repeatability,sample dilution,and sampling.
HPLC,zearalenone,uncertainty
O657.71
A
1003-0174(2011)03-0114-05
2009年农业部无公害农产品质量安全监测(2130109)
2010-03-01
陆美斌,女,1979年出生,助理研究员,食品科学与工程
王步军,男,1960年出生,研究员,博士生导师,农产品质量与安全
