超声引导下周围神经阻滞技术新进展
2011-11-12金荒漠郭向阳
金荒漠 郭向阳
北京大学第三医院麻醉科
安全、便捷、有效和快速的医疗工作是现代医学的核心内容,麻醉科的许多临床工作针对的是病人的神经系统和心血管系统,怎样在高效运转的医疗模式下保证医疗质量,是摆在麻醉学从业人员面前的严峻问题。目前,以超声技术为代表的诸多可视化技术使麻醉学科逐渐摆脱了“盲目”操作的时代,进入到可视化操作的新纪元。
超声技术是近年来发展最快、认可度最高的可视化技术。它对医疗效率和医疗质量的提高起到了极大的推动作用,改善了临床麻醉操作的水平,将麻醉学带入了一个崭新的时代。麻醉超声技术包括超声引导神经阻滞技术、经食道超声心动图技术(TEE)、经颅多普勒技术、以及超声引导下的动静脉穿刺等等。其中超声引导周围神经阻滞技术近年来以令人惊讶的速度得到了人们的认可,值得我们在下面进一步阐述。
1 超声引导技术与应用神经刺激器在外周神经阻滞研究进展
周围神经阻滞技术自发明以来已经有多种辅助方法,如超声引导[1]、透视引导[2]、神经刺激[3]和筋膜突破音[4]等,从最初的寻找异感法,到神经刺激器的广泛使用,再到超声引导辅助神经刺激器,周围神经阻滞技术的安全性和有效性经历了逐步提高的发展过程。近年来有多项研究对神经刺激器或超声引导技术进行了比较,有证据显示,单纯通过神经刺激方法引导置管对改善下肢的镇痛效果作用很小[5-6]。根据北京大学第三医院麻醉科最新的一项前瞻性随机临床研究[7],对于单次和持续股神经阻滞,联合应用神经刺激器和超声引导技术比单独使用神经刺激器成功率更高[(63.3% vs.38.3%),P=0.010],耗时更短[9.0(6.0~22.8 min)vs.13.5 (6.0~35.9 min),P=0.024],同时病人的满意率更高。Thomas等[8]研究发现,对于肌腱沟法臂丛神经阻滞,单纯使用超声引导技术置管比神经刺激器引导耗时更短[(4.3 ± 1.5)min vs.(10 ± 1.5)min,P=0.009],麻醉起效更快[(12 ± 2)min vs.(19 ± 2)min,P=0.02]。Bendtsen等[9]对坐骨神经阻滞的前瞻性研究也证实了这一结论,即超声引导下置管进行连续坐骨神经阻滞的成功率更高(94% vs.79%,P=0.03),进针深度更小(1 cm[1~6]vs.2 cm[1~10],P=0.0005),患者阿片类药物使用剂量更小 [18 mg (0~159 mg)vs.34 mg(0~152 mg),P=0.02]。此外,McNaught等[10]研究认为,使用超声引导神经阻滞达到有效镇痛所需最低局麻药容量比神经刺激器引导法显著减小[0.9 ml(0.3~2.8 ml) vs.5.4 ml (3.4~8.6 ml),P=0.034]。
以上研究结论对于快速周转的临床麻醉工作尤其是日间手术麻醉具有重要的参考价值。超声引导下神经阻滞技术公认的优势有如下几个方面:(1)能够直观地观察到神经、周围组织以及药物的扩散。这是超声技术最主要的优点[11]。(2)发现局部解剖变异(图1、2),有效避免阻滞失败;(3)减少局麻药用量[12-14],降低药物不良反应发生率;(4)改善阻滞效果,使局麻起效更快[15-18],持续时间更长[15-16,19]。(5)减少操作时病人的痛苦,提高病人满意度[20]。本文将对近年来超声引导下局部麻醉技术相关研究的进展进行回顾和总结,并展望该技术未来的发展。
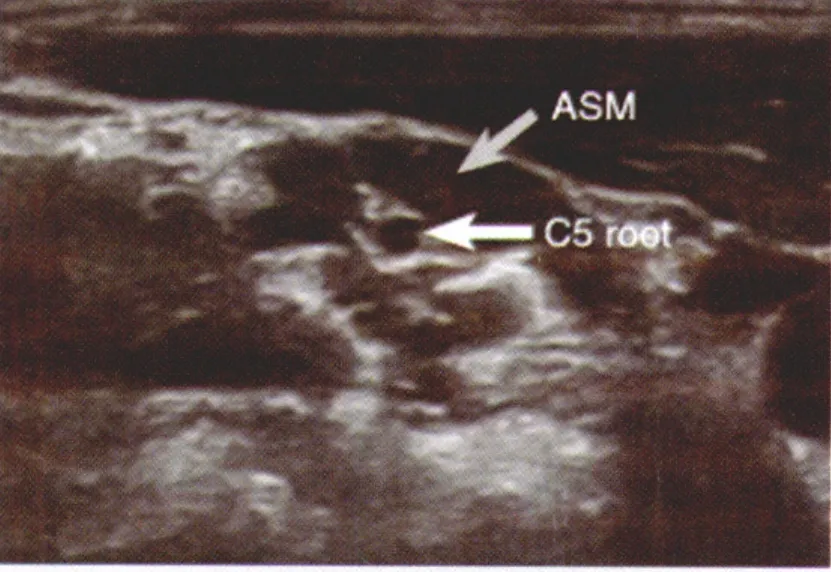
图1 C5神经根位于前斜角肌内 (ASM前斜角肌)
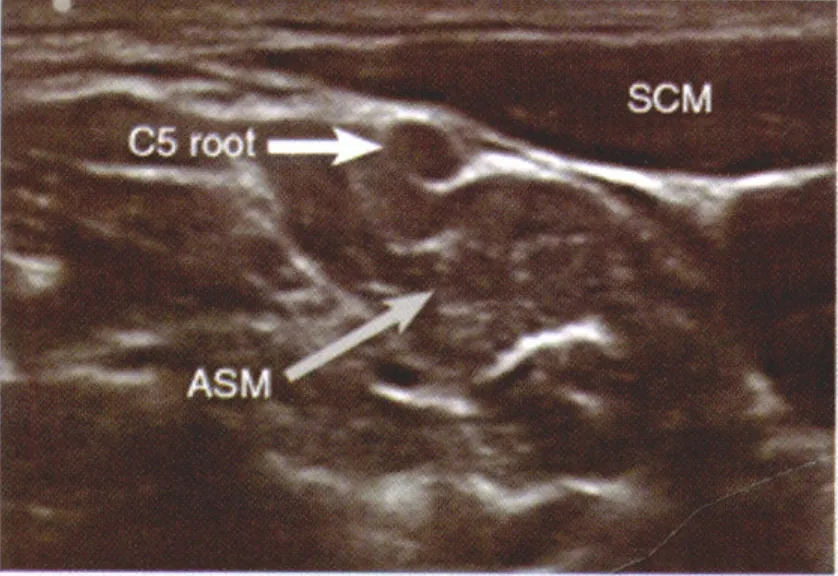
图2 C5神经根位于斜角肌间沟外(SCM 胸锁乳突肌)
2 超声引导下周围神经阻滞技术进展
2.1 上肢神经阻滞
上肢以及肩部的解剖结构虽然复杂,但由于其位置表浅,比较容易观察到清晰的超声图像,非常适合应用超声技术进行神经阻滞操作。目前上肢神经阻滞主要有以下几种。
2.1.1 肌间沟入路臂丛神经阻滞
Van Geffen等[21]最近研究了肌间沟的后路入路法。该方法使得进针点和手术操作区距离更远,减少了对手术区域的干扰,同时可以避免导管的移动,使肌间沟持续阻滞技术更加可行。然而该方法也有其明显的不足之处:首先,穿刺针需要在颈部组织中行进较长的距离才能到达神经周围,使得病人的痛苦相对增加;其次,穿刺针需要穿过中斜角肌,可能使该肌肉中的胸长神经和肩胛背神经受损;再次,由于较长的进针距离,使得平面内进针法时保持针体始终可见变得较为困难,这大大增加了穿刺针误入颈椎椎管内的风险。考虑到以上不足,传统的肌间沟穿刺点和平面外进针法[22]可能更加安全。该方法进针距离短,放置探头的位置神经表浅易于观察,阻滞效果也令人满意(图3)。对于传统平面外进针法不易于观察针尖位置的弊端,可以通过减慢进针速度,观察周围组织移动来给予解决。此外,平面外肌间沟入路中导管的行进方向与神经平行,更容易放置到位,从而达到较好的阻滞效果。
2.1.2 锁骨上入路臂丛神经阻滞
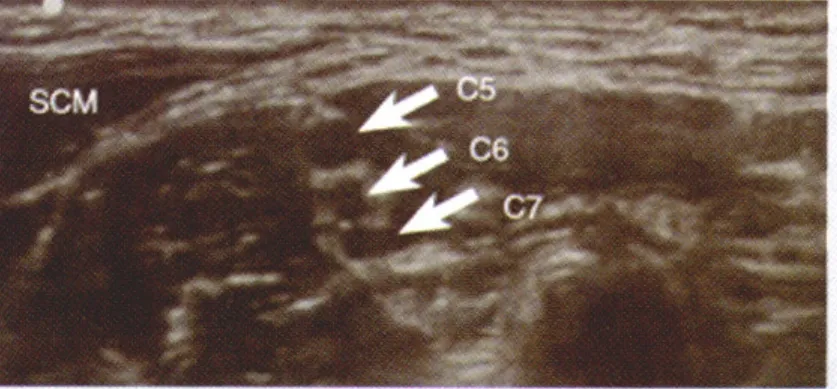
图3 传统肌间沟入路观察到的C5-C7神经根和胸锁乳突肌(SCM)
自从超声技术应用于臂丛神经阻滞,以前已经很少使用的锁骨上入路越来越多的被重新采用,并且在近年有取代锁骨下入路的趋势。锁骨上超声图像可以清晰的显示臂丛神经及其周围的组织结构,如锁骨,第一肋骨,锁骨下动脉以及胸膜顶等等(图4)。该入路既可以使用平面内进针也可以使用平面外进针法,但是大多临床医生推荐平面内进针法,因为该方法可以降低误穿胸膜或动脉的风险。关于注药部位,近年提出了“Corner Pocket”这一概念。“Corner Pocket”是由第一肋、锁骨下动脉和臂丛神经围绕的间隙,该处被认为是给药的最佳部位[23]。Duggan等[24]对锁骨上入路单点给药的剂量进行了研究,结论认为该部位最低有效剂量为23 ml(2%利多卡因和0.5%布比卡因混合液),95%有效剂量为42 ml。这一给药容量要高于肌沟入路,原因可能在于该部位神经周围组织较多,腔隙较大[25]。Fredrickson等[26]研究发现,锁骨上入路单点阻滞的效果差于锁骨下入路三点环绕阻滞,使用单点“Corner Pocket”阻滞的失败率较高。Marhofer等[27]认为只有肩部和肘部之间的手术操作适合使用锁骨上阻滞法,而前臂和手部手术使用腋路和锁骨下入路更为有效,原因在于后两种方法可以更好的阻滞尺神经、正中神经和肌皮神经。
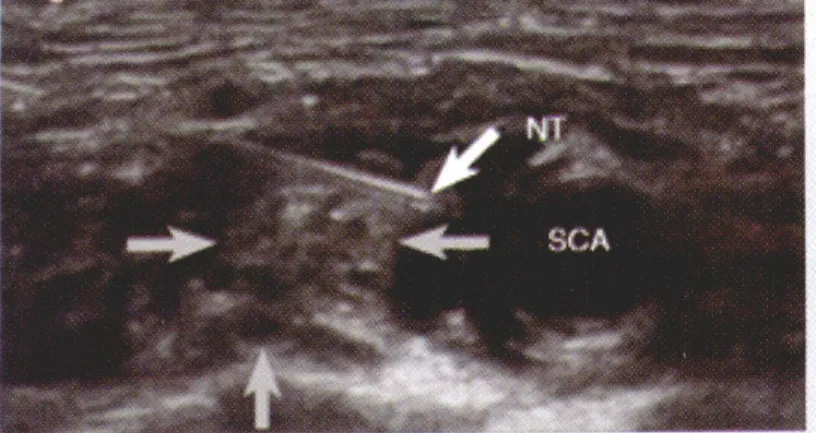
图4 锁骨上入路超声图像,NT 针尖, SCA 锁骨下动脉,灰色箭头指示神经位置
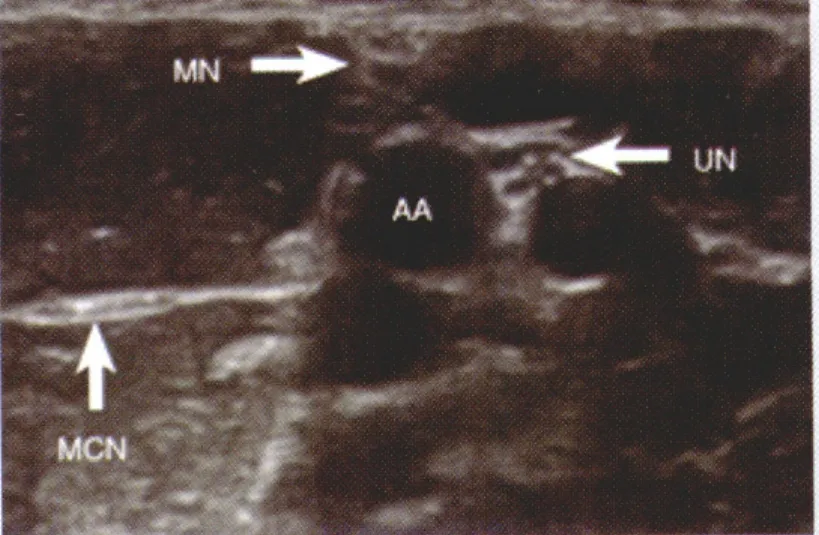
图5 腋路超声显像,MN 正中神经,UN 尺神经,MCN 肌皮神经(位于肱二头肌短头和喙肱肌之间),AA 腋动脉
2.1.3 腋路臂丛神经阻滞
超声技术使腋路臂丛神经阻滞的效果也发生了革命性的改善。近年,腋部臂丛神经解剖结构的个体差异性越来越得到重视[28],识别局部解剖结构变异可以显著提高阻滞的成功率。现在的观点认为腋路的4根神经(正中神经、尺神经、桡神经和肌皮神经)单独包绕在各自的组织腔隙中,所以应该分别对每根神经进行阻滞以达到满意的麻醉效果(耐受手术和止血带刺激)[29]。超声显像中,尺神经、正中神经和肌皮神经均比较容易鉴别,而最难辨认的是桡神经(图5)。桡神经在该部位与肱动脉位置非常近,如果不能给予有效的阻滞就可能影响麻醉效果[30]。Moayeri等[31]发现桡神经一般位于肱动脉周围4点钟和6点钟位置,且相对固定。可以使用通过注入少量液体使神经和动脉分离的方法提高超声下桡神经的识别率。腋路阻滞既可以使用平面内也可以使用平面外进针法,但平面内法更为安全,可以有效避免误入血管和神经损伤。近年也有平面内进针法误入静脉的报道,原因可能是注药时超声探头按压过紧致使静脉塌陷,以至于静脉不能显像,应注意予以避免。
2.2 下肢神经阻滞
与上肢相比,下肢的解剖结构相对简单,但由于包绕神经干的肌肉和脂肪组织较丰富,使得超声技术在下肢神经阻滞中的应用仍面临着诸多挑战。
2.2.1 腰大肌间隙阻滞
腰大肌间隙阻滞是最早应用于临床的下肢神经阻滞方法。腰大肌间隙单点给药即可以同时对股神经、闭孔神经和股外侧皮神经进行阻滞。传统方法是在L3-5水平放置探头观察腰大肌的横切面,在该部位腰丛可以显像。通常需要神经刺激器和超声联合使用以保证麻醉效果。最近Karmakar等[32]对超声引导腰大肌间隙阻滞的方法进行了改良,作者将探头纵向放置(与脊柱平行)观察腰大肌间隙,使用平面内进针法向头侧方向进针给药。腰大肌间隙阻滞主要的缺点是给药量大,如吸收过快或误入椎旁血管可能导致显著的中毒反应,此外双侧阻滞也是比较值得重视的临床并发症。目前认为腰大肌间隙阻滞的临床价值有待商榷,即使在临床中使用也应由经验丰富的操作者进行。
2.2.2 股神经阻滞
股神经阻滞中比较常用的是平面外进针法。该方法进针距离短,针体与神经平行,置管较容易(图6)。此外,Niazi等[33]最近也对平面内进针法股神经阻滞进行了研究。在某些情况下,股神经显像困难,也可使用髂筋膜阻滞进行替代。Dolan等[34]研究认为超声引导下髂筋膜阻滞比传统的突破感法更具优势,但需要更多的麻醉药容量。目前多数观点仍认为小剂量局麻药近神经阻滞更加安全有效。
2.2.3 闭孔神经阻滞
近年来,针对闭孔神经阻滞的研究成为了一个热点,这种方法可以应用于泌尿外科内镜手术或者膝关节手术中。研究证实,闭孔神经对大腿中部,膝关节以及髋关节均有神经支配。Helayel等[35]使用平面外进针法对闭孔神经前支进行阻滞,该研究共纳入22名患者,超声显像下闭孔神经前支是一个扁平的高回声结构,位于耻骨肌、长收肌和短收肌之间(图7)。但是闭孔神经在该水平的解剖结构较为复杂和多变,仍需进行更多的研究加以证实。最近,Akkaya等[36]使用闭孔神经分支前入路法,对髋关节痛、膝关节痛以及闭孔神经痛的病人进行了镇痛治疗的相关研究。
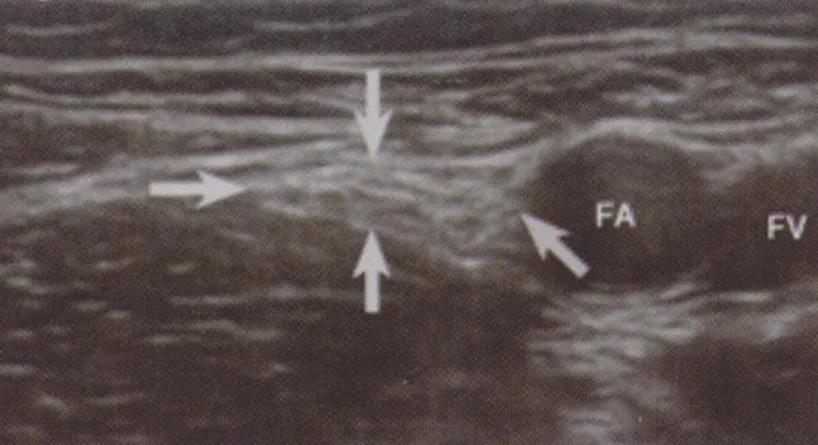
图6 箭头之间的股神经,FA 股动脉,FV 股静脉
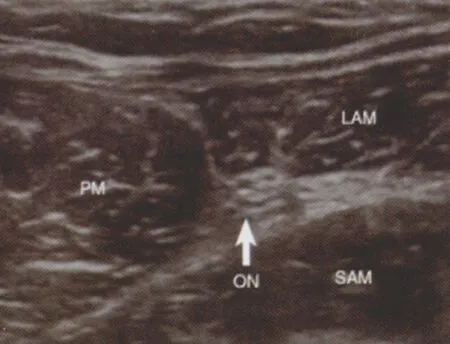
图7 ON 闭孔神经,PM 耻骨肌,LAM 长收肌,SAM 短收肌
2.2.4 坐骨神经阻滞
经臀入路坐骨神经阻滞联合腰丛阻滞可以用于髋关节手术的镇痛,这对于有严重合并症的老年患者尤其重要。坐骨神经阻滞的进针点理论上可以是神经走行的任何部位,但是由于肌肉和脂肪组织的影响,在多数部位使用超声定位并不容易。一般认为臀下入路时超声显像最为清晰(图8),可用于膝关节、血管和截肢手术。进针点继续下移则可以用于踝关节和足部的手术。
2.2.5 髂腹股沟神经和髂腹下神经阻滞
最近针对儿童和成人髂腹股沟神经和髂腹下神经阻滞的相关研究[37-38]显示,超声引导下神经阻滞的成功率高于传统的突破感法(96% vs.74%)。研究认为,观察髂腹股沟神经和髂腹下神经的最佳位置在髂前上嵴水平,神经横断面位于腹内斜肌和腹横肌之间(图9)。在另一篇报道中,作者进一步研究了婴幼儿最佳的给药剂量,发现0.075 ml/kg即可以满足临床需要[39]。
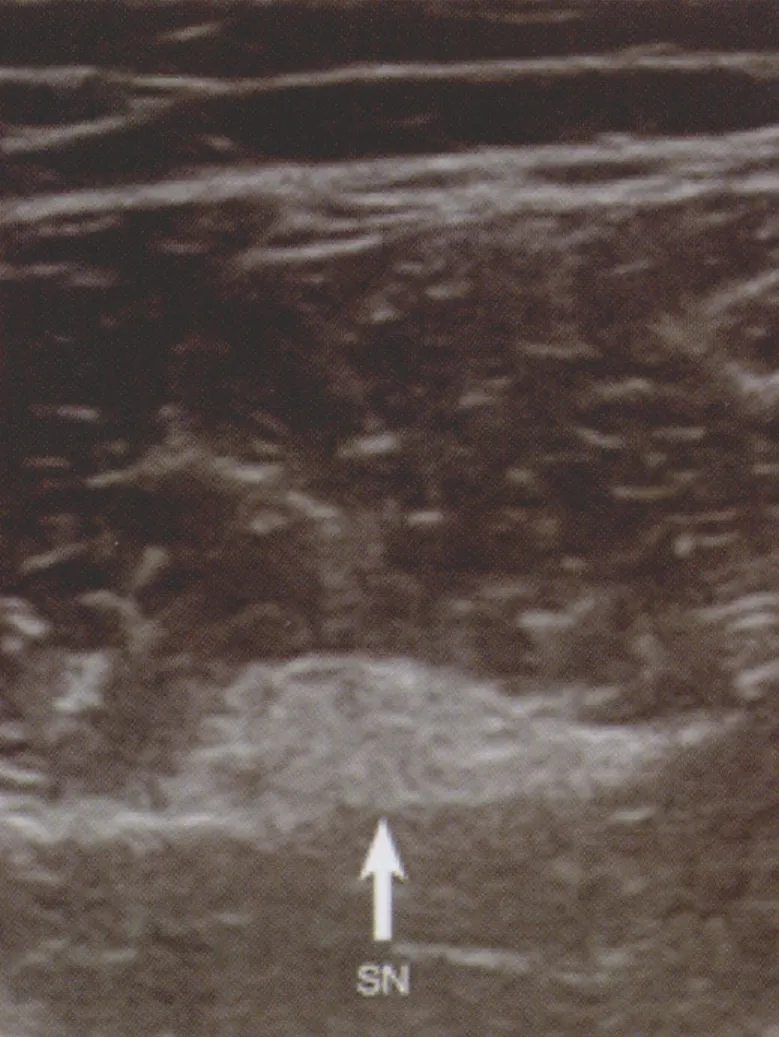
图8 SN 坐骨神经
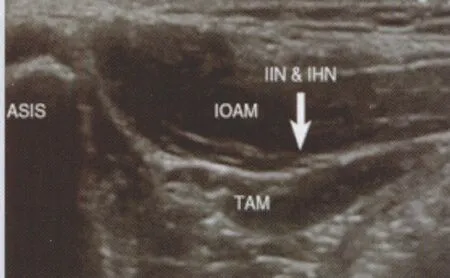
图9 IIN&IHN 髂腹股沟神经和髂腹下神经,IOAM 腹内斜肌,TAM 腹横肌,ASIS 髂前上嵴
最近腹横肌平面(transverses abdominis plane,TAP)阻滞技术得到了较快的发展。该技术可以为很多腹部手术提供镇痛[40-43]。TAP阻滞技术通过向腹内斜肌和腹横机间隙注入局麻药,可以阻滞包括T7~T12肋间神经、髂腹股沟神经和髂腹下神经、以及L1-3脊神经后根的皮支。值得一提的是,目前已经有将TAP技术应用于妇科腹腔镜手术的报道[44]。在尸体上的研究表明,在髂嵴上部位注入染料后,染料的分布节段主要为T10~L1皮区[45]。最近多项研究报道了超声引导下TAP阻滞技术在临床中的应用情况[46-48],通常给药容量需达到30~40 ml以产生完善的阻滞作用。这可能导致过高的血浆局麻药浓度,引起局麻药中毒或全身的镇痛作用。
对于腹部手术的镇痛,TAP技术是一个新颖并且有效的技术,但是关于TAP技术的安全性还需要进一步的研究。目前仍缺乏TAP阻滞腹部镇痛与硬膜外腹部镇痛安全性和有效性的对照研究。
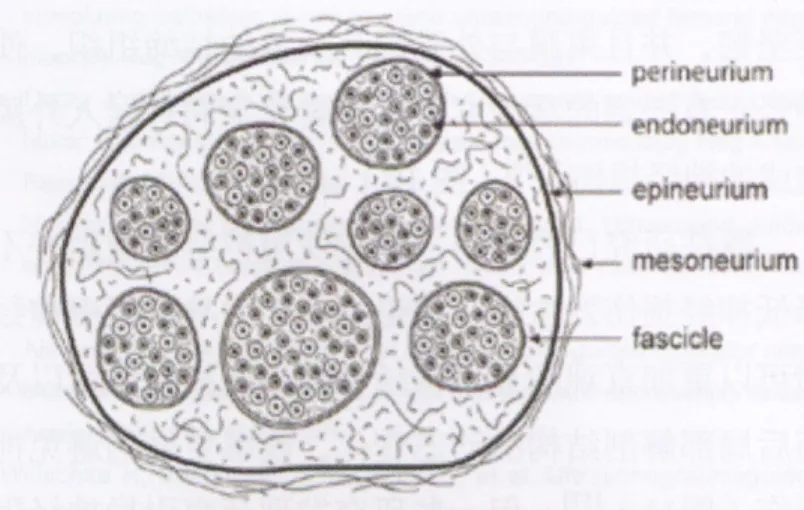
图10 外周神经横断面示意图:神经组织和结缔组织,神经束在结缔组织中有一定的移动度,针刺入时神经束能主动滑开
2.3 硬膜外阻滞
由于超声显示硬膜外腔的能力较差,关于临床中使用超声引导进行硬膜外麻醉是否可行还存在较大争议。目前还没有针对大样本患者使用超声引导进行硬膜外穿刺或置管的研究。可以预见,将超声技术应用于硬膜外麻醉还需要超声设备和技术的进一步发展。
3 超声引导下周围神经阻滞的安全性研究进展
关于超声引导下周围神经阻滞的安全性,目前研究多集中于超声技术对神经损伤发生率的影响。神经损伤可以由穿刺针直接损伤神经引起,也可由神经内注药造成。虽然近年的一些动物实验和临床研究证明,穿刺针误入神经内并不总是引起神经损伤[49-50],也有研究认为神经内注药在大多情况下仅引起神经组织性损伤而非功能性损伤[51], 但由于穿刺针直接损伤神经或局麻药注入后引起的毒性反应以及缺血反应后果严重,如何避免穿刺针误入神经仍是神经阻滞操作中应当给予足够重视的问题[52]。关于穿刺针误入神经后未造成神经损伤的原因,有观点认为是神经束膜比神经外膜起到了更好的保护作用[53-54]。由于神经束膜更坚韧,并且束膜与外膜间有大量的结缔组织,使得神经干有一定的活动度,从而避免穿刺针误入外膜后造成的神经损伤[55-56](图 10)。
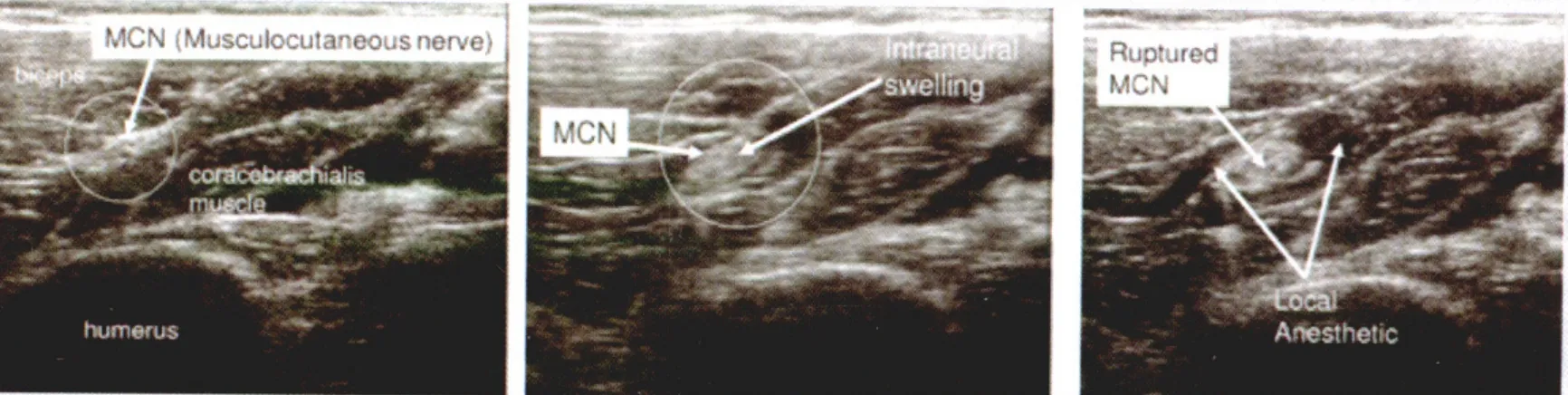
图11 左图:圈内为肌皮神经;中图:神经内注药后神经扩张;右图:神经外膜破裂,局麻药流入周围组织 (该患者术后未发生神经功能损伤)
既往研究已经证明,单纯使用神经刺激器并不能降低神经损伤发生率,理论上超声引导下周围神经阻滞可以更加直观的显示神经和针尖的相对位置以及注药后局部解剖结构的动态变化,能够更好的避免神经损伤(图11)[57],但一些研究发现超声引导神经阻滞并不能有效避免神经内注射[58],也不能有效降低术后神经损伤的发生率[59-60]。Barrington等[61]分析了8 000余例周围神经阻滞患者的数据,发现超声引导、神经刺激或两者联合使用对神经损伤的发生率并无显著影响,而且该调查得到的远期神经损伤的发生率与十年前的相关报道并无显著差异。
超声观察到神经内注药后神经扩张并不能代表神经会发生永久功能性损伤,而且保持针尖始终可见也比较困难[62],所以单纯依靠超声很难有效避免神经损伤的发生。如何及时准确地发现穿刺针误入神经,仍是临床上亟待解决的难题。有相当多的研究试图通过比较神经刺激器阈值电流或穿刺针电阻的变化来判断针尖和神经的位置关系。Tsui等[63]对猪坐骨神经的研究发现,无论在超声引导下穿刺还是直接暴露神经,绝缘穿刺针位于神经内和神经外时的电阻都有明显差别,神经外穿刺针的电阻小于神经内穿刺针,两者的差异有统计学意义。该结论提示可以通过使用神经刺激器监测针体电阻的情况来判断针尖所在位置进而避免神经内注药。Bigeleisen等[64]通过一项前瞻性临床试验研究了超声引导下神经内电刺激和神经外电刺激引发体动反应的阈值,发现当刺激电流小于或等于0.2 mA时如能引出体动反应,则提示穿刺针已经误入神经,而当电流阈值位于0.2 mA~0.5 mA之间时则不能完全排除误入神经的情况。
目前认为超声引导下联合使用神经刺激器监测体动电流阈值和针体电阻的变化,或许是减少神经损伤发生率的不错选择。此外,警惕注药时的高阻力[65-66]并在神经阻滞操作时保持病人处于清醒状态[67]也被认为是避免神经损伤的有效手段。超声技术虽然使周围神经阻滞技术发生了“划时代”的变化,但在安全性方面,仍需结合其他辅助技术和方法,才能有效减少神经损伤的发生。
4 总结
目前超声引导下神经阻滞技术已经广泛地应用于临床麻醉工作中,超声设备的发展使得绝大多数的神经结构都可以清晰地显示。但是目前仍缺乏关于超声引导下神经阻滞的大样本研究,关于其有效性和安全性的研究应该是未来几年的研究重点。可以相信,随着相关实验室研究和临床研究的不断深入以及超声设备的不断完善,周围神经阻滞的有效性和安全性会不断得到提高,成为日趋完美的医疗技术和医学艺术。
[1] Gray,A.T., Ultrasound-guided regional anesthesia: current state of the art[J].Anesthesiology, 2006, 104(2): 368-373.
[2] Pham-Dang,C., Meunier,J.F., Poirier,P., et al.A new axillary approach for continuous brachial plexus block.A clinical and anatomic study[J].Anesth Analg, 1995, 81: 686-693.
[3] Grant SA, Nielsen KC, Greengrass RA, et al.Continuous peripheral nerve block for ambulatory surgery[J].Reg Anesth Pain Med, 2001, 26:209-214.
[4] Selander D..Catheter technique in axillary plexus block[J].Acta Anaesthesiol Scand., 1977, 21(4): 324-329.
[5] Casati A, Fanelli G, Koscielniak-Nielsen Z, et al.Using stimulating catheters for continuous sciatic nerve block shortens onset time of surgical block and minimizes postoperative consumption of pain medication after halux valgus repair as compared with conventional nonstimulating catheters[J].Anesth Analg, 2005, 101(4): 1192-1197.
[6] Morin,AM, Eberhart LH, Behnke HK, et al.Does femoral nerve catheter placement with stimulating catheters improve effective placement? A randomized, controlled, and observer-blinded trial[J].Anesth Analg, 2005,100(5): 1503-1510.
[7] Li M, Xu T, Han WY, et al.Use of ultrasound to facilitate femoral nerve block with stimulating catheter[J].Chin Med J (Engl), 2011,124(4): 519-524.
[8] Thomas LC, Graham SK, Osteen KD, et al.Comparison of ultrasound and nerve stimulation techniques for interscalene brachial plexus block for shoulder surgery in a residency training environment: a randomized,controlled, observer-blinded trial[J].Ochsner J, 2011, 11(3): 246-252.
[9] Bendtsen TF, Nielsen TD, Rohde CV, et al.Ultrasound guidance improves a continuous popliteal sciatic nerve block when compared with nerve stimulation[J].Reg Anesth Pain Med, 2011, 36(2): 181-184.
[10] McNaught A, Shastri U, Carmichael N, et al.Ultrasound reduces the minimum effective local anaesthetic volume compared with peripheral nerve stimulation for interscalene block[J].Br J Anaesth, 2011, 106(1):124-130.
[11] Denny NM, Harrop-Griffiths W.Location, location, location! Ultrasound imaging in regional anaesthesia[J].Br J Anaesth, 2005, 94(1): 1-3.
[12] Eichenberger U, Stockli S, Marhofer P, et al.Minimal local anesthetic volume for peripheral nerve block: a new ultrasoundguided, nerve dimension-based method[J].Reg Anesth Pain Med, 2009, 34: 242–246.
[13] Latzke D, Marhofer P, Zeitlinger M, et al.Minimal local anaesthetic volumes for sciatic nerve blockade: evaluation of ED99 in volunteers[J].Br J Anaesth, 2010, 104: 239-244.
[14] O’Donnell BD, Iohom G.An estimation of the minimum effective anesthetic volume of 2% lidocaine in ultrasound-guided axillary brachial plexus block[J].Anesthesiology, 2009,111: 25-29.
[15] Kapral S, Greher M, Huber G, et al.Ultrasonographic guidance improves the success rate of interscalene brachial plexus blockade[J].Reg Anesth Pain Med, 2008, 33: 253-258.
[16] Marhofer P, Sitzwohl C, Greher M, et al.Ultrasound guidance for infraclavicular brachial plexus anaesthesia in children[J].Anaesthesia,2004, 59: 642-646.
[17] Perlas A, Brull R, Chan VW, et al.Ultrasound guidance improves the success of sciatic nerve block at the popliteal fossa[J].Reg Anesth Pain Med, 2008, 33: 259-265.
[18] Redborg KE, Antonakakis JG, Beach ML, et al.Ultrasound improves the success rate of a tibial nerve block at the ankle[J].Reg Anesth Pain Med,2009, 34: 256–260.
[19] Oberndorfer U, Marhofer P, Bosenberg A, et al.Ultrasonographic guidance for sciatic and femoral nerve blocks in children[J].Br J Anaesth,2007, 98: 797–801.
[20] Danelli G, Fanelli A, Ghisi D, et al.Ultrasound vs nerve stimulation multiple injection technique for posterior popliteal sciatic nerve block[J].Anaesthesia, 2009, 64: 638-642.
[21] van Geffen GJ, Rettig HC, Koornwinder T, et al.Ultrasound-guided training in the performance of brachial plexus block by the posterior approach: an observational study[J].Anaesthesia, 2007, 62: 1024-1028.
[22] Meier G, Bauereis C, Heinrich C.Interscalene brachial plexus catheter for anesthesia and postoperative pain therapy.Experience with a modified technique[J].Anaesthesist, 1997, 46: 715–719.
[23] Soares LG, Brull R, Lai J, et al.Eight ball, corner pocket: the optimal needle position for ultrasound-guided supraclavicular block[J].Reg Anesth Pain Med, 2007, 32: 94–95.
[24] Duggan E, El Beheiry H, Perlas A, et al.Minimum effective volume of local anesthetic for ultrasound-guided supraclavicular brachial plexus block[J].Reg Anesth Pain Med, 2009, 34: 215-218.
[25] Moayeri N, Bigeleisen PE, Groen GJ.Quantitative architecture of the brachial plexus and surrounding compartments, and their possible significance for plexus blocks[J].Anesthesiology, 2008, 108: 299–304.
[26] Fredrickson MJ, Patel A, Young S, et al.Speed of onset of ‘corner pocket supraclavicular’ and infraclavicular ultrasound guided brachial plexus block: a randomised observerblinded comparison[J].Anaesthesia,2009, 64: 738-744.
[27] Koscielniak-Nielsen ZJ, Frederiksen BS, Rasmussen H, et al.A comparison of ultrasound-guided supraclavicular and infraclavicular blocks for upper extremity surgery[J].Acta Anaesthesiol Scand, 2009, 53:620–626.
[28] Christophe JL, Berthier F, Boillot A, et al.Assessment of topographic brachial plexus nerves variations at the axilla using ultrasonography[J].Br J Anaesth, 2009, 103: 606-612.
[29] Handoll HH, Koscielniak-Nielsen ZJ.Single, double or multiple injection techniques for axillary brachial plexus block for hand, wrist or forearm surgery[J].Cochrane Database Syst Rev, 2006, 25(1): CD003842.
[30] Chan VW, Perlas A, McCartney CJ, et al.Ultrasound guidance improves success rate of axillary brachial plexus block[J].Can J Anaesth, 2007,54: 176-182.
[31] Moayeri N, Bigeleisen PE, Groen GJ.Quantitative architecture of the brachial plexus and surrounding compartments, and their possible significance for plexus blocks[J].Anesthesiology, 2008, 108: 299-304.
[32] Karmakar MK, Ho AM, Li X, et al.Ultrasound-guided lumbar plexus block through the acoustic window of the lumbar ultrasound trident[J].Br J Anaesth, 2008, 100: 533-537.
[33] Niazi AU, Prasad A, Ramlogan R.Methods to ease placement of stimulating catheters during in-plane ultrasound-guided femoral nerve block[J].Reg Anesth Pain Med, 2009, 34: 380-381.
[34] Dolan J, Williams A, Murney E, et al.Ultrasound guided fascia iliaca block: a comparison with the loss of resistance technique[J].Reg Anesth Pain Med, 2008, 33: 526-531.
[35] Helayel PE, da Conceicao DB, Pavei P, et al.Ultrasound-guided obturator nerve block: a preliminary report of a case series[J].Reg Anesth Pain Med, 2007, 32: 221-226.
[36] Akkaya T, Ozturk E, Comert A, et al.Ultrasound-guided obturator nerve block: a sonoanatomic study of a new methodologic approach[J].Anesth Analg, 2009, 108: 1037-1041.
[37] Willschke H, Bosenberg A, Marhofer P, et al.Ultrasonographicguided ilioinguinal/iliohypogastric nerve block in pediatric anesthesia: what is the optimal volume? [J] Anesth Analg, 2006, 102: 1680-1684.
[38] Eichenberger U, Greher M, Kirchmair L, et al.Ultrasound-guided blocks of the ilioinguinal and iliohypogastric nerve: accuracy of a selective new technique confirmed by anatomical dissection[J].Br J Anaesth, 2006, 97:238-243.
[39] Willschke H, Bosenberg A, Marhofer P, et al.Ultrasonographicguided ilioinguinal/iliohypogastric nerve block in pediatric anesthesia: what is the optimal volume? [J] Anesth Analg, 2006, 102: 1680-1684.
[40] Carney J, McDonnell JG, Ochana A, et al.The transversus abdominis plane block provides effective postoperative analgesia in patients undergoing total abdominal hysterectomy[J].Anesth Analg, 2008, 107:2056-2060.
[41] McDonnell JG, Curley G, Carney J, et al.The analgesic efficacy of transversus abdominis plane block after cesarean delivery: a randomized controlled trial[J].Anesth Analg, 2008, 106: 186-191.
[42] McDonnell JG, O’Donnell B, Curley G, et al.The analgesic efficacy of transversus abdominis plane block after abdominal surgery: a prospective randomized controlled trial[J].Anesth Analg, 2007, 104: 193-197.
[43] O’Donnell BD, McDonnell JG, McShane AJ.The transverses abdominis plane (TAP) block in open retropubic prostatectomy[J].Reg Anesth Pain Med, 2006, 31: 91.
[44] Shibata Y, Sato Y, Fujiwara Y, et al.Transversus abdominis plane block[J].Anesth Analg, 2007, 105: 883.
[45] Tran TM, Ivanusic JJ, Hebbard P, et al.Determination of spread of injectate after ultrasound-guided transversus abdominis plane block: a cadaveric study[J].Br J Anaesth, 2009, 102: 123-127.
[46] Belavy D, Cowlishaw PJ, Howes M, et al.Ultrasound-guided transversus abdominis plane block for analgesia after Caesarean delivery[J].Br J Anaesth, 2009, 103: 726-730.
[47] El-Dawlatly AA, Turkistani A, Kettner SC, et al.Ultrasound-guided transversus abdominis plane block: description of a new technique and comparison with conventional systemic analgesia during laparoscopic cholecystectomy[J].Br J Anaesth, 2009, 102: 763-767.
[48] Niraj G, Searle A, Mathews M, et al.Analgesic efficacy of ultrasoundguided transversus abdominis plane block in patients undergoing open appendicectomy[J].Br J Anaesth, 2009, 103: 601-605.
[49] Bigeleisen PE.Nerve puncture and apparent intraneural injection during ultrasound-guided axillary block does not invariably result in neurologic injury[J].Anesthesiology, 2006, 105(4): 779-783.
[50] Brull R, Chan VW, McCartney CJ, et al.Ultrasound detects intraneural injection (letter) [J].Anesthesiology,2007, 106: 1244.
[51] Lupu CM, Kiehl TR, Chan VW, et al.Nerve Expansion Seen on Ultrasound Predicts Histologic But Not Functional Nerve Injury After Intraneural Injection in Pigs[J].Regional Anesthesia and Pain Medicine,2010, 35(2): 132-139.
[52] Bigeleisen PE, Moayeri N, Groen GJ.Extraneural versus intraneural stimulation thresholds during ultrasoundguided supraclavicular block[J].Anesthesiology, 2009, 110: 1235-1243.
[53] Borgeat A.Regional anesthesia, intraneural injection, and nerve injury beyond the epineurium[J].Anesthesiology, 2006, 105: 647-648.
[54] Hadzic A, Dilberovic F, Shah S, et al.Combination of intraneural injection and high injection pressure leads to fascicular injury and neurologic deficits in dogs[J].Reg Anesth Pain Med, 2004, 29: 417-423.
[55] Sala-Blanch X, Ribalta T, Rivas E, et al.Structural injury to the human sciatic nerve after intraneural needle insertion[J].Reg Anesth Pain Med,2009, 34: 201-205.
[56] Moayeri N, Bigeleisen PE, Groen GJ.Quantitative architecture of the brachial plexus and surrounding compartments, and their possible significance for plexus blocks[J].Anesthesiology, 2008, 108: 299-304.
[57] Russon K, Blanco R.Accidental Intraneural Injection into the Musculocutaneous Nerve Visualized with Ultrasound[J].Anesth & Analg,2007, 105(5): 1504-1505.
[58] Liu SS, YaDeau JT, Shaw PM, et al.Incidence of unintentional intraneural injection and postoperative neurological complications with ultrasoundguided interscalene and supraclavicular nerve blocks[J].Anaesthesia, 2011, 66(3): 168-174.
[59] Liu SS, Ngeow JE, YaDeau JT.Ultrasound-guided regional anesthesia and analgesia.A quantitative systematic review[J].Reg Anesth Pain Med,2009, 34: 47-59.
[60] Neal JM, Brull R, Chan VWS, et al.The ASRA evidence-based medicine assessment of ultrasound-guided regional anesthesia and pain medicine:executive summary[J].Reg Anesth Pain Med, 2010, 35: S1-S9.
[61] Barrington MJ, Watts SA, Gledhill SR, et al.Preliminary results of the Australasian Regional Anaesthesia Collaboration.A prospective audit of over 7000 peripheral nerve and plexus blocks for neurological and other complications[J].Reg Anesth Pain Med, 2009, 34: 534-541.
[62] Chin KJ, Brull R, Perlas A, et al.Needle visualization in ultrasoundguided regional anesthesia: challenges and solutions[J].Reg Anesth Pain Med, 2008, 33: 532-544.
[63] Tsui BC, Pillay JJ, Chu KT, et al.Electrical Impedance to Distinguish Intraneural from Extraneural Needle Placement in Porcine Nerves during Direct Exposure and Ultrasound Guidance[J].Anesthesiology, 2008,109(3): 479-483.
[64] Paul E.Bigeleisen, Nizar Moayeri, Gerbrand J.et al.Extraneural versus Intraneural Stimulation Thresholds during Ultrasound-guided Supraclavicular Block[J].Anesthesiology, 2009, 110: 1235-1243.
[65] Hadzic A, Dilberovic F, Shah S, et al.Combination of intraneural injection and high injection pressure leads to fascicular injury and neurologic deficits in dogs[J].Reg Anesth Pain Med, 2004, 29: 417-423.
[66] Kapur E, Vuckovic I, Dilberovic F, et al.Neurologic and histologic outcome after intraneural injections of lidocaine in canine sciatic nerves[J].Acta Anaesthesiol Scand, 2007, 51: 101-107.
[67] Bernards CM, Hadzic A, Suresh S, et al.Regional anesthesia in anesthetized or heavily sedated patients[J].Reg Anesth Pain Med, 2008,33: 449-460.
