甲醇制丙烯反应的热力学研究
2011-11-09吴文章郭文瑶肖文德阎建民
吴文章,郭文瑶,肖文德,,阎建民,罗 漫
(1.华东理工大学 国家联合化学工程重点实验室,上海 200237;2.上海交通大学 化学化工学院,上海 200240)
甲醇制丙烯反应的热力学研究
吴文章1,郭文瑶2,肖文德1,2,阎建民2,罗 漫2
(1.华东理工大学 国家联合化学工程重点实验室,上海 200237;2.上海交通大学 化学化工学院,上海 200240)
对基于ZSM-5分子筛催化剂的甲醇制丙烯反应体系进行了热力学分析,计算了不同温度下各反应的反应焓变、吉布斯自由能变和反应平衡常数,采用最小自由能法计算了C2~6烯烃的热力学平衡组成。计算结果表明,烯烃甲基化反应为放热反应,烯烃裂化反应为吸热反应,甲醇生成丙烯反应的放热量约为30 kJ/mol;烯烃甲基化可视为不可逆反应,烯烃裂化为可逆反应。不同甲醇分压下均存在最佳反应温度,使丙烯平衡组成最高,平衡质量分数接近40%。采用小孔分子筛催化剂可有效提高丙烯平衡组成。
甲醇;丙烯;甲醇制丙烯;热力学;烯烃平衡
研究开发甲醇制烯烃(MTO)和甲醇制丙烯(MTP)工艺可以使烯烃生产摆脱石油原料的影响且节约生产成本[1-2],因为甲醇可以由煤或天然气经合成气进行大规模生产。MTO/MTP过程所涉及的反应主要包括甲醇脱水生成二甲醚、甲醇或二甲醚生成一系列不同碳数分布的烯烃。此外,不同碳数烯烃之间存在相互转化反应,烯烃之间还可以发生氢转移反应生成烷烃和芳烃。
MTO反应及烯烃之间反应的热力学研究已有文献报道[3-5],但所考察的反应基于小孔分子筛催化体系,主反应为甲醇平行生成C2~4烯烃的反应,烃类产物的最高碳数小于5。而基于中孔分子筛催化体系的 MTP主反应是甲基链增长和裂化反应[6-9],烃类产物的最高碳数可达9。由于反应体系及反应组分不同,因此MTP反应的热力学与MTO反应的热力学有差异,需要对其进行深入研究。
本工作计算了基于中孔分子筛催化剂的MTP反应体系主副反应的反应焓变、吉布斯自由能变、平衡常数以及C2~6烯烃之间的热力学平衡分布,并从热力学角度分析了反应条件对MTP反应的影响,提出了最优丙烯平衡组成的反应条件。
1 计算原理和方法
基于中孔分子筛催化剂的MTP主反应包括甲醇生成二甲醚、初始烯烃生成、甲基化和裂化反应;副反应包括烯烃叠合裂化反应、烯烃芳构化反应、芳烃歧化反应、烯烃加氢生成烷烃反应和甲醇分解反应。主副反应涉及主要组分包括C8以下烯烃和烷烃、二甲醚、甲苯、二甲苯和三甲苯等。MTP主副反应如下。
主反应:

副反应:

相关组分的标准生成焓、标准吉布斯自由能、摩尔定压热容数据见表1。

表1 MTP反应的相关组分的热力学数据[10-12]Table1 Thermodynamic data of some substances for methanol to propylene(MTP)[10-12]
进行反应(1)~(31)的热力学计算时,具有多个同分异构体的烯烃或烷烃的热力学数据都以相应的正构烯烃或烷烃计。二甲苯、三甲苯的热力学数据分别取邻二甲苯、1,2,3-三甲苯的相应热力学参数。
温度T下各反应的反应焓变由式(32)计算:
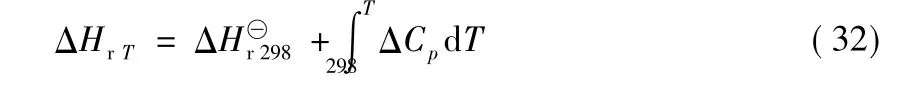
其中,ΔCp=Δa+ΔbT+ΔcT2+ΔdT3+ΔeT4。温度T下各反应的吉布斯自由能变可由吉布斯-亥姆霍兹方程[13]得出:

MTP过程中,当甲醇完全转化后,烯烃之间可发生相互转化反应达到热力学平衡。产物检测表明,烯烃产物主要包括C2~6烯烃,故只考虑C2~6烯烃之间的热力学平衡。MTP体系中C2~6烯烃之间相互转化的反应网络复杂,热力学平衡组成计算采用平衡常数联立方程组法十分繁琐,而采用系统最小自由能法则快捷简便[14]。计算基于以下两点假设:(1)由于反应体系高温低压,所有气相组分按理想气体考虑;(2)烷烃和芳烃在MTP反应中生成速率比较慢,按惰性气体考虑。
在系统压力为pt、存在y mol惰性稀释剂(例如水)的条件下,100 mol甲醇完全转化生成烯烃时C2~6烯烃的总吉布斯自由能计算[13]如下:
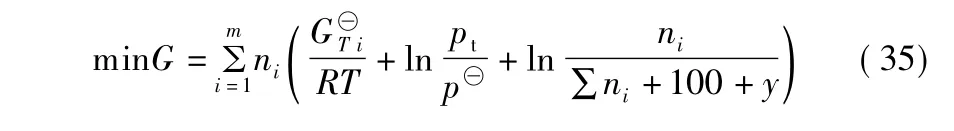
约束条件:∑niMi=100,ni>0。G⊖Ti表示纯气相物质i在温度T时的标准自由能,可以由式(36)[13]计算:

所有丁烯的同分异构体(4种)和戊烯的同分异构体(6种)都作为单独组分计算,己烯的热力学参数取反式2-己烯,它在己烯同分异构体中具有最小的吉布斯自由能,用此数据计算所得C6烯烃的平衡组成应高于实际平衡组成(相关热力学数据来自文献[12])。
式(35)的优化变量是C2~6烯烃各组分的物质的量。采用数值方法迭代计算,由Matlab程序内置Fmincon函数计算各组分的物质的量,将计算得到的各组分的物质的量再转化成质量分数进一步分析。
2 结果与讨论
2.1 MTP各反应的反应焓变
不同温度下反应(1)~(31)的反应焓变见表2。由表 2可见,各个反应的反应焓变在 350~550℃内变化很小,可以认为是常数;同一类型反应的反应焓变随碳数变化也不大;烯烃甲基化反应(反应(3)~(8))都是放热反应,反应焓变为-69.0~-53.1 kJ/mol;烯烃裂化反应(反应(9)~(14))都为强吸热反应,反应焓变为 75.5~103.0 kJ/mol;烯烃叠合裂化反应(15)和(16)为弱放热反应,反应焓变较小,为 -2.44~-0.55 kJ/ mol;高碳烯烃脱氢芳构化反应(17)和(18)为强吸热反应,反应焓变为108.8~123.8 kJ/mol,但芳烃的甲基化反应(19)和(20)为放热反应,反应焓变为-67.7~-61.5 kJ/mol;烯烃加氢生成烷烃反应(反应(22)~(28))都是剧烈的强放热反应,反应焓变为-143.1~-127.4 kJ/mol。
甲醇转化生成不同碳数烯烃的反应焓变可由反应(1)~(8)叠加得到。每摩尔甲醇生成丙烯的反应焓变由反应(2)和(3)叠加,350~550℃范围内为-30.5~-29.7 kJ。生成烯烃的碳数越高,反应放热越多。450℃时每摩尔甲醇生成C4,C5,C6,C7,C8烯烃的反应焓变分别为 -36.4,-40.3,-43.3,-44.9,-46.0 kJ。烯烃加氢生成烷烃的反应焓变表明,甲醇转化过程中的烯烃若继续发生氢转移反应生成烷烃,则反应放热量更大。固定床中进行MTP反应时,应合理控制反应条件,以避免因生成高碳烯烃和烷烃的副反应使得反应器超温。
2.2 M TP各反应的反应吉布斯自由能变及平衡常数
不同温度下反应(1)~(31)的吉布斯自由能变和平衡常数见表2。由表2可见,大多数反应在350~550℃范围内吉布斯自由能变为负值,表明反应能自发进行。反应(12)~(14)在高温(550℃)下的吉布斯自由能变均为负值。己烯裂化生成丙烯(反应(12))在350℃下可自发进行,而戊烯裂化生成乙烯和丙烯(反应(13))需在450℃时才能自发进行,丁烯裂化生成乙烯(反应(14))则需550℃时方可自发进行。

表2 不同温度下各反应的反应焓变、吉布斯自由能变和平衡常数Table 2 Enthalpy changes(ΔH rT),Gibbs free energy changes(ΔG rT)and thermodynamic equilibrium constants(K)from reactions(1)to(31)at various temperatures
甲醇脱水生成二甲醚反应(1)的平衡常数较小,且随反应温度的升高平衡常数减小。反应(2)~(8)、(19)和(20)的平衡常数均大于1 000,这说明烯烃和芳烃的甲基化反应几乎可以进行完全,均可视为不可逆反应。
裂化反应(9)~(14)的平衡常数较甲基化反应小得多,但随反应温度的升高而增大。反应温度高于450℃时,C8烯烃裂化反应(9)和(10)以及C7烯烃裂化反应(11)的平衡常数均大于32,反应平衡转化率较高。己烯裂化反应(12)的平衡常数低于C7烯烃裂化反应,反应温度从350℃升至450℃时,平衡常数从2.42升至20.7。戊烯裂化反应(13)受热力学限制,350℃时平衡常数为0.237,450℃时平衡常数达2.65。丁烯裂化反应(14)的平衡常数较戊烯裂化反应低得多,350℃以下丁烯裂化反应可以忽略,温度达到550℃时,丁烯裂化反应平衡常数才达1.55。反应(15)和(16)的平衡常数较小(小于2),且随反应温度变化不明显,表明丁烯和戊烯叠合裂化反应受热力学平衡限制,不能进行完全。烯烃的裂化反应和叠合裂化反应受热力学平衡限制,为可逆反应。
烯烃加氢生成烷烃反应(22)~(28)的平衡常数都很大,350℃时平衡常数均大于1 000,但随反应温度升高平衡常数显著下降。高碳烯烃脱氢芳构化反应(17)和(18)的平衡常数很大(大于1 000),热力学上极易进行。二甲苯歧化反应(21)的平衡常数接近1,受热力学平衡限制。甲醇分解副反应(29)和(30)的平衡常数很大(大于1 000),均可视为不可逆反应。水气变换反应(31)的平衡常数较小(小于20.4),受热力学平衡限制CO不能完全转化。
2.3 烯烃的热力学平衡组成计算
由式(35)和(36)计算了含有惰性稀释剂时不同甲醇分压下烯烃的最终热力学平衡组成随反应温度的变化,计算结果见图1。
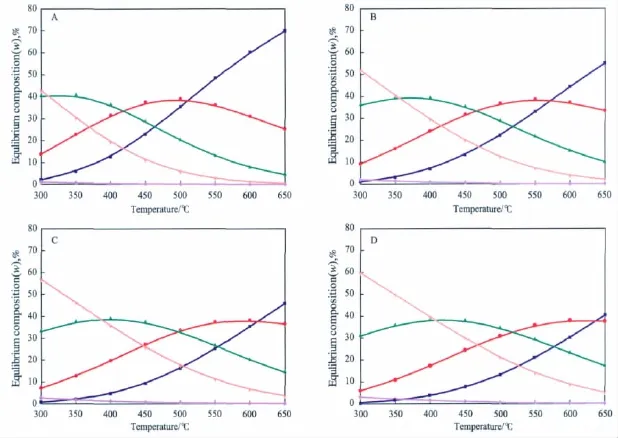
图1 不同甲醇分压下烯烃最终平衡组成与反应温度的关系Fig.1 Equilibrium compositions of the light olefins as a function of reaction temperature.p(MeOH)/kPa:A 5;B 20;C 50;D 100
由图1可看出,反应温度对平衡组成影响很大。同一甲醇分压下,乙烯平衡组成随反应温度的升高而增大;C5~6烯烃平衡组成随反应温度的升高而下降;丙烯和丁烯平衡组成随反应温度的升高呈先上升后下降的趋势。
改变甲醇分压也会改变烯烃最终热力学平衡组成。如图1所示,甲醇分压降低,相同温度下乙烯的平衡组成增大而C5~6烯烃平衡组成减小。对于丙烯和丁烯,最大丙烯或丁烯平衡组成对应的温度随甲醇分压降低而降低。
对于MTP过程,总希望选择合适的反应条件使得丙烯收率最高。不同甲醇分压下最高丙烯平衡组成及其对应的反应温度见图2。由图2可看出,最高丙烯平衡组成接近40%(质量分数),且随甲醇分压的增大略有下降,但对应的最佳反应温度则快速升高。MTP过程中,保持甲醇分压和反应温度满足图2的关系可使丙烯平衡组成最高。
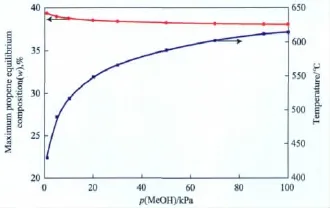
图2 不同甲醇分压下最高丙烯平衡组成及其对应的反应温度Fig.2 The optimal propene equilibrium compositions and reaction temperatures at various methanol partial pressures.
当然,选择合适的MTP反应条件还需结合其他烯烃产物平衡组成进行分析。最高丙烯平衡组成反应条件下各烯烃的组成见表3。由表3可见,乙烯、丁烯平衡组成在不同的最高丙烯平衡组成反应条件下几乎不变。戊烯平衡组成缓慢上升,丙烯与乙烯的比(P/E比)也几乎不变。甲醇分压为3~10 kPa、对应反应温度469~519℃时P/E比相对略高。实际上,分子筛催化MTP反应时,过高的甲醇分压(大于20 kPa)对应的最高丙烯平衡组成温度也过高(高于550℃),这会导致催化剂积碳失活严重,也会加剧甲醇分解等副反应;而过低的甲醇分压又会导致反应效率低。因此,根据烯烃平衡热力学分析,甲醇分压3~20 kPa、对应温度469~550℃时对MTP反应最有利。

表3 最高丙烯平衡组成反应条件下各烯烃的平衡组成Table 3 Equilibrium compositions of the olefins under the reaction conditions for the maximum propene equilibrium yield
采用小孔分子筛催化剂(如SAPO-34分子筛)时,由于分子筛孔道的择形限制,戊烯和己烯将不存在于反应体系中,这时丙烯的平衡组成在不同甲醇分压下也存在最佳温度[3],使得丙烯平衡组成最高。不考虑戊烯和己烯时,不同甲醇分压下最高丙烯平衡组成反应条件下各烯烃的平衡组成见表4。
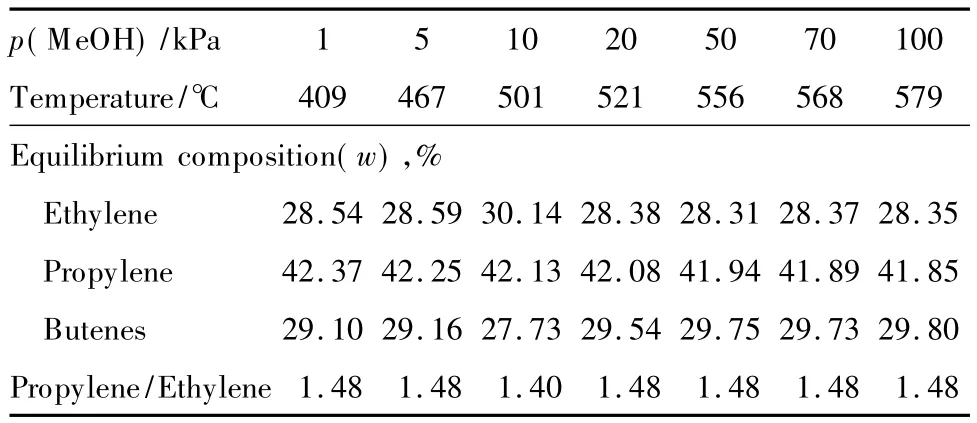
表4 不存在戊烯和己烯时最高丙烯平衡组成反应条件下各烯烃的平衡组成Table 4 Equilibrium compositions of the olefins under the reaction conditions for the maximum propene equilibrium composition without regard to pentenes and hexenes
由表4可见,当采用小孔分子筛催化剂时,最高丙烯平衡组成比采用中孔分子筛催化剂时略高,P/ E比也有所提高,而且不同甲醇分压下最高丙烯平衡组成对应的反应温度下降了20~30℃,这有利于在较高甲醇分压下进行反应。烯烃热力学平衡分析表明,采用小孔分子筛催化剂对MTP反应更有利,但小孔分子筛催化剂失活较快[15],需要采用流化床反应-再生装置,导致催化剂的损耗和反应器开发成本增加。而采用ZSM-5中孔分子筛催化剂时,由于催化剂稳定性好,MTP反应可采用固定床反应器。采用哪种催化剂有利还需结合全流程进行经济技术分析。
3 结论
(1)在MTP过程中,烯烃的甲基化反应为放热反应,裂化反应为吸热反应。甲醇生成丙烯的反应放热量为29.7~30.5 kJ/mol。甲醇生成高碳烯烃和烷烃的副反应会使MTP过程放热更加剧烈。
(2)烯烃甲基化反应可视为不可逆反应,而烯烃裂化反应受热力学平衡限制。高温有利于高碳烯烃裂化生成低碳烯烃。
(3)不同甲醇分压下均存在最佳反应温度,使得丙烯平衡组成最高。甲醇分压3~20 kPa、对应温度469~550℃最有利于生成丙烯。采用小孔分子筛催化剂可提高丙烯的最高平衡组成。
符 号 说 明


[1] 柯丽,冯静,张明森.甲醇转化制烯烃技术的新进展[J].石油化工,2006,35(3):205-211.
[2] 毛东森,郭强胜,卢冠忠.甲醇转化制丙烯技术进展[J].石油化工,2008,37(12):1328-1333.
[3] 齐国祯,谢在库,钟思青,等.甲醇制低碳烯烃(MTO)反应热力学研究[J].石油与天然气化工,2005,34(5):349-353.
[4] 杨明平,罗娟.甲醇制低碳烯烃反应体系的热力学计算与分析[J].煤化工,2008,36(3):44-48.
[5] 李晓红,齐国祯,王菊,等.丁烯/甲醇耦合反应制乙烯和丙烯的热力学[J].石油学报(石油加工),2009,25(4):533-539.
[6] Dessau R M.On the H-ZSM-5 Catalyzed Formation of Ethylene from Methanol or Higher Olefins[J].J Catal,1986,99(1):111-116.
[7] Svelle S,Joensen F,Nerlov J,et al.Conversion of Methanol into Hydrocarbons over Zeolite H-ZSM-5:Ethene Formation Is Mechanistically Separated from the Formation of Higher Alkenes[J].JAm Chem Soc,2006,128(46):14770-14771.
[8] Svelle S,Olsbye U,Joensen F,et al.Conversion of Methanol to Alkenes over Medium-and Large-Pore Acidic Zeolites:Steric Manipulation of the Reaction Intermediates Governs the Ethene/ Propene Product Selectivity[J].J Phys Chem C,2007,111 (49):17981-17984.
[9] 吴文章,郭文瑶,肖文德,等.甲醇制丙烯过程的主导反应机理[C]//中国化工学会.第六届全国化学工程与生物化工年会会议论文摘要集.长沙:中国化工学会,2010:890.
[10] Yaws C L.Chemical Properties Handbook[M].New York:McGraw-Hill,1999:20-50.
[11] 时钧,汪家鼎,余国琮,等.化学工程手册[M].第2版.北京:化学工业出版社,1996:1-79-1-90.
[12] Lange N A,Dean JA.Handbook of Lange Chemistry[M].15th ed.New York:McGraw-Hill,1999:6-5-6-50.
[13] Smith JM,Ness H C V,AbbottM M.Introduction to Chemical Engineering Thermodynamics[M].6th ed.New York:McGraw-Hill,2001:476-509.
[14] 汤效平,周华群,魏飞,等.催化裂化多产丙烯过程热力学分析[J].石油学报(石油加工),2008,24(1):22-27.
[15] 齐国祯,谢在库,钟思青,等.甲醇制烯烃反应副产物的生成规律分析[J].石油与天然气化工,2006,35(1):5-9.
Thermodynamic Study on M ethanol Conversion to Propylene
Wu Wenzhang1,Guo Wenyao2,Xiao Wende1,2,Yan Jianmin2,Luo Man2
(1.UNILAB,State Key Laboratory of Chemical Reaction Engineering,East China University of Science and Technology,Shanghai200237,China;2.School of Chemistry and Chemical Engineering,Shanghai Jiao Tong University,Shanghai200240,China)
Thermodynamic analysis of the methanol to propylene(MTP)process based on ZSM-5 catalysts has been carried out.For each reaction,enthalpy change,Gibbs free energy change and equilibrium constant at varying temperatures were presented.The thermodynamic equilibrium between C2-6alkenes was analyzed by the method of minimum Gibbs free energy.The results indicated that alkenemethylation is exothermic whereas alkene cracking is endothermic;one mole of methanol releases about 30 kJ heat when converted to propylene;alkene methylation is virtually irreversible but alkene cracking is limited by thermodynamic equilibrium.For eachmethanol partial pressure in MTP,there always exists an optimum temperature at which the propylene content is maximal among the final equilibrium compositions of C2-6olefins.The maximum propylene mass fraction is close to 40%(w).Higher propylene equilibrium composition can be obtained by using small poremolecular sieves as the catalyst.
methanol;propylene;methanol to propylene;thermodynamics;olefin equilibrium
1000-8144(2011)05-0499-07
TQ 013.1
A
2010-12-08;[修改稿日期]2011-01-20。
吴文章(1985—),男,安徽省桐城市人,博士生,电话021-34203757,电邮 wenzhangwu@mail.ecust.edu.cn。联系人:肖文德,电话021-34203788,电邮wdxiao@sjtu.edu.cn。
(编辑 王 萍)
