链接基团对固载手性Salen Mn(Ⅱ)催化不对称环氧化反应的影响
2011-11-09罗云飞傅相锴邹晓川王长炜胡小艳贾紫永张怀志
罗云飞 傅相锴*, 邹晓川,2 王长炜 胡小艳 贾紫永 张怀志
(1西南大学化学化工学院,应用化学研究所,重庆市应用化学重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
(2重庆教育学院生物化学工程系,重庆 400067)
链接基团对固载手性Salen Mn(Ⅱ)催化不对称环氧化反应的影响
罗云飞1傅相锴*,1邹晓川1,2王长炜1胡小艳1贾紫永1张怀志1
(1西南大学化学化工学院,应用化学研究所,重庆市应用化学重点实验室,三峡库区生态环境教育部重点实验室,重庆 400715)
(2重庆教育学院生物化学工程系,重庆 400067)
制备了二胺和二酚修饰的晶态有机聚合物-无机杂化载体低聚苯乙烯基膦酸-膦酸氢锆(LCZSPP)轴向固载手性Salen Mn(Ⅱ)催化剂,将其应用于非官能烯烃的多相不对称环氧化反应。研究了两类轴向连接基团及助催化剂在催化不对称环氧化反应中的影响。结果表明,通过二胺为链接基团固载的催化剂在加入轴向助剂(NMO)的情况下,转化率和对映选择性都有较大提高。然而,与文献报道相反,二酚固载的催化剂在不添加轴向助剂的情况下,转化率和对映选择性都比添加轴向助剂有明显提高。此外,制备的固载催化剂可以很容易从反应体系中分离出来,并且在重复使用10次以上后,催化活性和对映选择性都没有明显的降低。
低聚苯乙烯基膦酸-膦酸氢锆;手性Salen Mn(Ⅱ);多相催化剂;非官能化烯烃的不对称环氧化反应;轴向助催化剂
0 引 言
具有光学活性的环氧化物是合成许多天然产物、光学活性材料、光学活性药物等重要有机合成中间体。现已成为当今研究的热门课题之一。手性环氧化物是合成纯的对映体分子的重要模块,可以通过选择性开环和官能团转化方便地合成许多医药和精细化学品的重要中间体,特别是在合成药物、生物活性化合物中有重要的应用[1-2]。目前制备手性环氧化物最重要的方法是烯烃的催化环氧化,而常用的催化剂为过渡金属卟啉、酞菁以及Salen等的配合物[3-4]。人们发现手性Salen Mn(Ⅱ)配合物是非官能化烯烃不对称环氧化反应最有效的催化剂[5-6],然而,均相催化剂存在着难以分离,容易形成Salen Mn(Ⅱ)的μ-oxo-Mn(Ⅱ)无催化活性二聚体,造成其不能循环使用,限制了它的广泛应用[7]。为解决这一问题,目前,已成功地将此类配合物负载到无机、有机或者有机-无机复合载体上,并且部分地实现了催化剂的循环使用[8~10]。更值得指出的是,在大多数情况下,固载型Salen Mn(Ⅱ)催化剂均需要在昂贵的助催化剂参与下才能对非功能化烯烃的不对称环氧化起到促进作用[11-13],这就使其在工业化应用中失去了意义。因此,研究助催化剂在不对称环氧化反应中的作用机理,以及设计一类在没有昂贵助催化剂参与下使环氧化反应顺利进行的多相催化剂具有非常重要的工业意义。
近年来,本课题组探索合成了有机聚合物-无机杂化磷酸锆新型催化剂载体系列ZSPP、ZPS-iPPA和ZPS-PVPA,采用侧链接枝或轴向配位固载技术合成了这些载体固载的手性Salen Mn(Ⅱ)多相催化剂,在催化烯烃的不对称环氧化反应中显示了优良的催化活性、对映选择性和卓越的重复使用性[14-22]。但ZSPP、ZPS-iPPA和ZPS-PVPA聚苯乙烯基膦酸-磷酸氢锆系列载体均为无定型。本工作探索合成了晶态低聚苯乙烯基膦酸-磷酸氢锆复合载体,并分别用有机二胺和二酚作为连接手臂,与手性Salen Mn(Ⅱ)进行轴向配位固载。详细考察了两种不同的连接手臂及助催化剂对非功能化烯烃不对称环氧化反应催化性能的影响。
1 实验部分
1.1 仪器和试剂
PK-6000型FTIR红外光谱仪;DR UV-2550型紫外可见分光光度计;TAS-986G型原子吸收分光光度计;KYKY-EM3200型扫描电子显微镜;美国vecco公司原子显微镜(AFM);采用日本岛津公司GC-2014型气相色谱仪对反应进行测定。通过与标准产物比较计算产率及对映选择性(ee)值。氢火焰离子化检测器,N2为载气。色谱柱为手性毛细管(HP19091G-B233,30 m×25 μm×0.25 μm),采用程序升温程序,其中α-甲基苯乙烯(柱箱温度:80℃,汽化温度:230℃,检测器温度:250℃,载气流速:34.0 mL·min-1,分流比:30.0)茚(柱箱温度:80℃,汽化温度:230℃,检测器温度:230℃,载气流速:24.0 mL·min-1,分流比:30.0)
壬烷、N-甲基吗啉氮氧化物 (NMO)、(1R,2R)-环己二胺(99%)、间氯过氧苯甲酸(m-CPBA)、α-甲基苯乙烯、茚均购自Alfa Aesar。其他试剂和溶剂均为市售分析纯。
1.2 载体的制备
低聚苯乙烯基亚膦酸,低聚苯乙烯基膦酸的制备参见文献[18]。
晶态层状低聚苯乙烯基膦酸-磷酸氢锆的制备是在聚四氟乙烯塑料杯中,将OSPNA(5.2 g,13 mmol)和NaH2PO4·2H2O(4.2 g,27 mmol)和50 mL水的混合液,在搅拌下滴加到 ZrOCl2·8H2O(6.4 g,20 mmol)和10 mL 40%HF(0.20 mol)的100 mL溶液中,75℃搅拌5 d,直到白色沉淀析出,离心过滤,用水洗涤至滤液为pH=5,甲醇洗涤(40 mL×3),70℃真空干燥24 h。产率约70%。IR(KBr,cm-1),3027,2 925(CH),2370(O=P-OH),1603,1494,1453,754 (-C6H5),1 267(P=O),1 067,1 013)。
氯甲基化晶态低聚苯乙烯基膦酸-磷酸氢锆、胺化和酚羟基化载体的制备参照文献[18-21]。结构如图1中所示。
1.3 催化剂的制备
均相手性Salen Mn(Ⅱ)的制备参照文献[23]。分别将0.5 g胺化和酚羟基化载体2a、2b、2c和2d,均相手性Salen Mn(Ⅱ)催化剂 (2.5 g),适量氢氧化钠,40 mL四氢呋喃,加入到100 mL三颈瓶中回流反应12 h。过滤,分别用甲苯、二氯甲烷及去离子水洗涤滤饼至洗液经原子吸收检测不到锰元素存在,真空干燥24 h得棕色粉末状固载催化剂,分别记作3a、3b、3c和3d。催化剂3a IR(KBr cm-1):2930-2870(CH),1 615,1 495,1 455(-C6H5),1 624-1 627(C=N),520 (Mn-N)。DR UV-Vis:251,423 nm;催化剂 3b IR (KBr cm-1):2 950-2 880 (C-H),1 625,1 500,1 460 (-C6H5),1 624-1 635(C=N),521(Mn-N)。DR UV-Vis:253,425.5 nm。催化剂3c IR(KBr cm-1):2 935-2 850 (C-H),1 611,1 492,1 450(-C6H5),1 620-1 635(C=N),520(Mn-N)。DR UV-Vis:252,428.5 nm;催化剂 3d IR (KBr cm-1):2 945-2 850(C-H),1 615,1 02,1 460 (-C6H5),1 625-1 645(C=N),520(Mn-N)。DR UV-Vis:251,428.2 nm。

2 结果与讨论
2.1 催化剂的微观形貌
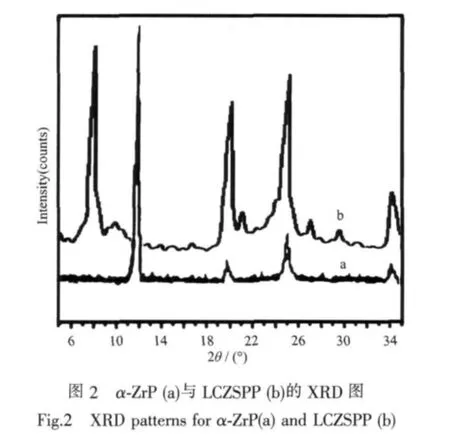
图2为载体的粉末衍射图,从图中可知样品在2θ=8.23°,19.48°,24.54°存在3个很强的吸收峰,对应的内层间距分别为1.065、0.443和0.336 nm。和α-ZrP相比,最大的不同是在2θ=8.23°出现了1个新的吸收峰,其层间距(1.065 nm)比α-ZrP的层间距(0.764 nm)大0.301 nm。表明,样品的层间距为1.065 nm。层间距增大是由于样品中存在大量刚性的苯环和无机基团所致。
固载催化剂3d的SEM、TEM及AFM照片如图3、4、5。SEM和TEM图显示固载催化剂的颗粒的粒径大小在几十到100 nm范围,结构疏松,拥有大量的纳米通道、孔洞和空腔。从图5a,5b可以看出固载催化剂中存在大量的孔洞,其大小为 13.0~15.2 nm。 因此催化剂可以为不对称环氧化反应提供足够的空间,这可能是固载化均相催化剂具有优良的催化活性和对映选择性最主要的因素之一。


2.2 催化烯烃环氧化性能研究
以间氯过氧苯甲酸(m-CPBA)为氧化体系催化烯烃的不对称环氧化反应,考察了反应时间、温度、助催化剂等因素对催化结果的影响,并且与均相Jacobsen催化剂进行对比。
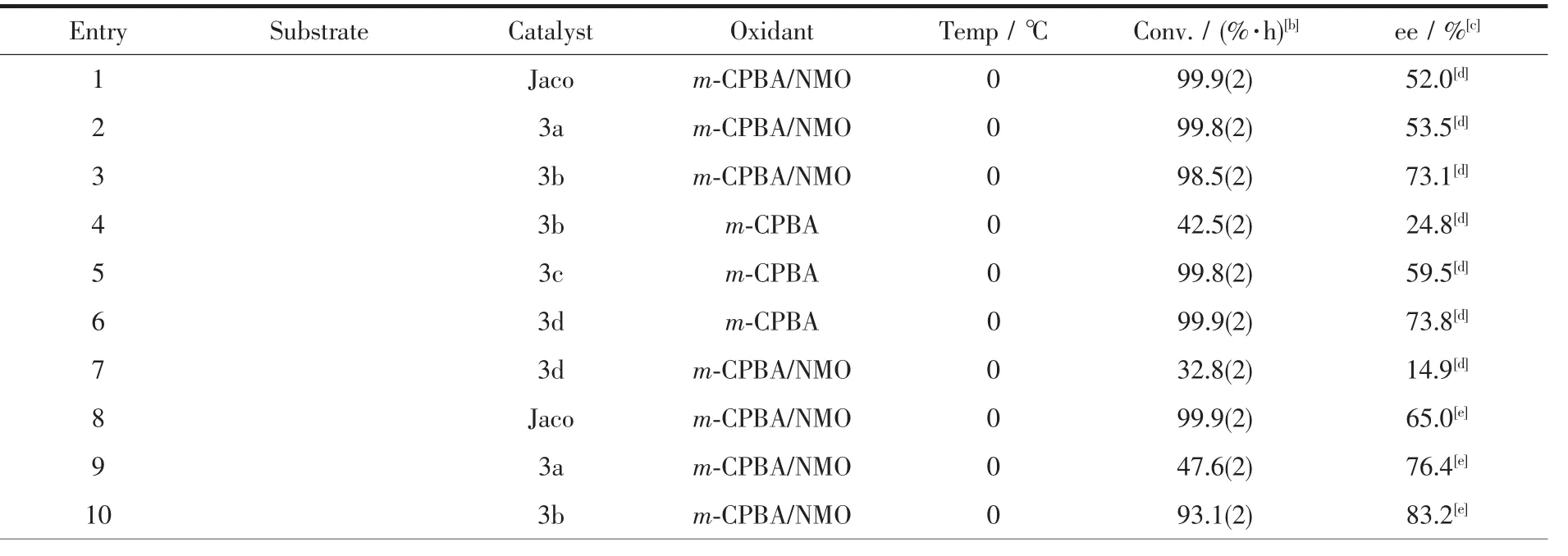
表1 m-CPBA体系中催化剂3a-3d催化烯烃不对称环氧化反应[a] Table 1 Asymmetric epoxidation of alkenes catalyzed by 3a-3d with m-CPBA as oxidants[a]

续表1
从表1中可以看出固载催化剂3a~3d表现出了与均相Jacobsen催化剂相近甚至更高的对映选择性。尤其对于α-甲基苯乙烯,对映选择性从53.5%增加到73.8%,对映选择性的增加主要归因于轴向连接基团与载体(LCZSPP)所组成的微环境以及载体纳米孔道的限阈效应。
2.3 助催化剂效应
大量的文献报道轴向添加剂对催化剂的活性和对映选择性起到促进作用。本文中,对于有机二胺固载的催化剂(3a~3b),当加入助催化剂NMO,转化率和对映选择性都有较大的提高,这与文献报道相一致。当加入助催化剂NMO,尤其对于α-甲基苯乙烯转化率从42.5%增加到98.5%(表1),对映选择性24.8%增加到73.1%。但是对于有机二酚手柄固载的催化剂(3c,3d)却出现了截然相反的结果,即不加入比加入助催化剂,转化率和对映选择性不但没有降低,反而大大提高,这与绝大多数先前报道的文献相矛盾。尤其对于 α-甲基苯乙烯 (转化率从 99.9%降低到32.8%;ee:从73.8%降低到14.9%;entries 6 and 7),相似的结果对于茚也同样可以得到(entries 13 and 14)。原因可能是Mn-O化学键比Mn-N化学键具有更多离子性;另一个原因可能是酚氧基比脂肪族胺基具有更大的刚性和空间位阻。最近List小组[24]采用大位阻的手性联二萘酚刚性配体的Salen Mn(Ⅱ)催化色素烯及其衍生物的不对称环氧化反应有相似实验现象的报道,但未给出具体的实验数据。
实际上,作为连接手臂的酚氧基团具有和助催化剂NMO具有相似的电子结构和配位性质。不存在NMO的情况,催化剂3c与3d已经表现出来相当满意的效果(entries 5 and 6,entries 12 and 13),因为在这里酚氧基团扮演了轴向连接基团和轴向助剂例如(NMO)的双重作用。此时加入NMO后,NMO可能干扰不对称环氧化反应中已经形成的较好的中间体或者过渡态的几何构型与构象,从而影响手性诱导和催化效果。对于这些固载催化剂表现出反常现象的机理的研究正在进一步进行中。
2.4 不同溶剂与温度的影响

表2 固载催化剂3d在不同的溶剂和温度条件下催化茚的环氧化反应[a]Table 2 Epoxidation of indene catalyzed by immobiled catalyst 3d in different solvents and temperature[a]
表2中概括了催化剂3d在不同溶剂和温度条件下催化茚的不对称环氧化结果。从表中可以看出,当用二氯甲烷做溶剂时,不论是转化率还是对映选择性都是最好的。同时,我们发现随着温度的降低,对映选择性在增加,而转化率略微降低。可能的原因是随着温度的降低,底物分子的有效碰撞减少,因此转化率有所降低。同时可能随着温度的降低,更有利于环氧化产物中C-O键的形成和抑制过渡态的反转造成更高的对映选择性。
2.5 催化剂的循环使用
表3为固载化均相催化剂对α-甲基苯乙烯的循环使用情况。从表3中可以看出,和均相Jacobsen催化剂相比,固载催化剂3d在循环使用10次后仍然具有较高的催化活性。这主要归因于载体的结构是由疏水的聚苯乙烯片段和具有亲水性的以及具有纳米层状自组装结构的无机磷酸锆部分以及构成载体LCZSPP中的有机聚苯乙烯部分相互重叠、扭曲、平行、交叉、甚至缠绕以及层状磷酸锆部分形成了不同分子尺寸大小的孔径、空洞、以及二级通道一起构成的微环境,使得固载催化剂表现出如此优异的循环性能。

表3 固载催化剂3d催化α-甲基苯乙烯环氧化反应的循环使用性能[a]Table 3 Recycling of immobilized catalyst in the asymmetric epoxidation of α-methylstyrene with m-CPBA as the oxidant[a]
3 结 论
(1)用氢氟酸络合法合成出了新型层状晶态有机聚合物无机杂化低聚苯乙烯基膦酸-磷酸氢锆载体材料。并将其用于固载手性Salen Mn(Ⅱ)催化不对称环氧化反应中。
(2)制备的固载催化剂表现出了和均相催化剂相当或更高的催化活性,并且具有较好的重复使用性。
(3)对两类不同链接手臂进行研究发现,二酚类链接手臂固载的手性Salen Mn(Ⅱ)催化剂在不加入昂贵的助催化剂情况下,就表现出了很好的对映选择性和催化活性。
[1]Schurig V,Betschiner F.Chem.Rev.,1992,92:873-888
[2]Rukhsana I K,Noor-ul H K,Sayed H R A,et al.J.Catal., 2004,224:229-235
[3]GUO Feng(郭锋),ZHANG Hong-Qi(张洪起),FENG Lei (冯磊),et al.Chem.J.Chinese Universities(Gaodeng Huaxue Xuebao),2008,22:972-977
[4]ZHAO Dong-Min(赵东敏),ZHAO Ji-Quan(赵继全),ZHAO Shan-Shan(赵姗姗).Chinese Sci.Bull.(Kexue Tongbao), 2007,52:886-892
[5]Zhang W,Jacobsen E N.J.Org.Chem.,1991,56:2296-2298
[6]Katsuki T.Adv.Synth.Catal.,2002,344:131-147
[7]Jacobsen E N,Deng L,Furukawa Y.Tetrahedron,1994,50: 4323-4334
[8]McGarrigle E M,Gilheany D G.Chem.Rev.,2005,105:1563-1602
[9]Baleizo C,Garcia H.Chem.Rev.,2006,106:3987-4043
[10]Fraile J M,Garci J I,Mayoral J A.Chem.Rev.,2009,109: 360-417
[11]Palucki M,Pospisil P J,Zhang W.J.Am.Chem.Soc.,1994, 116:9333-9334
[12]Palucki M,Mccormick G J,Jacobsen E N.Tetrahedron Lett., 1995,36:5457-5460
[13]Wang D P,Wang M,Wang X N.J.Catal.,2006,237:248-254
[14]Ma X B,Fu X K.J.Mol.Catal.A:Chem.,2003,195:47-53
[15]Sui Y,Fu X K,Zeng R Q,et al.J.Mol.Catal.A:Chem., 2004,217:133-138
[16]Wu X J,Ma X B,Ji Y L,et al.J.Mol.Catal.A.Chem., 2007,265:316-322
[17]BAO He-Bin(包河彬),FU Xiang-Kai(傅相锴),BAI Ruo-Fei (白若飞),et al.Chem.J.Chinese Universities(GaodengHuaxue Xuebao),2008,25:927-931
[18]Bai R F,Fu X K,Bao H B,et al.Catal.Comm.,2008,9: 1588-1594
[19]TU X B,Fu X K,Hu X Y,et al.Inorg.Chem.Commun.,2010, 13:404-407
[20]Gong B W,Fu X K,Chen J X,et al.J.Catal.,2009,262:9-17
[21]Ren W S,Fu X K,Bao H B,et al.Catal.Commun.,2009, 10:788-793
[22]Zou X C,Fu X K,Li Y D,et al.Adv.Synth.Catal.,2010, 352:163-170
[23]Zhang W,Loebach J L,Wilson S R,et al.J.Am.Chem. Soc.,1990,112:2801-2803
[24]Saihu L,Benjamin L.Angew.Chem.Int.Ed.,2010,49:628-631
[25]Zhang H D,Xiang S,Xiao J L,et al.J.Mol.Catal.A,2005, 238:175-184
[26]Kureshy R I,Ahamd I,Khan N H,et al.J.Catal.,2005, 235:28-34
Effect of Axial Linker Group on Heterogeneous Chiral Salen Mn(Ⅱ)Catalyzed Enantioselective Epoxidation of Unfunctionalized Olefins
LUO Yun-Fei1FU Xiang-Kai*,1ZOU Xiao-Chuan1,2WANG Chang-Wei1HU Xiao-Yan1JIA Zi-Yong1ZHANG Huai-Zhi1
(1College of Chemistry and Chemical Engineering,Research Institute of Applied Chemistry Southwest University, The Key Laboratory of Applied Chemistry of Chongqing Municipality,The Key Laboratory of Eco-environments in Three Gorges Reservoir Region(Ministry of Education),Chongqing 400715,China)
(2Department of Biological&Chemical Engineering,Chongqing Education College,Chongqing 400067,China)
The chiral Salen Mn(Ⅱ)was axially immobilized onto a diamine or diphenoxyl linker modified layered crystalline hybrid material-zirconium oligostyrenylphosphonate-phosphate (LCZSPP)synthesized in this lab.The influence of the two types of linkers and axial additives on the catalytic performance of the heterogeneous Salen Mn(Ⅱ)was investigated.The results demonstrate that the conversion and enantioselectivity(ee)value increase in the presence of axial additive such as NMO for the Salen Mn(Ⅱ) immobilized onto LCZSPP via diamine linkers while the opposite is true for the immobilized Salen Mn(Ⅱ) via diphenoxyl.In addition,the prepared catalysts could be conveniently separated from the reaction system by simple precipitation in hexane,and could be reused at least ten times without significant loss of activity and enantioselectivity.
zirconium oligostyrenylphosphonate-phosphate;chiral Salen Mn(Ⅱ);heterogeneous catalysts;enantioselective epoxidation of unfunctionalized olefins;axial additive
O614.3;TQ426.65
A
1001-4861(2011)07-1302-07
2011-01-15。收修改稿日期:2011-03-21。
国家科技部科技中小型企业技术创新基金(No.09C26215112399)和国家人力资源和社会保障部留学人员回国创业启动支持计划(人社厅发2009(143号))资助项目。
*通讯联系人。E-mail:fxk@swu.edu.cn
