不同嗜酸氧化亚铁硫杆菌(DY15, DY26, DC)对黄铜矿的浸出及其基因Afe0022的差异表达
2011-11-08吴学玲侯冬梅邱冠周
吴学玲,袁 鹏,胡 琪,侯冬梅,苗 博,邱冠周
(1. 中南大学 资源加工与生物工程学院,长沙 410083;2. 中南大学 教育部生物冶金重点实验室,长沙 410083)
不同嗜酸氧化亚铁硫杆菌(DY15, DY26, DC)对黄铜矿的浸出及其基因Afe0022的差异表达
吴学玲1,2,袁 鹏1,2,胡 琪1,2,侯冬梅1,2,苗 博1,2,邱冠周1,2
(1. 中南大学 资源加工与生物工程学院,长沙 410083;2. 中南大学 教育部生物冶金重点实验室,长沙 410083)
通过摇瓶浸矿比较研究3株Acidithiobacillus ferrooxidans (At. ferrooxidans)菌DY15、DY26和DC的耐受Cu2+能力的差异以及在不同的初始Cu2+浓度影响下菌对黄铜矿浸出能力的不同。采用Real time RT(Reverse transcriptase) PCR检测这些菌株的阳离子通道蛋白基因Afe0022在不同Cu2+环境下的差异表达,进行相对表达量分析。结果表明:DY15、DY26和DC菌的最高Cu2+抗性分别是0.40、0.22和0.04 mol/L,且在以元素硫为能源的9K培养基中,3株菌DY15,DY26和DC对应的培养体系pH值在7 d内由1.8分别降到0.8、1.2和1.3,说明DY15的硫氧化能力最强;3株菌都具有较好的亚铁氧化能力,在40 h内,DY15、DY26和DC的Fe2+氧化率分别是80%、100%、100%。黄铜矿精矿浸矿实验表明,DY15对黄铜矿精矿的浸出效率最高,DY26的其次,DC的最低,但DY15的单菌浸出效率略低于3株菌的混合浸出效率。对Cu2+抗性越强的菌株,其基因Afe0022表达量越高,这对菌株的Cu2+抗性能力有一定的理论解释作用,在分子层面上为研究At. ferrooxidans菌抗铜机理提供一定的理论依据。
嗜酸氧化亚铁硫杆菌;黄铜矿精矿浸出;元素硫氧化;Cu2+抗性;差异表达
Acidithiobacillus ferrooxidans是一种嗜酸性的革兰氏阴性菌,它能够氧化Fe2+、元素硫以及还原无机硫化合物来获取能量,在生物冶金领域受到广泛的应用和深入的研究[1−4]。生物冶金通过黄铜矿和次生铜硫化物的氧化提取金属,是从低品位矿石中获取金属的经济有效的方法[5−7]。一些研究得分析了它的流程及机制,为进一步研究生物冶金的分子机制起到了理论和实践指导作用[8−10]。
在生物浸出过程中,一些重金属离子在高浓度时对细菌是有害的[11]。黄铜矿生物浸出的主要产物是Cu2+,当Cu2+浓度比较低时,它对细胞是低害或者无害的,但是当浓度上升后,这些离子就会抑制细菌的活性,进而影响浸出过程。因此,关于菌株浸出黄铜矿的能力大小与菌株耐受Cu2+的能力大小是否相关的研究至关重要。筛选出既具有较高的浸出效率同时又具有较高抗Cu2+能力的菌株是生物浸出成功的关键[12]。本研究针对具有不同Cu2+抗性的3株At. ferrooxidans菌株展开,测定它们的最高Cu2+耐受水平及Fe2+和元素硫的氧化能力,并对其黄铜矿精矿的浸出能力进行了分析比较,并就初始Cu2+浓度对细菌浸矿的影响进行了研究,以探究不同铜离子抗性的At. Ferrooxidans的Fe2+和元素硫的氧化能力及黄铜矿浸矿能力的差异。为了进一步探究At. ferrooxidans菌的抗铜机理,采用Real time RT-PCR法检测不同菌株在不同Cu2+浓度下的Afe0022 的mRNA差异表达。
1 实验
1.1 菌株
1.1.1 菌种资源和生长条件
本研究中的3个菌株分别来自广西大厂铜矿山(DC)、湖北大冶铜矿山(DY15、DY26)。
1.1.2 菌株的培养,Fe2+和元素硫的氧化测定
培养基(9K基本培养基):(NH4)2SO43.0 g/L, KCl 0.1 g/L, K2HPO40.5 g/L, MgSO4·7H2O 0.5 g/L,Ca(NO3)20.01 g/L,FeSO4·7H2O 20 g/L,pH 2.0,初始菌浓度为0.5×107cell/mL,利用直接细胞计数法做出生长曲线。利用重铬酸钾(K2Cr2O7)滴定法对培养基中Fe2+浓度进行分析。1 mL 6 mmol/L的K2Cr2O7(1.8 mg)可以与2 mg Fe2+起反应。二苯磺酸钠用作指示剂,当出现紫色时即为滴定的终点。由此测出菌株对Fe2+的氧化能力。在进行元素硫氧化能力测定时,培养基为无FeSO4·7H2O的9K培养基,加入10 g/L的元素硫做为能源,绘制生长曲线,用pH值的变化来监控元素硫的氧化。
为了进一步确定不同菌株的Cu2+抗性,基于一定预实验的基础,在不同Cu2+浓度(0.02~0.42 mol/L)的9K培养基中于160 r/min 30 ℃恒温状态下对三株菌进行培养[13−14]。利用重铬酸钾滴定法(K2Cr2O7)测定培养基中的Fe2+浓度,若培养体系中Cu2+浓度超过菌株的耐受能力,则Fe2+不会被氧化。
1.2 黄铜矿精矿的生物浸出
1.2.1 黄铜矿精矿样品
本实验使用的黄铜矿精矿为广西德兴铜矿的0.125 mm粒径的矿粒,其化学组成见表1。

表1 黄铜矿精矿的主要成分Table 1 Main components of chalcopyrite concentrate (mass fraction, %)
1.2.2 黄铜矿精矿的生物浸出
利用摇瓶实验浸出黄铜矿精矿,无铁9K培养基加入150 g/L的黄铜矿精矿作为能源,初始菌浓度为1.0×107cell/mL[15−16]。为了评估浸矿过程中初始Cu2+浓度的影响,在该浸矿体系中分别加入不同初始浓度(0、0.001和0.05 mol/L)的Cu2+,160 r/min 30 ℃培养。在浸出过程中维持pH值在2.0。利用光学显微镜对浸出体系中的细菌进行计数。在36 d的培养周期内利用原子吸收光谱AA−6800每6 d测定一次浸出液中的Cu2+浓度。同时进行无菌空白对照实验,所有的实验同时设定3组平行实验。
1.3 Real-time RT-PCR
将3株菌分别接种于含有不同浓度Cu2+的9K培养基中,并使接种后的菌浓度保持一致,分别培养至对数生长初期(Fe2+氧化率为20%),经4 ℃离心(12 000 r/min)分离10 min,收集菌种,并立即提取细菌总RNA。
用TRIzol试剂(Invitrogen)提取总RNA,用RNeasy Mini Kit试剂盒(Qiagen)纯化RNA,RNase-free DNase set 试剂盒(Qiagen)去掉基因组DNA的污染,使用反转录试剂盒(Revert Aid TM First Strand cDNA Synthesis Kit,MBI) 合成cDNA。
使用MyiQTM single color Real-time PCR Detection systerm (BIO-Rad)和SYBR Green Realtime PCR MasterMix试剂盒(QPK−201,YOBO Co.Ltd.),鉴定目标基因在不同Cu2+浓度环境下的差异表达。以持家基因rrs (16s rDNA)为参照基因。实时定量(Real-time)PCR数据由Optical system software(Version 1.0)收集并处理。
2 结果与讨论
2.1 铜抗性菌的抗性能力测定
菌株DY15、DY26 和 DC对Cu2+最高抗性分别为0.40、0.22和0.04 mol/L(见图1)。显然,这3种菌在Cu2+抗性上有很大的差异,DY15的Cu2+抗性最强,DC的Cu2+抗性最弱,抗性曲线也显示菌株在不同Cu2+浓度下的生长情况,同时也可以看出,Cu2+的抑制作用主要是延长了菌株刚开始适应生长环境的时间,并提高了菌浓度。
2.2 株菌的生长和对Fe2+及元素硫的氧化能力Fe2+
DY15、DY26和DC在以元素硫为能源的9K培养基中,7 d内菌数由0.5×107cell/mL分别增加至1.1×108,1.0×108和1.0×107cell/mL,同时pH值由1.8分别降至0.8、1.2、1.3(见图2(a)和(b)),显然DY15的硫氧化能力最强,DY26居中,DC最低。
当Fe2+作为能源物质时,在40 h内,DY15、DY26和DC和的菌浓度从0.5×107cell/mL分别上升至3.25×107cell/mL、4.75×107cell/mL和5.25×107cell/mL(见图2(c))。经过40 h,DY15、DY26和DC的Fe2+氧化率分别是80%、100%和100%。说明当Fe2+作为能源物质时,DY15的细菌生长能力及对Fe2+氧化能力最弱。比较这3株菌,不难发现DY15的Cu2+抗性最强,元素硫氧化能力最强,但Fe2+氧化能力最弱。而DC的Fe2+氧化能力最强,但Cu2+抗性及元素硫氧化能力均最弱(见图2(c)和(d)),这为进一步的实际应用提供了一定的参考依据,根据不同的环境,应选择不同的菌株,以达到在浸矿过程中的菌株浓度最高,并且菌株的活性最高,从而使得矿的浸出效果最佳。
2.3 黄铜矿精矿浸出
2.3.1 菌株在浸矿体系中的生长
据有关文献报道,浸矿36 d时,浸出液中Cu2+约为0.001 mol/L[17];由于菌株DC对Cu2+的最高耐受能力为0.04 mol/L,所以浸矿体系的初始Cu2+浓度设置为0、0.001和0.05 mol/L 3个浓度梯度,浸矿周期为36 d。
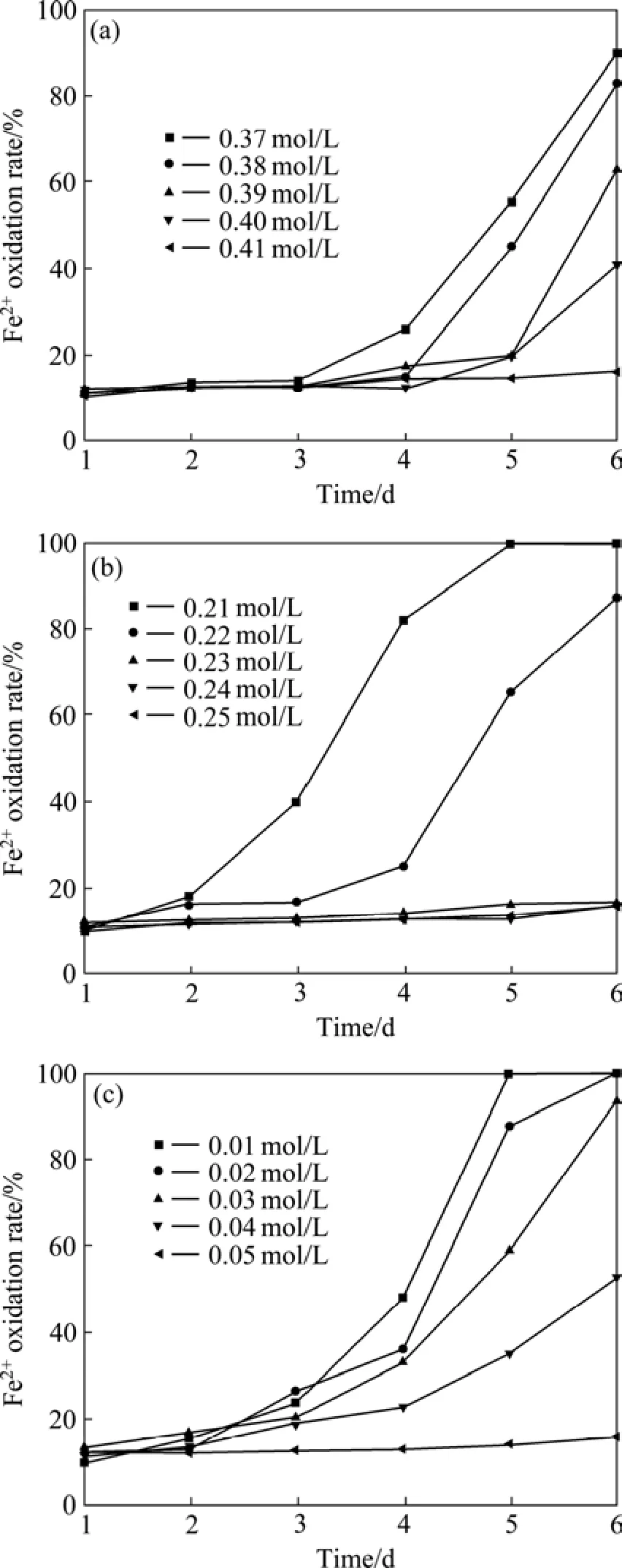
图1 不同Cu2+浓度下的Fe2+氧化曲线Fig.1 Oxidation curves of Fe2+ at different initial Cu2+concentrations: (a) 0.40 mol/L, DY15; (b) 0.22 mol/L, DY26;(c) 0.04 mol/L, DC
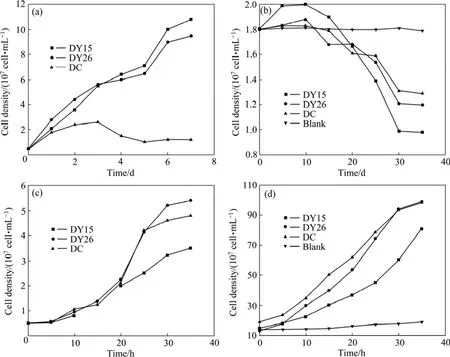
图2 不同能源物质时的生长和元素硫氧化曲线Fig.2 Growth(a) and sulfur oxidation(b) of 3 strains in 9K medium with different energy resources: (a), (b) Sulfur; (c), (d)FeSO4·7H2O

图3 不同初始Cu2+浓度时浸矿菌在浸矿体系中的生长曲线Fig.3 Growth curves of bacteria in leaching system at different initial Cu2+concentrations: (a) 0; (b) 0.001 mol/L;(c) 0.05 mol/L
在浸矿过程的第一周,3株菌的菌浓度均从1.0×107cell/mL降至0.4×107cell/mL(见图3),说明此时细菌还不适应新的浸矿环境,细菌生长缓慢并有部分细菌死亡。在第二周,3株菌逐渐适应浸矿环境,开始进入指数生长期。经过36 d的浸矿,菌的浓度都有明显上升,但每株菌浸矿效率明显不同,也说明了菌株对浸矿体系的适应程度不同。初始Cu2+浓度为0时,浸矿体系中菌株DY15、DY26和DC的菌浓度从1.0×107cell/mL分别上升至1.1×108cell/mL,8.0×107cell/mL和5.0×107cell/mL(见图3(a))。显然,DY15在浸矿体系中菌浓度最高。同时,在以元素硫作为能源物质的9K培养基中,DY15的菌浓度也是最高,达1.1×108cell/mL(见图2(a)),但在Fe2+作为能源物时,它的最高菌浓度只有3.5×107cell/mL(见图2(c)),说明DY15能够高效氧化元素硫并获得能量,在黄铜矿精矿作为能源物质时也能够很好地生长,浸矿菌对不同的浸矿环境会表现出极大的差异性。
在Cu2+初始浓度为0.001 mol/L时,DY15的最高菌浓度为1.0×108cell/mL,也高于DY26(7.75×107cell/mL)和DC(4.75×107cell/mL)(见图3(b)),说明DY15的生长能力仍然最高,但此浓度的Cu2+对3株菌已有一定的抑制,3株菌的浓度都要低于初始Cu2+浓度为0时的菌浓度。当Cu2+初始浓度上升至0.05 mol/L时, 3株菌的生长受到明显抑制,由于0.05 mol/L的Cu2+浓度高于DC的最高耐受能力(0.04 mol/L),在此环境下DC不能生长。DY26菌浓度为5.6×107cell/mL,DY15菌浓度仍然最高(6.0×107cell/mL)(见图3(c))。显示了DY15在实际浸矿中一定的优越性,即使浸矿体系中的Cu2+浓度较高,也可以延迟从浸矿液中提取铜的时间,这将减少实际浸矿中频繁提取铜带来的成本,具有一定的实际应用价值。
2.3.2 3株菌在不同起始Cu2+浓度时黄铜矿精矿浸出
在浸出的前6 d,由于菌株还没适应新浸矿环境而导致菌浓度很低,所以黄铜矿的浸出效率很低(见图4,其中Mix代表3株菌的混合浸矿)。随后,菌株进入对数生长期,浸矿效率也随之升高。当初始Cu2+浓度为0.001 mol/L时, 它对3株菌的抑制比较弱(见图4(b)),浸矿结束后,浸矿体系中浸出的Cu2+浓度(减初始Cu2+)分别为2.926 g (DY15)、2.432 g (DY26) 和2.436 g (DC),这跟初始Cu2+浓度为0时的浸出相似(见图4(a))。说明了低浓度的Cu2+(0到0.001 mol/L)对3株菌的浸矿能力无影响。
当初始Cu2+浓度为0.05 mol/L时(见图4(c)),3株菌的浸矿效率都较低,细菌的生长受到抑制(见图3(c)),导致在此环境下浸矿能力的下降。在此条件下,DY15的浸矿效率仍然高于DY26和DC的。但同时含有以上3株菌的混合浸矿效率要高于DY15纯菌浸矿的效率。
黄铜矿精矿可能受到Fe3+和质子的攻击而溶解,方程式如下:

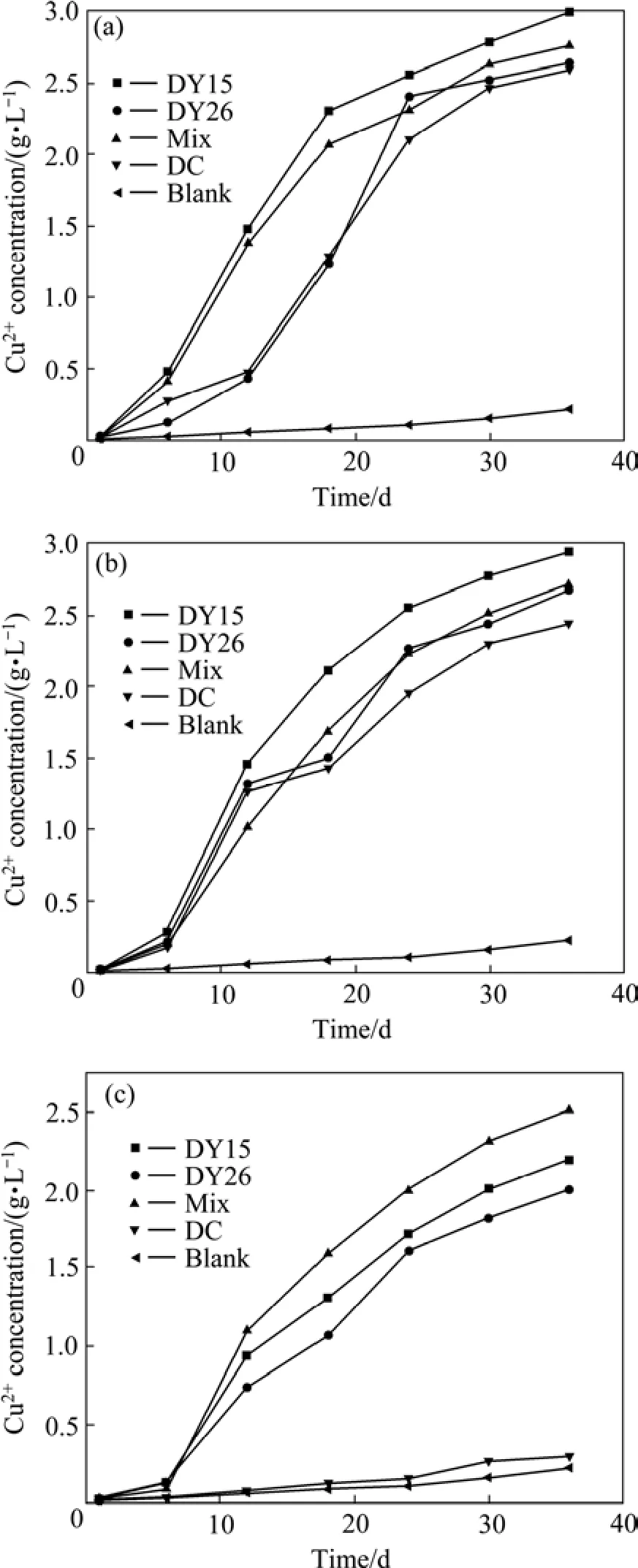
图4 不同初始Cu2+浓度时Cu2+的浸出曲线Fig.4 Cu2+ leaching curves in leaching system at different initial Cu2+ concentrations: (a) 0; (b) 0.001 mol/L; (c) 0.05 mol/L

嗜酸亚铁氧化硫杆菌(At. ferrooxidans)通过氧化Fe2+、S和还原性硫化物来获得能量。在浸矿中,黄铜矿是唯一的能源物质。因此,菌株的Cu2+耐受能力、硫氧化能力与黄铜矿精矿的浸出效果直接相关。通过图4(a)和(b)可发现,在单菌浸矿中,DY15的浸出效率最高。一般而言,黄铜矿浸出效率主要依赖于菌种各项生理特征,包括菌的生长速率、重金属抗性、对Fe2+和元素硫以及还原性硫化物的氧化能力等。在浸矿过程中,DY15能够如上述方程式描述的那样使黄铜矿精矿溶解,就是能够耐受一定浓度的Cu2+并能氧化元素硫及其还原性氧化物。但是当浸矿体系的Cu2+初始浓度很高时(0.05 mol/L)(见图4(c)),浸矿能力最强的DY15也受到一定的抑制。而在混合培养液中,DY26的硫氧化能力虽然低于DY15的,但其对Fe2+的氧化能力较强,所以,混合菌浸矿效率要高于单菌浸矿效率的原因,很可能是DY15和DY26的协同作用[18],各株菌都有一定的浸矿优势,并在混合浸矿中,每种菌都将优势得以发挥,所以一般来说,混合浸矿的效果要优于纯菌浸矿的。
2.4 不同Cu2+环境中3株菌抗铜基因Afe0022的差异表达
菌株DC、DY26和DY15在不同浓度Cu2+胁迫下抗铜基因Afe0022的表达上调倍数如表2所列。
在Cu2+作用时,只要尚未达到菌株最高耐受Cu2+浓度,基因Afe0022的表达都上调,DC、DY26和DY15菌在各自最高Cu2+胁迫时的抗铜基因Afe0022 表达量相对于无Cu2+胁迫情况下的上调倍数分别为18.31、55.53和186.22,这说明培养体系中Cu2+对细菌的抗铜基因Afe0022的表达具有一定的刺激作用,DY15的抗性最强,故其抗铜基因Afe0022 表达量在最高耐受浓度时是3株菌中最高的,DC对Cu2+的抗性最弱,所以DC的抗铜基因表达量最低。且在菌株的最大Cu2+耐受范围内,随着Cu2+浓度的上升,抗铜基因Afe0022的表达量也上升。这也说明了菌株对Cu2+的抗性强弱,在一定程度上跟菌株自身抗铜基因Afe0022的表达量成正比关系。3株菌抗铜基因Afe0022对同一Cu2+浓度的敏感程度也不一样,在Cu2+浓度为0.04 mol/L的时候,3株菌抗铜基因Afe0022的表达增加量分别是:DC为18.31倍,DY26为11.55倍,DY15为1.17倍。由此可以看出,对Cu2+抗性越强的菌株,其对Cu2+的敏感性越弱,也就是说,较低浓度的Cu2+还不足以促使高耐受Cu2+的菌株大量表达抗铜基因,但是对于不同菌株,一旦Cu2+浓度达到一定高度,那么菌株抗铜基因Afe0022的表达量就会迅速提升。当培养体系中Cu2+浓度超过菌株的最大耐受浓度时,菌株不能生长。
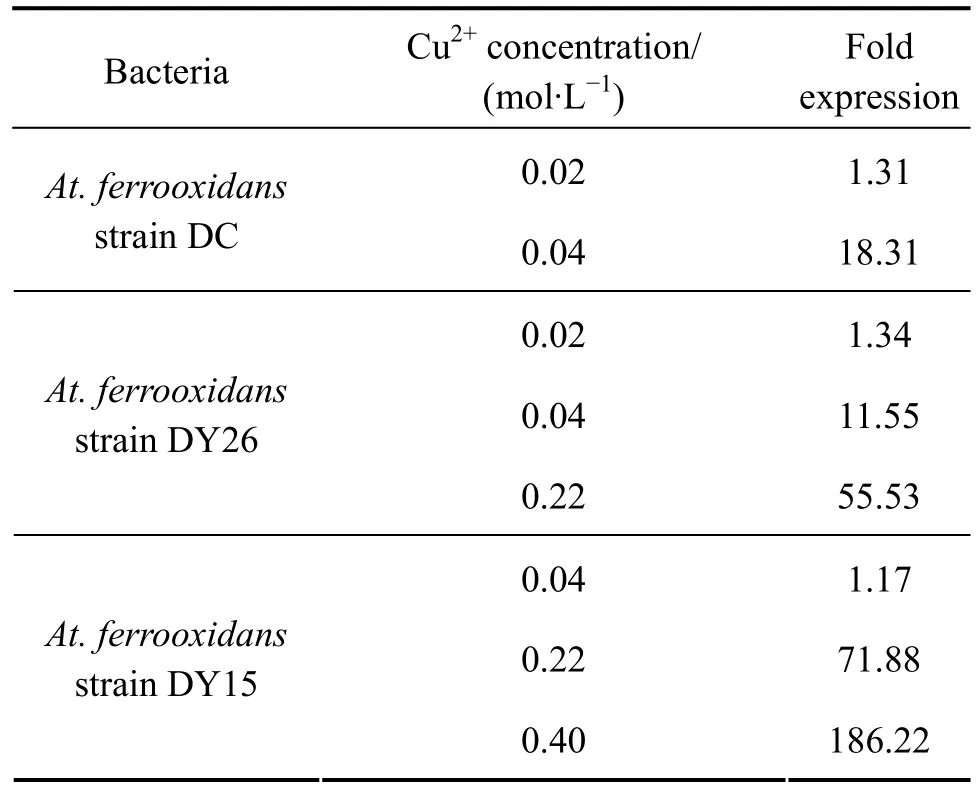
表2 不同Cu2+浓度环境下抗铜基因Afe0022 的差异表达Table 2 Difference expression of Afe0022 in At. ferrooxidans strain DC and DY26 under different Cu2+ concentrations
3 结论
1) 3株At. ferrooxidans DY15、DY26和DC有着不同的Cu2+耐受能力、元素硫氧化能力和Fe2+氧化能力。其对Cu2+的最大耐受浓度依次为 0.40 mol/L、0.22 mol/L和0.04 mol/L,对元素硫的氧化能力由大至小的顺序依次为DY15、DY26和DC,对Fe2+的氧化能力由大至小的顺序依次为DY15、DY26和DC。
2) 3株菌中DY15对Cu2+的耐受能力最强,对元素硫的氧化能力最强,在纯菌浸矿过程中,在各种条件下DY15的生长速度均最快且浸矿效率最高,说明浸矿效率的高低与菌株的Cu2+耐受能力和元素硫的氧化能力密切相关。
3) 在浸矿过程中,当浸矿体系中起始Cu2+浓度很高时,DY15的生长速度及浸矿效率仍高于DY26和DC的,但略低于混合菌浸矿效率。这可能与其Fe2+的氧化能力较弱有关,并说明不同菌种之间的相互作用可有效提高浸矿效率。
4) 环境中Cu2+浓度只要尚未达到细菌最高耐受Cu2+浓度,抗铜基因Afe0022 的表达都上调,Cu2+浓度高的环境中比在Cu2+浓度低的环境中上调倍数更高,说明抗铜基因Afe0022 对Cu2+的胁迫是敏感的,且其表达量与菌株对Cu2+耐受能力的强弱成一定的正相关。
REFERENCES
[1] SASAKI K, NAKAMUTA Y, HIRAJIMA T, TUOVINEN O H.Raman characterization of secondary minerals formed during chalcopyrite leaching with Acidithiobacillus ferrooxidans[J].Hydrometallurgy, 2009, 95: 153−158.
[2] ZHANG Lin, QIU Guan-zhou, HU Yue-hua, SUN Xiao-jun, LI Jian-hua, GU Guo-hua. Bioleaching of pyrite by At. ferrooxidans and L. ferriphilum[J]. Transactions of Nonferrous Metals Society of China, 2008, 18: 1415−1420.
[3] WATLING H R , PERROT F A, SHIERS D W. Comparison of selected characteristics of Sulfobacillus species and review of their occurrence in acidic and bioleaching environments[J].Hydrometallurgy, 2008, 93: 57−65.
[4] QIU Mu-qing, XIONG Shui-ying, ZHANG Wei-min, WANG Gen-xuan. A comparison of bioleaching of chalcopyrite using pure culture or a mixed culture[J]. Minerals Engineering, 2005,18: 987−990.
[5] PETERSEN J, DIXON D G. Competitive bioleaching of pyrite and chalcopyrite[J]. Hydrometallurgy, 2006, 83: 40−49.
[6] WATLING H R. The bioleaching of sulphide minerals with emphasis on copper sulphides—A review[J]. Hydrometallurgy,2006, 84: 81−108.
[7] RAWLINGS D E, JOHNSON D B. The microbiology of biomining: development and optimization of mineral-oxidizing microbial consortia[J]. Microbiology, 2007, 153: 315−324.
[8] BOSECKER K. Bioleaching: metal solubilization by microorganisms[J]. FEMS Microbiol Rev, 1997, 20: 591−604.
[9] FU Bo, ZHOU Hong-bo, ZHANG Ru-bing, QIU Guan-zhou.Bioleaching of chalcopyrite by pure and mixed cultures of Acidithiobacillus spp. and Leptospirillum ferriphilum[J].International Biodeterioration & Biodegradation, 2008, 62:109−115.
[10] CABRERA G, GOMEZ J M, CANTERO D. Influence of heavy metals on growth and ferrous sulphate oxidation by Acidithiobacillus ferrooxidans in pure and mixed cultures[J].Process Biochemistry, 2005, 40: 2683−2687.
[11] ABOU-SHANAB R A I, BERKUM P V, ANGLE J S. Heavy metal resistance and genotypic analysis of metal resistance genes in gram-positive and gram-negative bacteria present in Ni-rich serpentine soil and in the rhizosphere of Alyssum murale[J].Chemosphere, 2007, 68: 360−367.
[12] XIA Jin-lan, PENG An-an, HE Huan, YANG Yu, LIU Xue-duan,QIU Guan-zhou. A new strain Acidithiobacillus albertensis BY-05 for bioleaching of metal sulfides ores[J]. Transactions of Nonferrous Metals Society of China, 2007, 17: 168−175.
[13] SUZUKI I. Microbial leaching of metals from sulfide minerals[J]. Biotechnology Advances, 2001, 19: 119−132.
[14] THIRD K A, CORD-RUWISCH R, WATLING H R. The role of iron-oxidizing bacteria in stimulation or inhibition of chalcopyrite bioleaching[J]. Hydrometallurgy, 2000, 57:225−233.
[15] WANG Jun, QIN Wen-qing, ZHANG Yan-sheng, YANG Cong-ren, ZHANG Jian-wen, NAI Shao-shi, SHANG He, QIU Guan-zhou. Bacterial leaching of chalcopyrite and bornite with native bioleaching microorganism[J]. Transactions of Nonferrous Metals Society of China, 2008, 18: 1468−1472.
[16] BEVILAQUA D, LEITE A L L C, GARCIA Jr O, TUOVINEN O. Oxidation of chalcopyrite by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans in shake flasks[J]. Process Biochemistry, 2002, 38: 587−592.
[17] 李金龙, 李得春. 低品位原生黄铜矿生物浸出技术的应用实践[J]. 铜业工程, 2006, 2: 7−10.LI Jin-long, LI De-chun. The practice of low grade primary chalcopyrite bacteria leaching technology[J]. Copper Engineering, 2006, 2: 7−10.
[18] ZHANG Yan-sheng, QIN Wen-qing, WANG Jun, ZHEN Shi-jie,YANG Cong-ren, ZHANG Jian-wen, NAI Shao-shi, QIU Guan-zhou. Bioleaching of chalcopyrite by pure and mixed culture[J]. Transactions of Nonferrous Metals Society of China,2008, 18: 1491−1496.
Bioleaching of chalcopyrite by Acidithiobacillus ferrooxidans DY15,DY26 and DC and difference expressions of gene Afe0022
WU Xue-ling1,2, YUAN Peng1,2, HU Qi1,2, HOU Dong-mei1,2, MIAO Bo1,2, QIU Guan-zhou1,2
(1. School of Resources Processing and Bioengineering, Central South University, Changsha 410083, China;2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha 410083, China)
The effects of different initial concentrations of Cu2+on chalcopyrite concentrate bioleaching and the difference of ability in response to copper ion (Cu2+) were investigated with three strains of Acidithiobacillus ferrooxidans (At. ferrooxidans) DY15, DY26 and DC. The real time reverse transcriptase (RT) PCR was used to analyze the difference expression of gene Afe0022 cation channel protein in copper ion with different concentrations. The results show that strain DY15, DY26 and DC have the copper ion tolerance level of 0.40, 0.22 and 0.04 mol/L, respectively.When the elemental sulfur acts as the energy resource in 9K medium, the oxidation capacity of elemental sulfur of strain DY15 is better than that of elemental sulfur of DY26 and DC, and after 7 d, the pH values of DY15, DY26 and DC decline from 1.8 to 0.8, 1.2 and 1.3, respectively. All three strains can oxidize ferrous ions well, and after 40 h, the oxidation capacities of ferrous ions of three strains are 80% (DY15), 100% (DY26), and 100% (DC), respectively. In the leaching experiment, strain DY15 has the highest bioleaching efficiency on chalcopyrite concentrate while strain DC has the least bioleaching efficiency in the three strains, but the mixed cultures containing 3 strains exhibit the highest bioleaching efficiency than the pure cultures of DY15. The stronger the capacity of strain resistance to Cu2+is, the more the expression of gene Afe0022 is. This result assists interpretation of bacterium resistance to Cu2+, and provides theoretical basis to study the mechanism of bacterium resistance to Cu2+in molecular level.
Acidithiobacillus ferrooxidans; chalcopyrite concentrate bioleaching; sulfur oxidation; Cu2+resistance;difference expression
Q819
A
1004-0609(2011)04-0932-07
2010-02-01;
2010-09-06
吴学玲,副教授,博士;电话:0731-88804873;E-mail: xueling0714@yahoo.com.cn
(编辑 李艳红)
