高盐度有机废水磁载催化剂降解工艺研究
2011-11-07赵俊生何锡阳
赵俊生 丁 杰 何锡阳
(四川理工学院,四川 自贡 643000)
安全与环保
高盐度有机废水磁载催化剂降解工艺研究
赵俊生 丁 杰*何锡阳
(四川理工学院,四川 自贡 643000)
以均匀沉淀法制备的Fe3O4磁粒为核心,以钛酸丁酯、正硅酸乙酯为原料,采用溶胶-凝胶法制备了磁载TiO2-SiO2-Fe3O4复合微粒,运用X射线衍射(XRD)、红外(IR)测试方法对所制得复合粒子进行表征,并以TiO2-SiO2-Fe3O4复合微粒为催化剂研究其高盐度有机废水催化降解的性能。结果表明,磁基体Fe3O4上包覆了一层SiO2和TiO2,制得磁载TiO2-SiO2-Fe3O4复合微粒。当有机废水pH=4.0,该催化剂的用量为3.0 g/L,空气体积流量为2 L/min,反应时间为1 h、温度为60℃时,COD的去除率为62.0%。
高盐度;磁性Fe3O4;TiO2-SiO2-Fe3O4复合微粒;催化降解
CWO工艺,是在一定温度和压力下,在填充有专用固定催化剂的反应容器中,利用氧化剂将废水及污泥中的有机物、氨氮化合物不经稀释,一次处理即可将高含量工业有机废水中的COD、总有机碳(TOC)、氨等污染物催化氧化进行深度分解处理,使其转变为CO2、N2和水等无害成分,并同时脱色、除臭及杀菌消毒,从而达到净化处理废水的目的[2]。 由于氧化催化剂具有选择性,有机化合物的种类和结构不同,所需要的催化剂也不同,因此在采用该工艺处理废水时,对催化剂进行筛选评价是一个非常重要的环节。目前,应用于CWO的催化剂主要包括过渡金属及其氧化物、复合氧化物和盐类等。本实验采用溶胶-凝胶法制备了磁载TiO2-SiO2-Fe3O4复合微粒,并以空气为氧化剂,对高盐度有机废水的催化降解工艺进行了研究[3]。
1 实验部分
1.1 试剂和仪器
硫酸亚铁(FeSO4·7H2O)、硫酸铁(Fe2(SO4)3)、钛酸丁酯(C16H36O4Ti)、正硅酸乙酯((C2H5)4SiO4)等,均为AR。
TD-3000型X射线衍射仪,NICOLET6700型红外光谱仪,HI99724A型BOD测定仪,SHB-Ⅳ双A循环水式多用真空泵,JJ-1精密增力电动搅拌器。
1.2 磁基体的制备
将2价铁盐和3价铁盐按一定比例混合,溶解于一定量的新煮沸的冷却蒸馏水中,溶解过程中加入少量的稀硫酸和聚乙二醇,溶解完全后过滤以除去其中的杂质,过滤到500 mL三口烧瓶中,升温至(65±1)℃,剧烈机械搅拌下,控制一定的滴加速度滴加质量分数为25%的氨水溶液,直至溶液的pH为10~11;继续恒温搅拌2 h,然后35℃水浴中晶化1 h,将所得溶液磁力沉降,用蒸馏水抽滤洗涤至最终的pH为7,再醇洗3次,然后于80℃下真空干燥,研磨后保存备用,即得磁基体Fe3O4粒子。
1.3 磁基体表面包覆SiO2
取一定量的上述磁基体Fe3O4粒子分散于无水乙醇中,加入几滴油酸,超声波分散10 min,然后于50℃恒温水浴下搅拌,同时加入一定量的正硅酸乙酯,搅拌10 min后,加入适当的浓氨水(质量分数25%~28%),滴加完毕后,继续搅拌3 h,所得产物磁力沉降,用蒸馏水抽滤洗涤,直至洗后的溶液不再变浑浊,然后醇洗3次,红外干燥5 h,再置于80℃烘箱中干燥,研细,即得SiO2-Fe3O4。
1.4 TiO2-SiO2-Fe3O4的制备
参照文献[4]方法,准确称取1 g SiO2-Fe3O4于三口烧瓶中,同时将无水乙醇、钛酸丁酯按一定比例加入三口烧瓶中,超声波分散10 min,然后(40±1)℃水浴中强力搅拌40 min,使之充分分散,再逐滴加入一定量的H2O、无水乙醇和HCl的混合物。滴加完毕,继续搅拌1 h直至形成凝胶,红外干燥10 h,再置于90℃烘箱中干燥,研磨后,于马弗炉中450℃下煅烧2 h,即得TiO2-SiO2-Fe3O4复合微粒。
1.5 高盐度有机废水催化降解
人工模拟有机废水:准确称取一定量甲醇、甲苯、丙三醇、异丙醇和NaCl,用蒸馏水溶解,定容,得Cl-的质量分数为4%、COD为20~30 g/L的模拟高盐度有机废水储备液,将储备液置于冰箱中保存。
废水催化降解实验:量取100 mL废水样于250 mL三口烧瓶中,然后调节水样的pH,加入一定量的催化剂,在恒温水浴磁力搅拌下,通入空气,反应1 h;冷却后过滤,取过滤后的清液20 mL,采用国标法(重铬酸钾法)测其COD,计算其去除率[5]。
BOD5的测定:采用快速BOD测定仪测定。
2 结果与讨论
2.1 催化剂的筛选
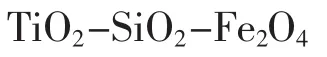
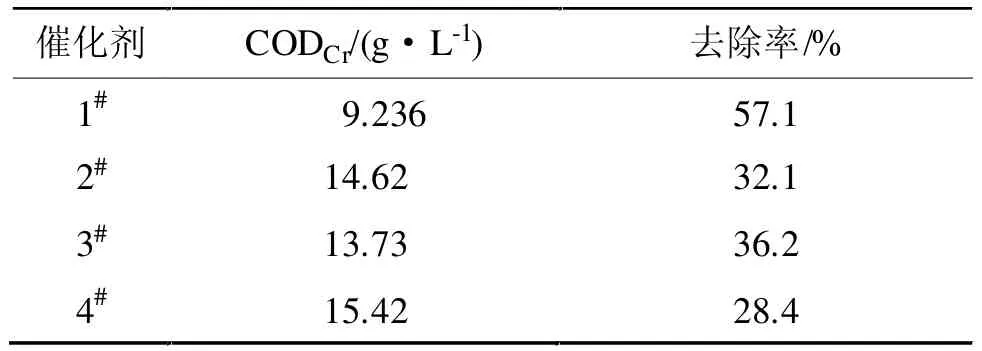
表1 不同催化剂COD去除结果Tab 1 The removal result of COD with diflerent catalyst
2.2 X射线衍射分析
图 1 是 Fe3O4、SiO2-Fe3O4和 TiO2-SiO2-Fe3O4的XRD图谱。
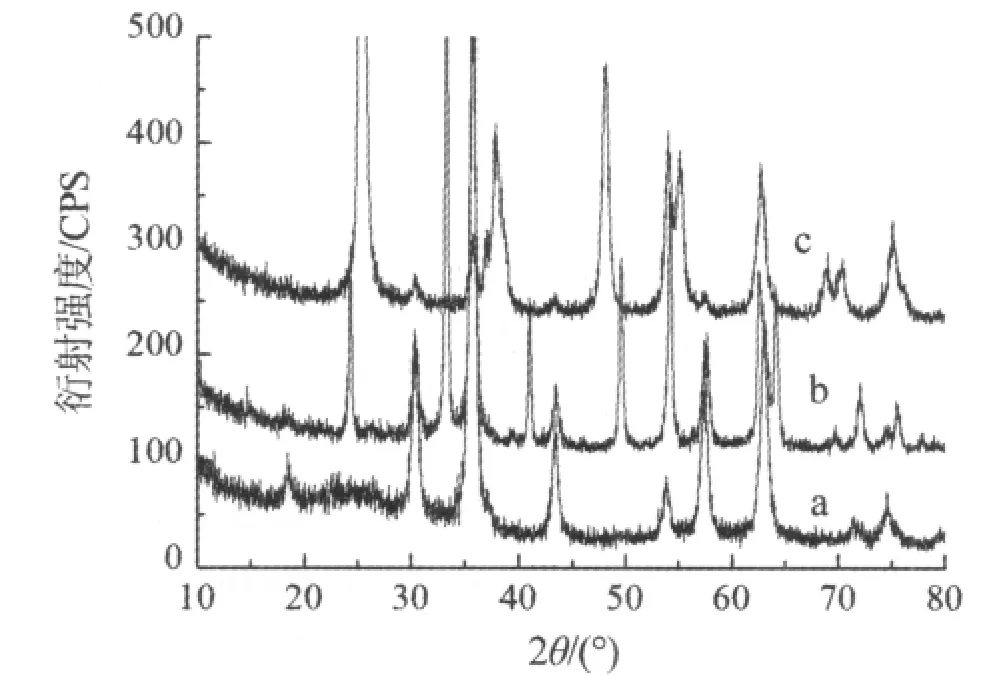
图 1 Fe3O4(a)、SiO2-Fe3O4(b)和TiO2-S iO2-Fe3O4(c)的 XRDFig 1 XRD patterns of Fe3O4(a),SiO2-Fe3O4(b)and TiO2-S iO2-Fe3O4(c)
由图 1 可知,对 Fe3O4(a),2θ在 30.3°、35.8°、63.1°处出现的峰是其特征峰,还可看到部分Fe2O3的特征峰,可能是部分Fe3O4被氧化所至,这与Fe3O4在空气中易被氧化有关;对 SiO2-Fe3O4(b),2θ=24.1°是SiO2的特征峰,除了有Fe3O4的特征峰外,还出现了较大的波包,这是无定型SiO2和一些玻璃体物质的特征,说明Fe3O4的包覆层是无定SiO2;对TiO2-SiO2-Fe3O4(c),2θ在 25.4°、37.1°、48.3°、54.0°、55.2°、68.8°处出现的峰,分别对应于锐钛矿TiO2的(101)、(004)、(200)、(105)、(211)、(204)的晶 面 ,说 明 SiO2-Fe3O4复合颗粒表面确实包覆了一层TiO2,并且以锐钛矿相存在。
2.3 红外光谱分析
图2是3种催化剂的XRD图谱。
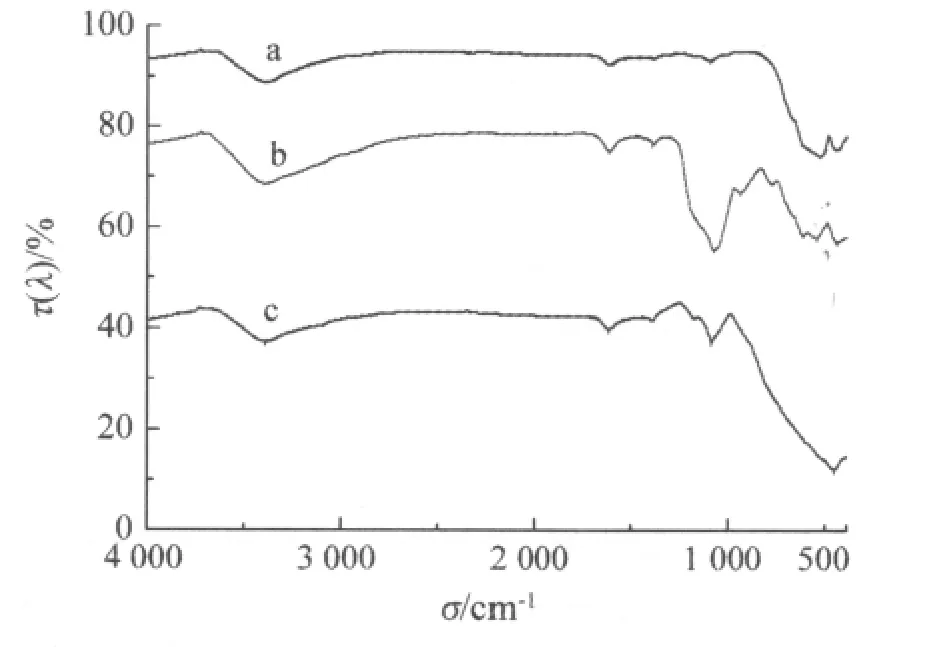
图 2 Fe3O4(a)、SiO2-Fe3O4(b)和TiO2-SiO2-Fe3O4(c)的红外光谱Fig 2 FT-IR spectra of Fe3O4(a),SiO2-Fe3O4(b)and TiO2-SiO2-Fe3O4(c)
由图 2可知,对 Fe3O4(a),548.4 cm-1处是其Fe—O的特征吸收峰,另外3 399.8 cm-1处的较强吸收峰是其表面缔合羟基的伸缩振动峰,说明该样品在空气中吸水性较强;对SiO2-Fe3O4(b),1 090.6 cm-1处的吸收峰是SiO2膜中Si—O—Si键的反对称伸缩振动,3 400.3 cm-1处的吸收峰为表面吸附水的羟基的吸收峰,458.4 cm-1处的吸收峰对应于Si—O—Si键的弯曲振动,957.1 cm-1处出现的Si—O—H特征峰说明Si元素为壳层,这也验证了Fe3O4被完全包覆,由此表明形成了SiO2膜;在562.1 cm-1处有Fe3O4粒子产生弱的吸收峰,粒子改性以后,形成了Fe—O—Si键,可能是因为 Si—O的吸收峰强于Fe—O且两者距离较近的缘故;对 TiO2—SiO2—Fe3O4(c),1 629.4 cm-1处的峰为表面吸附H2O分子H—O—H键之间的弯曲振动,1 102.1 cm-1处的吸收峰是Si—O—Si键的反对称伸缩振动,但其吸收强度大大减弱,469.2 cm-1处的吸收峰对应于Ti—O的特征吸收峰,另外SiO2在400~600 cm-1处的特征吸收峰基本上被TiO2中Ti—O的伸缩振动峰掩盖,也说明SiO2被包覆在其中。
2.4 正交试验
设计了以pH(A)、催化剂加入量(B)、空气体积流量(C)及反应温度(D)为变量的4因素3水平的L9(34)正交试验,如表2所示。水样体积100 mL,反应时间均为1 h,结果列于表3。

表2 正交试验因素水平Tab 2 The factor level of orth ogonal test
由表3正交试验的结果和极差分析可以看出,在选定的影响因素中,pH对COD去除率影响最大,其次是催化剂质量,再次是空气体积流量,最后是反应温度。由此确定的最优试验操作条件为:pH=4,催化剂加入量为0.3 g(100 mL水样中),空气体积流量为2 L/min,反应温度60℃,在此条件下,COD的去除率达到62.0%。
2.5 可生化性
测得高盐度有机废水处理前BOD5为3.92 g/L,BOD5/COD为0.182<0.2,废水难生化降解;在最优试验操作条件下废水催化氧化后的BOD5为3.35 g/L,BOD5/COD为0.409>0.45,可生化性有很大提高,由难生化降解变为易生化降解[6]。
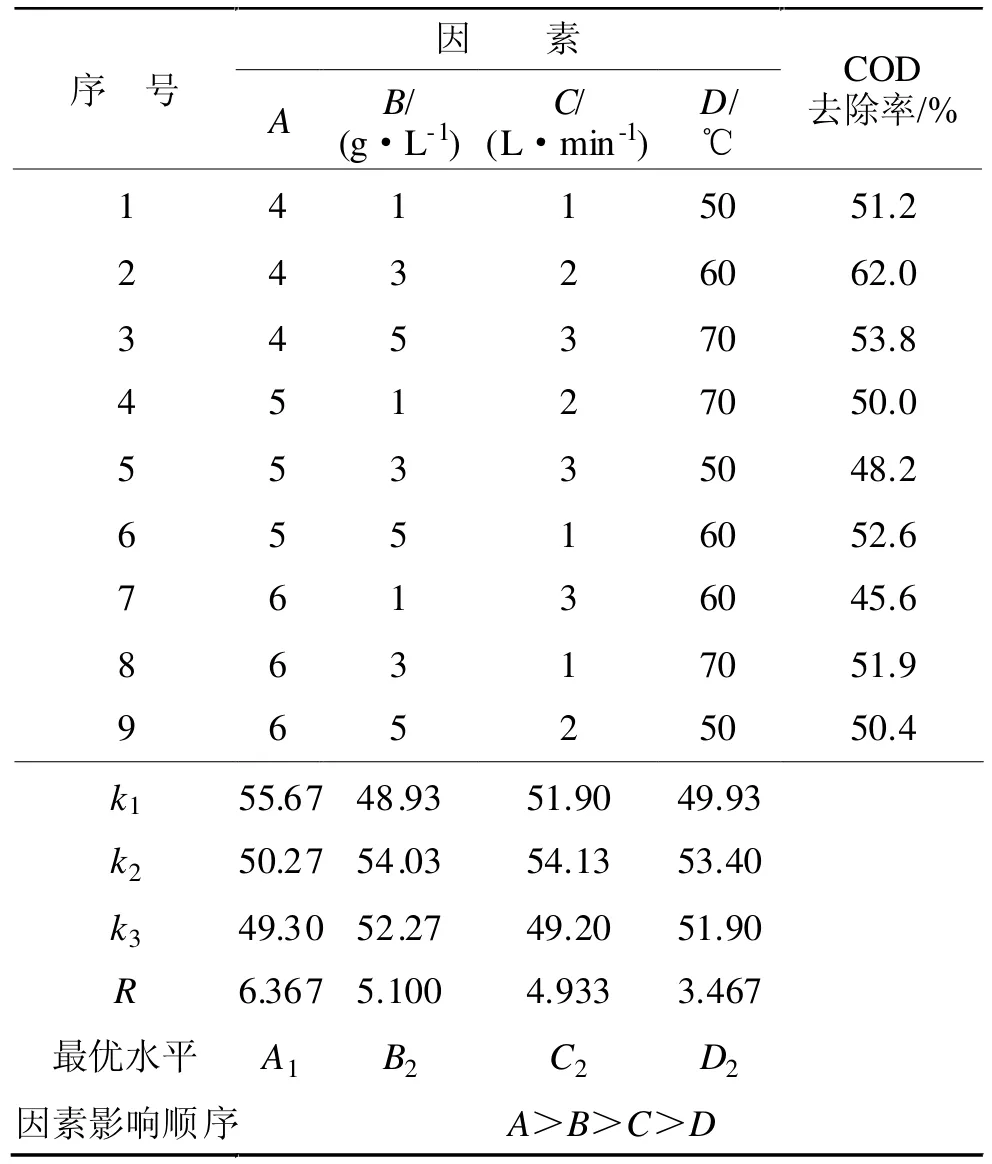
表3 高盐度有机废水COD去除率直观分析表Tab 3 The analysis table of COD remlval ratio by high sanlinity organic wastewater
2.6 催化剂的重复使用
将盛有含催化剂TiO2-SiO2-Fe3O4的反应液的三口烧瓶转移至永久磁铁上,稍后待催化剂完全被磁铁吸至三口烧瓶底部时,将澄清的上层反应液直接倒出,回收后的催化剂再经干燥,称量,回收后的催化剂重新用于高盐度有机废水的催化降解实验,测其COD,计算其去除率。
结果表明,催化剂使用1、2、3次的COD去除率为61.6%、60.1%、59.7%。可以看出,新制的催化剂活性较高,第1次使用后的催化剂的活性稍微下降,催化剂部分失活的原因可能是由于反应中的有机物覆盖在催化剂的表面上使其结炭,导致催化剂活性中心减少[7]。另外发现经过第1次使用后,以后的几次使用中其催化性能几乎相差不大,这说明了新制催化剂表面的一些活性位在催化氧化反应中被钝化后,催化剂的活性变得比较稳定。由于所制备的催化剂有一定的磁性能,3次循环使用后,其COD去除率仍可保持在60%左右,故该催化剂可多次循环利用,降低运行成本。
3 结论
(1)通过正交试验得出最佳反应条件为:有机废水pH=4.0,催化剂的用量为3.0 g/L,空气体积流量为2 L/min,反应时间为1 h,反应温度为60℃。
(2)催化剂TiO2-SiO2-Fe3O4对高盐度有机废水的催化降解CODCr去除率达62.0%,处理效果较好,且该工艺流程简单,反应条件温和,作为预处理工艺有一定的研究价值和应用开发前景。
(3)TiO2-SiO2-Fe3O4复合催化剂经过多次循环使用后,仍具有较好的催化活性。说明所制复合微粒TiO2-SiO2-Fe3O4对高盐度有机废水有较好的催化降解性能,同时也有较好的磁性回收性能,可循环利用降低运行成本。
[1]Binder.Use of SBR′S to treat pesticide wastewater:Presented at the notre dame/mile hazardous waste conference[C].South Bend:University of Notre Dame,1992.
[2]林佩斌.湿式催化氧化技术在工业废水处理中的运用[J].有色冶金设计与研究,2002,4(23):75-77.
[3]Briuker C J,Scherer G W.Sol-Gel Science the Physics and Chemistry of Sol-Gel Processing[M].Academic Press:INC,1990.
[4]包淑娟,张校刚,刘献明.磁载纳米TiO2光催化剂的制备及其光催化性能研究[J].分子催化,2003,17(2):96-100.
[5]GB 11914-89水质化学需氧量的测定重铬酸钾法[S].
[6]张丹.Fenton氧化-活性炭吸附预处理天然气净化检修废水试验研究[D].成都:南交通大学,2008:43.
[7]张密林,王君,梅长松,等.磁性纳米固体超强酸的合成、表征及性能[J].高等化学学报,2002,23(7):1347-1351.
X703.1,TQ032.41
A DOI10.3969/j.issn.1006-6829.2011.02.013
2011-02-09
四川理工学院创新基金(y2009026)
*通讯联系人;E-mail:dingjie@suse.edu.cn
