壳聚糖凝胶球的制备及对银离子的吸附
2011-11-07李东亮
韩 彤 张 良 李东亮
(西安建筑科技大学理学院,西安 710055)
安全与环保
壳聚糖凝胶球的制备及对银离子的吸附
韩 彤 张 良 李东亮
(西安建筑科技大学理学院,西安 710055)
以壳聚糖(CTS)为基材、硝酸银为印迹物,提出了一种新的CTS水凝胶球的制备方法。采用Ag+吸附容量作为评价指标,对凝胶球的制备条件进行了优化,并进行了吸附试验。结果显示,当CTS用量为质量分数2.5%、交联剂用量为体积分数3.0%、凝固浴三乙醇胺的质量分数为10.0%、制备温度为25℃,热处理温度为60℃,洗脱剂硫代硫酸钠的质量浓度为20.0 g/L时,所制备凝胶吸附效果较佳;当水中Ag+的质量浓度为6.0 g/L时,凝胶球饱和吸附容量为434 mg/g;对于质量浓度为2.0 g/L Ag+溶液,7.5 h可达到吸附平衡,平衡吸附量为353 mg/g。
壳聚糖;银离子;凝胶球;吸附
银的回收再利用问题一直是研究的热点,常用的银回收技术包括电解法、沉淀法、置换法、离子交换法与吸附法等[1]。其中吸附法可弥补传统方法的不足,且低能耗,因此受到研究者广泛关注。当前的研究,更多的是集中在新型吸附材料的研究与开发。壳聚糖(CTS)对重金属具有良好吸附性能的这一特性引起了研究者注意,先后有研究者进行了CTS-Ag+配合物的合成研究,使得利用CTS对银吸附回收有了理论基础[2]。
CTS为粉末状材料,耐酸性差,再利用性不高,所以在应用中受到了限制。为了增强各方面性能,改变CTS的形态成为研究者的关注方向。先后制备出CTS膜以及CTS凝胶、交联CTS膜、交联CTS凝胶等[3-6]。这些改进,一定程度改善了CTS本身的一些缺点,但是凝胶的制备过程复杂、耗时较长,难以形成较高机械强度的凝胶球。此外,在凝胶材料的应用研究中,也未发现对银的吸附研究报道。
本研究利用相转化法,以三乙醇胺为凝固浴,CTS溶液在其中可以快速形成水凝胶,形成的水凝胶颗粒具有较高的机械强度及较大粒径,适合用于固相吸附及分离。并且研究了此凝胶对银的吸附性能。
1 实验部分
1.1 仪器与试剂
ES-J系列电子分析天平,CL-2型恒温加热磁力搅拌器,DGF25003C鼓风干燥箱,GFS97型石墨炉原子吸收分光光度计,THZ-82A型台式恒温振荡器。
CTS,脱乙酰度≥90.0%;硝酸银、三乙醇胺等试剂,均为国产分析纯。
1.2 实验方法
1.2.1 CTS凝胶球的制备
配制一定含量的CTS醋酸溶液,加入一定量的硝酸银,避光搅拌至其溶解;滴加适量戊二醛作为交联剂,继续搅拌,待反应充分后,在暗处静置脱泡,得到胶状的透亮微黄的CTS溶液。以三乙醇胺溶液为凝固浴,将上述制备好的CTS水凝胶滴加至三乙醇胺溶液中,形成凝胶球,用去离子水反复冲洗干净。制得的球进行热处理,之后用硫代硫酸钠溶液洗脱银,完毕后静置晾干,待用。
1.2.2 吸附容量的测定
称一定质量的凝胶球,置入25 mL一定含量的AgNO3溶液中,于台式恒温振荡器上,避光振荡吸附8.0 h,吸附完毕后,清洗颗粒。将吸附液定容于50 mL容量瓶,用原子吸收分光光度法测定溶液中Ag+含量,按照下式计算吸附容量Q:
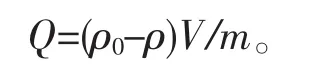
式中,Q为吸附容量,ρ0和ρ分别为吸附前后Ag+的质量浓度,V为吸附液体积,m为凝胶球干质量。
2 结果与讨论
2.1 制备条件对吸附容量的影响
2.1.1 CTS含量
使用不同含量的CTS溶液制备凝胶球,在2.000 g/L的Ag+溶液中进行吸附容量测定,结果如图1所示。
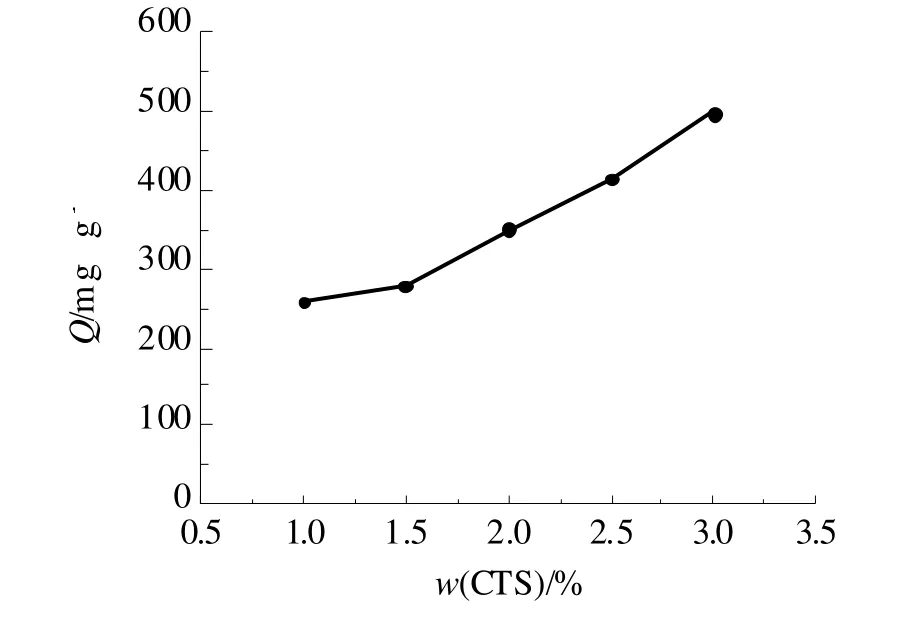
图1 CTS浓度对凝胶球吸附量的影响Fig 1 The effect of chitosan concentration on the adsorption capacity of gel beads
凝胶球的吸附容量随CTS含量增加而增加。CTS作为凝胶球基体材料,其含量增加使得活性吸附点增加,所以吸附容量增加。但是当CTS的质量分数大于2.5%时,溶液粘稠,交联度过大,凝胶球成型过程较为困难,故选择质量分数为2.5%的CTS溶液制备凝胶球。
2.1.2 交联剂用量
在选定含量的CTS溶液中,分别加入定量交联剂,使其中交联剂体积分数分别为0.0、1.0%、2.0%、3.0%、5.0%,制备不同交联剂含量的凝胶球,进行相同的吸附实验,结果见图2。可以看出,在交联剂体积分数为3.0%时吸附达到平衡。
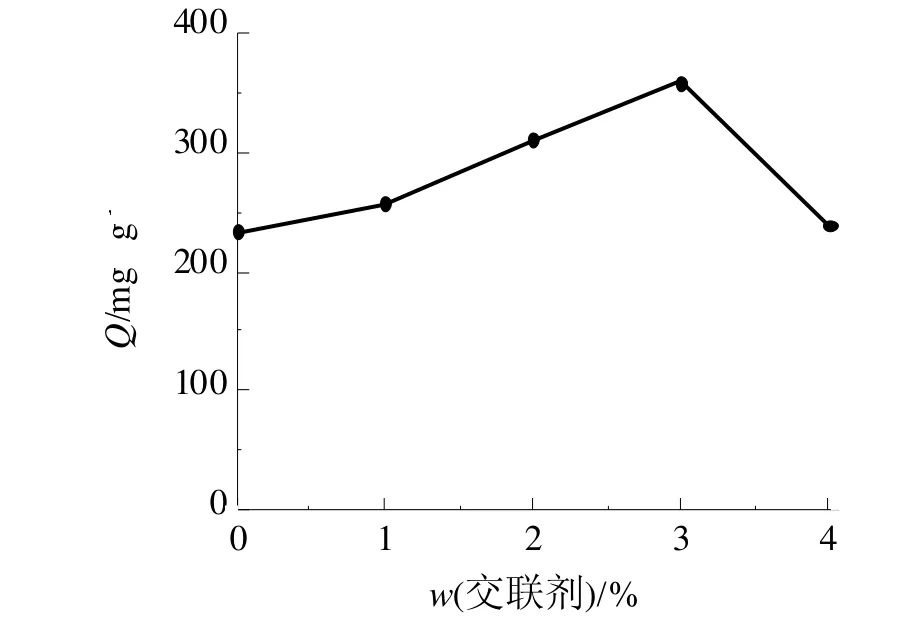
图2 交联剂用量对凝胶球吸附容量的影响Fig 2 The effect of the amount of crosslinker on the adsorption capacity of gel beads
2.1.3 凝固浴含量及温度
配制质量分数分别为 10.0%、20.0%、30.0%、40.0%、50.0%的三乙醇胺(N(CH2CH2OH)3)溶液作为凝固浴制备凝胶球,进行吸附实验,结果见图3。可以看出,三乙醇胺含量对吸附容量并无明显影响,故在确保成球机械强度的条件下,选用较低的三乙醇胺质量分数,为10.0%。
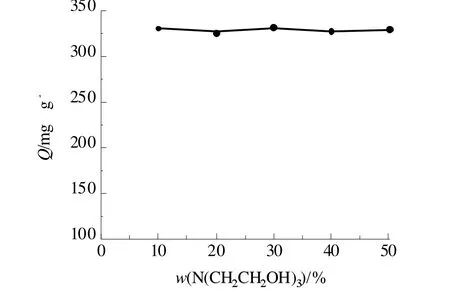
图3 凝固浴含量对凝胶球吸附容量的影响Fig 3 The effect of coagulation bath concentration on the adsorption capacity of gel beads
2.1.4 热处理温度
对于在上述优化条件下制备的凝胶球,分别在20、40、60、80、100 ℃下,进行热处理。 之后,进行吸附容量的测定,结果如图4所示。
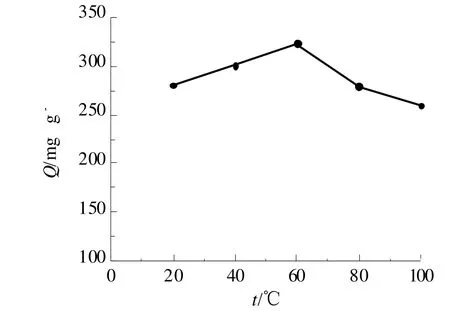
图4 热处理温度对凝胶球吸附容量的影响Fig 4 The effect of heat-treatment temperature on the adsorption capacity of gel beads
由图4可以看出,在60℃下制备的凝胶球吸附容量最高,且随着温度继续升高,吸附容量下降。原因疑是过高的温度对凝胶球结构造成一定程度的破坏。因此,选择60℃作为制备过程中的热处理温度。
2.1.5 洗脱剂的选择及其含量
上述优化条件下制备的凝胶球,分别浸入25 mL、质量浓度为10.0 g/L的乙二胺四乙酸二钠溶液、硫代硫酸钠溶液和硫脲溶液中。洗脱10 h,用去离子水浸泡冲洗。结果显示,用硫脲洗脱的凝胶球完全溶解,乙二胺四乙酸二钠洗脱的凝胶球表面部分溶解,去离子水浸泡后解体成细粉状;硫代硫酸钠溶液洗脱的凝胶球外观及强度均无变化,将洗脱后的凝胶球浸入碱性条件下的水合肼溶液中,无颜色变化,说明Ag+已被充分洗脱,故选用硫代硫酸钠溶液作为本吸附材料的洗脱剂。
用质量浓度分别为 5.0、10.0、15.0、20.0、25.0 g/L的硫代硫酸钠溶液洗脱凝胶球,发现在20.0 g/L时,洗脱速度快,且Ag+的洗脱较完全。
2.2 吸附时间对凝胶球吸附量的影响
取一定量优化条件下制备的凝胶珠,加入质量浓度2.0 g/L的Ag+溶液,间隔一定时间取样检测。结果如图5所示,此凝胶对Ag+吸附量随着时间的增加而增加,到7.5 h基本达到吸附平衡,在此条件下的平衡吸附量为353 mg/g。
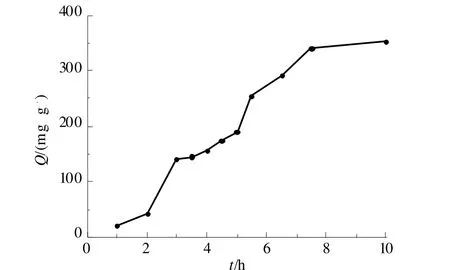
图5 吸附时间对凝胶球吸附容量的影响Fig 5 The effect of adsorption time on the adsorption capacity of gel beads
2.3 吸附液Ag+含量对吸附的影响
向不同初始Ag+含量的吸附液中,加入优化条件下制备出的等质量凝胶球,吸附10 h后检测。结果如图6所示。
CTS凝胶球对Ag+的吸附量随着Ag+含量的增加而增加,到6.0 g/L时达到吸附饱和,饱和吸附量达到434 mg/g。
3 结论
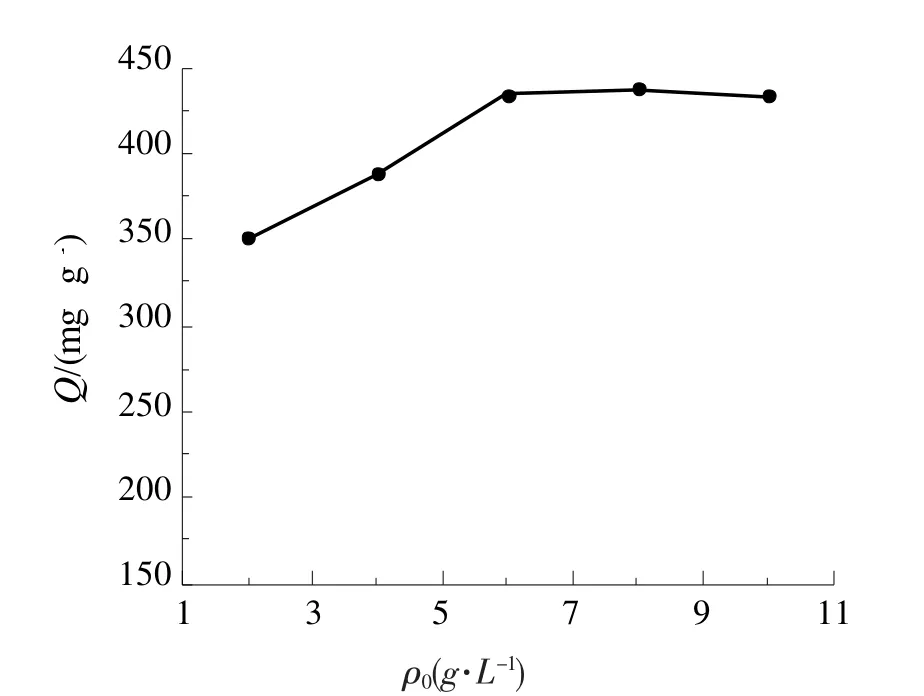
图6 吸附液Ag+含量对凝胶球吸附容量的影响Fig 6 The effect of the concentration of adsorption solution on the adsorption capacity of gel beads
以三乙醇胺溶液为凝固浴,采用相转化法制备出性能优良的CTS凝胶球。该方法成球迅速,制作简单,制备的凝胶球能够应用于金属离子的回收。以Ag+为吸附对象,优化了凝胶球的制备条件,结果显示,当CTS用量为质量分数2.5%、交联剂用量为体积分数3.0%、凝固浴三乙醇胺的质量分数为10.0%、制备温度为25℃、热处理温度为60℃、洗脱剂硫代硫酸钠的质量浓度为20.0 g/L时,所制备凝胶吸附效果较佳。吸附研究结果表明,当水中Ag+的质量浓度为6.0 g/L时,凝胶球饱和吸附容量为434 mg/g;对于质量浓度为2.0 g/L Ag+溶液,7.5 h可达到吸附平衡,平衡吸附量为353 mg/g。
[1]黄美荣,李振宇,李新贵.含银废液来源及其回收方法[J].工业用水与废水,2005,36(1):9-12.
[2]张苏敏,魏永锋,郎惠云.壳聚糖银(I)配合物的合成及吸附动力学[J].化学通报,2005(4):296-300.
[3]Zofia Modrzejewska,Irena Korus,Pior Owczarz.The effect of seasoning a membrane-forming solution on the separation properties of chitosan membranes[J].Jurnal of Membrane Science,2001,181:229-239.
[4]Sudipta Chatterjee,Tania Chtterjee,Seung H Woo.A new type of chitosan hydrogel sorbent generated by anionic surfactant gelation[J].Bioresource Technology,2010,101:3853-3858.
[5]Jen Ming Yang,Wen Yu Su,Te Lang Leu,et al.Evaluation of chitosan/PVA blended hydrogel membranes[J].Journal of Membrane Science,2004,236:39-51.
[6]Z M Wu,X G Zhang,C Zheng,et al.Disulfide-crosslinked chitosan hydrogel for cell viability and controlled protein release[J].European Journal of Pharmaceutical Sciences,2009,37:198-206.
TQ 028.1+5
A DOI10.3969/j.issn.1006-6829.2011.02.014
2011-02-17
