不能用CaCl2鉴别Na2CO3和NaHCO3溶液的理论分析
2011-11-07李大塘
刘 狄,李大塘
(湖南科技大学化学化工学院,湖南湘潭411201)
不能用CaCl2鉴别Na2CO3和NaHCO3溶液的理论分析
刘 狄,李大塘
(湖南科技大学化学化工学院,湖南湘潭411201)
通过理论分析,CaCl2与NaHCO3溶液混合也能产生沉淀,是因为碳酸氢根离子HCO3-的解离而产生了足量的碳酸根离子CO23-所致。进一步分析结果显示,Ca(HCO3)2溶液不产生沉淀的条件是其溶液中H+的浓度应大于2.26×10-7mol/L。向CaCl2溶液中通入CO2因会产生H+而无沉淀生成;只有向澄清的石灰水中通入过量CO2至溶液呈微酸性时才能使产生的碳酸钙溶解,这些实验现象都说明了这一点。因此,不能用CaCl2来鉴别Na2CO3和NaHCO3溶液。
碳酸钙;碳酸氢钙;沉淀;溶解;解离
一 问题的提出
Na2CO3与NaHCO3都被广泛用于日常生活、食品卫生、医药保健、工业生产和科学研究等领域,其溶液都为无色透明体,肉眼无法直接加以鉴别。教材[1-3]普遍介绍钙的碳酸盐难溶于水,而其碳酸氢盐易溶于水,自然界中溶洞、钟乳石、石笋和石柱的形成固然与钙的这种性质密切相关[2,3]。因此,在化学教学中通常介绍鉴别碳酸钠和碳酸氢钠溶液的方法是分别向两种溶液中滴加CaCl2溶液,如果不产生沉淀或浑浊现象,则所鉴别的溶液为NaHCO3溶液,产生白色沉淀就为Na2CO3溶液。然而在反复实验中的结果却一致表明,即使等体积混合0.02 mol/L的NaHCO3溶液与0.02 mol/L的CaCl2溶液仍能观察到溶液变浑浊现象。显而易见,用CaCl2溶液鉴别常量浓度(10mg/mL)的Na2CO3和NaHCO3溶液是缺乏实验依据的,原因何在?什么条件下Ca(HCO3)2溶液不产生沉淀,或其溶液中最小氢离子H+的有效浓度应为多少才能使Ca(HCO3)2溶液保持澄清呢?有常量浓度而澄清透明的Ca(HCO3)2的碱性溶液吗?
二 理论分析
1.使Ca(HCO3)2溶液产生沉淀的原因
仅仅考虑HCO-3解离的影响
如果等体积混合0.02 mol/L的 CaCl2溶液与0.02 mol/L的NaHCO3,已知混合液:=0.01 mol/L,Ka1=4.2 × 10-7,Ka2=5.6 × 10-11,因为 cKa1,所以
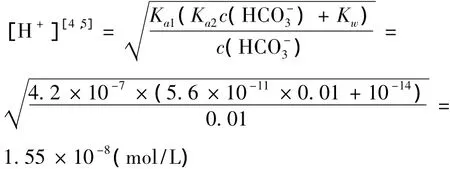
再求溶液中碳酸根离子的分布分数:
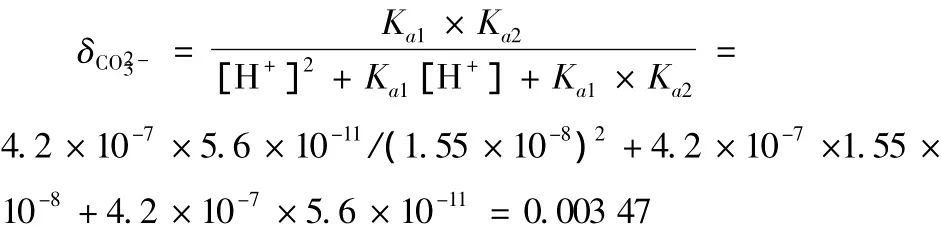
Q=[Ca2+][CO23
-]=0.01 ×3.47 × 10-5=3.47 × 10-7>Ksp(CaCO3)=2.9×10-9。进一步考虑钙配离子的影响
Ca2+,平衡常数 K=10[6],系统全面进行分析时应考虑[CaHCO3]+的生成。
等体积混合0.02mol/L的NaHCO3溶液和0.02mol/L的CaCl2溶液后的起始浓度均为0.01mol/L,令其平衡浓度都为x mol/L,那么它们的转化浓度为(0.01 - x)mol/L。

平衡时x x 0.01-x
考虑了钙配离子的产生后,仍有沉淀或浑浊现象。再考虑离子强度的影响
大家知道,离子强度非常明显的影响离子的有效浓度是一个不争的事实。混合液中,[Ca2+] =0.009 16 mol/L,[Na+]=0.01 mol/L,0.009 16 mol/L,[CaHCO3]+≈ 0.000 84 mol/L,[Cl-]=0.02 mol/L,0.000 031 8 mol/L。可以忽略H+和OH-的浓度不计,因为它们的浓度实在太小。I=0.5 ×(0.009 16 ×22+0.01 ×12+0.009 16 ×12+0.000 84 ×12+0.02 ×12+0.003 18 ×22)=0.038 38(mol/L)。
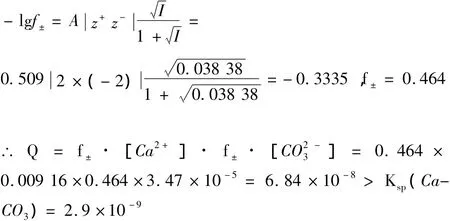
显然,全面考虑[CaHCO3]+的形成和离子强度影响离子有效浓度等因素,即使很稀的NaHCO3溶液与CaCl2溶液混合也会出现浑浊甚至沉淀现象。所以不能用CaCl2来鉴别Na2CO3与NaHCO3溶液。
2.Ca(HCO3)2溶液能保持澄清透明的条件
当CaCl2溶液与NaHCO3溶液混合,即使它们的有效浓度很稀仍能观察到浑浊甚至沉淀现象,那么,什么条件下Ca(HCO3)2溶液不产生沉淀,或应控制其溶液中最小氢离子H+的有效浓度为多少Ca(HCO3)2溶液才能保持澄清透明呢?我们仍设混合后CaCl2和NaHCO3的起始浓度分别是0.01 mol/L为例,如前分析的浓度必须小于1.474×10-6mol/L才能使 Ca(HCO3)2溶液不产生沉淀。
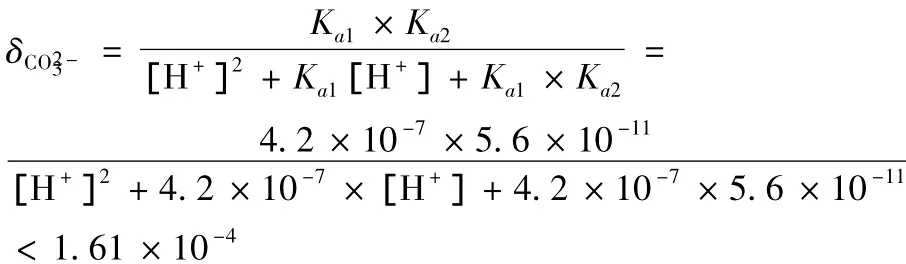
解得 [H+]>2.26 ×10-7mol/L。
显然,只有微偏酸性的Ca(HCO3)2溶液才能保持澄清透明。正如大家知道的一样,向澄清石灰水中通入少量CO2气体会产生白色沉淀。事实上只有通入CO2气体过量到溶液呈微酸性时,才能溶解所产生的沉淀。通CO2气体于CaCl2溶液中没有沉淀产生也是因为产生了H+的原故。
三结论
(1)向NaHCO3溶液中滴入CaCl2溶液也能观察到明显的浑浊或沉淀现象。因此,不能用CaCl2来鉴别Na2CO3和NaHCO3溶液。
(2)澄清透明的Ca(HCO3)2溶液一定微偏酸性,没有常量浓度而澄清透明的Ca(HCO3)2碱性溶液。
(3)溶液中H+的浓度最小为2.26×10-7mol/L才能使Ca(HCO3)2溶液不产生沉淀。
(4)向CaCl2溶液中通入CO2因会产生H+使溶液呈酸性,因而无沉淀生成。
[1]武汉大学,吉林大学.无机化学(下册)[M].第三版.北京:高等教育出版社,1994.
[2]北京师范大学,华中师范大学,南京师范大学.无机化学(下册)[M].第三版.北京:高等教育出版社,1993.
[3]天津大学无机化学教研室.无机化学(下册)[M].第二版.北京:高等教育出版社,1996.
[4]武汉大学.分析化学[M].第三版.北京:高等教育出版社,1995.
[5]华中师范大学,东北师范大学,陕西师范大学.分析化学[M].第二版.北京:高等教育出版社,1994.
[6](美)ButlerJN.离子平衡及其数学处理[M].陆淑引,许晓文,王新省等译.天津:南开大学出版社,1989.
[7]傅献彩,沈文霞,姚天扬.物理化学(下册)[M].第四版.北京:高等教育出版社,1995.
[8]上海师范大学,河北师范大学,华中师范大学等.物理化学(下册)[M].第二版.北京:高等教育出版社,1985.
O6-051
A
1674-5884(2011)10-0072-02
2011-07-10
国家级化学特色专业资助项目
刘 狄(1966-),男,湖南湘潭人,副教授,主要从事化学教学与研究工作。
(责任编校 谢宜辰)
