固定化小麦酯酶生物传感器的制备及应用
2011-11-06王会友王振宇
王会友,王 涛,王振宇,2,于 伟
(1.东北林业大学林学院食品科学专业,黑龙江哈尔滨150040; 2.哈尔滨工业大学食品学院,黑龙江哈尔滨150086)
固定化小麦酯酶生物传感器的制备及应用
王会友1,王 涛1,王振宇1,2,于 伟1
(1.东北林业大学林学院食品科学专业,黑龙江哈尔滨150040; 2.哈尔滨工业大学食品学院,黑龙江哈尔滨150086)
将固定化酶膜与精密酸度计的玻璃电极连接制备出了生物传感电极探头,并对两种常见的有机磷农药乐果和敌百虫进行测试,结果:乐果浓度在1×10-8~1×10-3mol/L内与小麦酯酶的抑制率呈线性关系,回归方程为y=13.02x +118.7,相关系数为0.995,最低检出限(LDC)为1.7×10-9mol/L;敌百虫浓度在1×10-8~1×10-3mol/L内与小麦酯酶的抑制率呈线性关系,回归方程为y=13.08x+112.7,相关系数为0.997,LDC为1.1×10-8mol/L。以国家标准方法测得结果为对照,进行实际样品检测,检测方程得出的结果回收率为真实值的87.9%~92.3%,而生物敏感膜重复使用20次以内其酶活保存率为初始酶活的90%左右。因此,此传感器可以应用于现场有机磷农药的实验检测等。
固定化,小麦酯酶,生物传感器,有机磷农药
1 材料与方法
1.1 材料与仪器
小麦(龙麦26号) 黑龙江省农科院育种研究所提供;固定化小麦酯酶酶膜 实验自制;丙酮 天津市北方天医化学试剂厂;α-萘酚、乙酸-α-萘酯国药集团化学试剂有限公司;固蓝B、TritonX-100、2-吡啶醛肟甲基碘化物 Sigma;TEOS 北化恒业精细化工有限公司;PVA 天津市科密欧化学试剂开发中心;PEG-400、甘油 天津市光复精细化工研究所。
电子恒温水浴锅(DK-98-I) 天津泰斯特仪器有限公司;磁力搅拌器(78-1) 江苏海门市其林贝尔仪器制造有限公司;精密型酸度计(pHS-3C) 上海雷磁仪器厂;饱和甘汞电极 上海罗素科技有限公司;气相色谱仪(GC-2010) 日本岛津公司。
1.2 实验方法
1.2.1 固定化小麦酯酶酶膜的制备工艺 小麦→粉碎→过40目筛→盐溶液提取→离心分离→取上清液→过滤→测定酶活→固定化制备小麦酯酶酶膜
固定化制备方法:将去离子水与一定量的硅酸酯类化合物按照一定比例混合(R值为8.25,V/V),加入25μL HCl,120mL甘油溶液(75%)和400mL聚乙烯醇(PVA)溶液(5%),超声30min。之后吸取80μL溶胶,加入 150μL 9.84%的 TritonX-100和162μL 5.41%的PEG-400溶液,漩涡振荡20min即得到溶胶。
将小麦酯酶以30mL/g的比例溶解于pH6.6的磷酸缓冲溶液(PBS)中,磁力搅拌30min。吸取60μL的酶液加入到杂化溶胶中,旋涡振荡10min。吸取100μL的混合溶胶均匀涂布于载玻片上,于4℃干燥36h,即得到固定化后的小麦酯酶。
1.2.2 小麦酯酶酶活测定方法 酶活的测定根据Asperen[8]等方法改进。
1.2.2.1 α-萘酚标准曲线的绘制 用3mL不同浓度的α-萘酚溶液与0.5mL 0.8%固兰B盐3.5%SDS溶液混合均匀,30℃恒温水浴5min。用蒸馏水作空白,待1min读数稳定后595nm处读取OD值。以吸光度为横坐标,浓度为纵坐标,得标准曲线。
1.2.2.2 小麦酯酶酶活的测定 将酶液按一定比例稀释,取3mL稀释后的酶液加入25μL 0.8mmol/L乙酸α-萘酯丙酮溶液,漩涡振荡均匀,在30℃恒温水浴5min。之后加入0.5mL 0.8%固兰B盐3.5%SDS溶液,漩涡振荡均匀,于30℃恒温水浴5min。用不加乙酸-α-萘酯的反应液作空白,待1min读数稳定后在595nm读取OD值。根据下式计算酶液的活性:

式中:E:小麦酯酶活性(U/mL);C:酶液的稀释倍数;k:α-萘酚标准曲线斜率;y:α-萘酚标准曲线的截距;OD:反应液的吸光度;V:反应酶液的体积,mL。
1.2.3 生物传感电极探头元件的制备 将1mL的TEOS与7.7mL的去离子水按照一定比例混合,加入25μL HCl,120mL甘油溶液(75%)和400mL聚乙烯醇(PVA)溶液(5%),超声30min。之后吸取80μL溶胶,加入150μL 10.13%的TritonX-100和162μL 5.80%的PEG-400溶液,漩涡振荡20min即得到杂化溶胶。
将纯化后的小麦酯酶以30mL/g的比例溶解于一定pH6.5的磷酸缓冲溶液(PBS)中,磁力搅拌30min。吸取60μL的酶液加入到杂化溶胶中,旋涡振荡10min。吸取100μL的混合溶胶均匀涂布于载玻片上,于4℃干燥36h,即得到固定化后的小麦酯酶。
使用前,将其在pH6.5的磷酸盐缓冲溶液中浸泡10min,再用O型圈将该酶膜固定在球型精密型酸度计玻璃电极表面,即制成生物传感电极探头。
1.2.4 生物传感电极探头元件的测定 移取5.0mL0.001mol/L磷酸盐缓冲溶液(pH=6.5)于电解池中,插入传感器和参比电极,加入乙酸-α-萘酯,使其浓度达到一定浓度,测量出生物传感器的初始电位E0,加入适量含有机磷农药的溶液,温育一段时间,然后测量最终电位E1,则传感器的抑制率为:

在小麦酯酶的催化作用下,乙酸-α-萘酯水解为α-萘酚和乙酸,这个过程的发生使生物反应系统的电位发生变化,有机磷农药能强烈地抑制小麦酯酶的催化作用,所以加入有机磷农药以后,上述反应进行的程度会有所降低,溶液中有机磷农药的浓度越高,反应进行的程度就会越慢,电位改变的幅度相应就越小[9-10]。通过建立抑制率和农药浓度间的关系曲线,可以得出农药的检测方程,来确定农药的浓度[11]。
2 结果与讨论
2.1 α-萘酚标准曲线
根据ASPEREN等的方法测得OD值与α-萘酚含量关系,绘制标准曲线如图1。

图1 α-萘酚标准曲线
2.2 酶负载量对生物传感电极探头电位响应的影响
将冷冻干燥后不同质量的小麦酯酶(1~4g)溶解到30mL的pH6.5的磷酸缓冲溶液(PBS)中,吸取60μL的酶液用溶胶凝胶法固定,测定底物的电位响应[12]。
如图2所示,当酶膜上固定2g小麦酯酶时,其响应的峰电位达到最大值。但是,当进一步增加酶的负载量时,膜的厚度增加,导致电阻增大,从而该生物传感器对乙酸-α-萘酯的响应减小。采用含有较低的酶负载量,有利于减小膜中的扩散障碍,实现对低浓度农药的动力学控制和高灵敏度。所以采用2g小麦酯酶为每张酶膜上最佳的酶的负载量。

图2 小麦酯酶负载量对不同浓度乙酸-α-萘酯的电位影响
2.3 溶胶凝胶量与小麦酯酶的体积比对生物传感探头电位响应的影响
由于溶胶凝胶法可以很好地保持蛋白质表面的微观结构的整体性和方向一致性,从而对组分的活性和稳定性损伤较小。溶胶凝胶材料的用量和所固定化的小麦酯酶量之比对测定电位有着直接的影响。比值少,则固定不牢靠,会造成测定过程中酶的流失[13];比值大亦会增大电子转移过程中的电阻,延长响应时间。
固定小麦酯酶固定化量2g,改变溶胶凝胶材料的用量,制备不同溶胶凝胶材料与小麦酯酶体积比的酶膜,用于测定不同浓度底物的电位响应。由图3确定了最佳的溶胶凝胶与小麦酯酶体积比为0.4。

图3 溶胶凝胶体积与酶的体积比对不同浓度乙酸-α-萘酯的稳态电位影响
2.4 缓冲溶液pH对生物传感探头电位响应的影响
实验表明,不同酸度的磷酸盐缓冲溶液会影响到传感器的抑制率[14](图4)。同样测定5×10-3mol/L的乙酸-α-萘酯,pH在6.5~7.5的范围内,响应电位最大,且十分稳定。其中过强的酸碱性对酶都会起到破坏作用,同时由于有机磷农药在pH>8时易发生水解,图中在pH>8时,响应电位的下降可能与此有关。为了测定时既可以获得较高的灵敏度又防止有机磷农药水解,故缓冲溶液的pH选取7.0。
2.5 乙酸-α-萘酯浓度对生物传感探头电位响应的影响

图4 pH对乙酸-α-萘酯响应电位的影响
不同浓度的底物对生物传感器的响应性能会产生影响[15](图5)。实验表明,底物浓度在0.05~1.6mmol/L范围内,响应电位值与底物浓度的对数值呈线性关系,可以在此范围内进行实验。本实验选用0.8mmol/L作为底物浓度。

图5 响应电位与乙酸-α-萘酯浓度的关系图
2.6 温育时间对生物传感器电位响应的影响
两种有机磷农药对小麦酯酶的抑制作用随着时间的变化[16],如图6。酶的残留活性在抑制作用开始的10min里迅速减小,大约10min抑制作用完成95%。所以在农药的测定过程中,温育时间选择为10min。

图6 小麦酯酶残留活性随时间变化趋势
2.7 有机磷农药检测标准曲线的建立
由于有机磷农药对小麦酯酶有抑制作用[17],这样将导致在含有农药的基液中的电位发生变化,电位的变化量与农药的浓度在一定范围内有线性关系。根据公式(1),将电位变化量换算成有机磷农药的抑制率I,见表1和表2。再以抑制率I对乐果和敌百虫两种常用农药浓度对数作图,如图7。

表1 乐果检测实验数据换算表

表2 敌百虫检测实验数据换算表

图7 乐果和敌百虫农药测定标准曲线
结果表明,固定化小麦酯酶对两种有机磷农药的抑制率在其浓度为1×10-8~1×10-3mol/L的范围内成线性关系。线性方程、相关系数R2可求,同时,对小于10-8mol/L浓度农药继续进行检测,得出实际检测下限。各种参数见表3。

表3 两种有机磷农药的检测参数
从表3可以看出,虽然敌百虫的抑制曲线相关系数优于乐果,但是小麦酯酶对乐果的检测下限却要低于敌百虫。这可能是由于小麦酯酶对敌百虫的选择性要强于乐果,而乐果对小麦酯酶的抑制性要高于敌百虫的原因。
2.8 有机磷农药检测曲线的拟合实验
配制适宜浓度的乐果和敌百虫溶液喷洒洗净的白菜后在封闭环境放置过夜,取出后剪成1cm2左右的碎片浸入丙酮溶液中振荡30min过滤,将所得的两种农药的丙酮提取液定容至25mL,采用得到的检测标准曲线和国家标准方法进行检测,结果见表4。

表4 真实样品中两种农药的检测结果(n=5)
采用本实验得出的检测曲线检测样品溶液中两种农药的浓度,测定5次取平均值,为测定值。再按照国家标准方法利用气相色谱法对上述两个样品溶液进行分析,为加入值,结果显示白菜中两种农药的残留量加入值分别为乐果浓度为0.182×10-4mol/L,敌百虫浓度为0.158×10-4mol/L。将用检测标准曲线得出的结果同国标方法相对照,乐果的检测结果回收率为真实值的 88.9%~92.3%,标准偏差为3.05%;敌百虫的检测结果回收率为真实值的87.9%~91.7%,标准偏差为3.24%,均在5%以下,表明用本文提出的方法分析蔬菜中的有机磷农残留与标准方法基本一致,结果满意。
2.9 生物传感电极探头的半衰期测定
生物传感探头的半衰期取决于电极探头的使用时限、酶膜的重复次数等因素。但是最重要的是酶膜中固定化小麦酯酶的活性。农药的抑制作用使酶膜中的小麦酯酶活性降低,导致传感器的灵敏度下降,检测数值不稳定,造成误差。为了恢复小麦酯酶的活性,把传感器在1%的2-吡啶醛肟甲基碘化物(2-PAM)溶液或在pH为6.5的磷酸盐缓冲溶液(PBS)中浸泡10min后相比较,结果如图8。
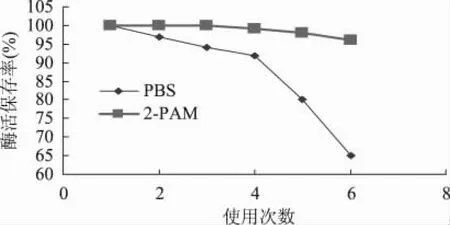
图8 使用次数对酶活保存率的影响
由图8可以看到,经过2-PAM复活处理的酶膜中,使用0~6次时,小麦酯酶的活性始终在95%以上,而用PBS处理过的酶膜3次使用过后就在95%以下,随后急剧下降。由后续实验可知,经过2-PAM处理后的酶膜一般可以重复使用10~20次,在0~13次时的酶活保存率可恢复到原来活性的95%以上,14~20次为初始酶活的90%~95%。经浸泡后的电极用缓冲溶液清洗干净,继续使用。而当传感器上的小麦酯酶膜失效,可更换新的小麦酯酶膜,传感器仍可反复使用。
3 结论
3.1 确定了每张酶溶胶凝胶传感膜上最佳反应条件为小麦酯酶的负载量2g;溶胶凝胶与小麦酯酶体积比0.4;有机磷农药检测时体系中缓冲溶液的pH为7.0、乙酸-α-萘酯浓度为 0.8mmol/L、温育时间为10min。
3.2 乐果的浓度在1×10-8~1×10-3mol/L内与小麦酯酶的抑制率呈线性关系,计算出回归方程为lgI= 13.02x+118.7,相关系数为 0.995,最低检出限为1.7×10-9mol/L。敌百虫的浓度在 1×10-8~1× 10-3mol/L内与小麦酯酶的抑制率呈线性关系,计算出回归方程为y=13.08x+112.7,相关系数为0.997,最低检出限为1.1×10-8mol/L。
3.3 对照国家标准检测方法得出的结论,采用检测方程得出的乐果的检测结果回收率为真实值的88.9%~92.3%,标准偏差为3.05%;敌百虫的检测结果回收率为真实值的87.9%~91.7%,标准偏差为3.24%。
3.4 对酶膜的重复使用次数进行了实验,得出使用20次以内其酶活保存率为初始酶活的90%左右。
[1]张先恩.生物传感器[M].北京:化学工业出版社,2006: 3-117.
[2]乔丽娜,周在德,肖丹.酶生物传感器中酶的固定化技术[J].化学应用于研究,2005,17(3):300-302.
[3]钱军民,李旭祥.固定化技术在生物传感器中的应用传感器技术中的应用[J].传感器技术,2001,20(7):6-10.
[4]何奕.快速检测有机磷农药的酶生物传感器研究[D].浙江大学硕士论文,2003:11-12.
[5]杨艳.生物传感器的发展及应用[J].茂名学院学报,2006,16(4):43.
[6]Madalina M B,Janja K,Martin B,et al.Design and application of a flow cell for carbon-film based electrochemical enzyme biosensors[J].Talanta,2007,71:1893-1900.
[7]周炯亮,施利春.生物传感器的研究现状和发展方向[J].安徽电子信息职业技术学院学报,2005,6(4):79-81.
[8]K van A.A study of housefly esterase by means of a sensitive colorimetric method[J].Journal Institute of Physiology,1962(8): 401-416.
[9]Joseph W,Robin K,Kirstin B,et al.Dual amperometricpotentiometric biosensor detection system for monitoring organophosphorus neurotoxins[J].Analytica Chimica Acta,2002,469:197-203.
[10]Priti M,Ashok M,Irina K.Biosensor for direct determination of organophosphate nerve agents.1.Potentiometric enzyme electrode[J].Biosensors&Bioelectronics,1999,14:77-85.
[11]栾崇林,马文石,汪军.植物酯酶法检测有机磷农药残留量研究[J].分析实验室,2006,25(9):103-106.
[12]刘畅.血清胆碱酷酶的分离纯化及其在农药残留快速检测中的应用[D].华中农业大学硕士学位论文,2005:57.
[13]高慧丽.检测有机磷农药电流型乙酰胆碱酯酶生物传感器的研究[D].北京工业大学硕士学位论文,2005:58-60.
[14]孟玲,翁霞,刘长江.用于有机磷农药残留检测的小麦酯酶的最适反应条件[J].农药,2006,45(7):445-447.
[15]许学勤,徐斐,华泽钊.用于有机磷农药残留快速检测的固定化小麦酯酶研究[J].食品科学,2003,24(5):122-126.
[16]Vioque-Fernández A,Alves de Almeida E,López-Barea J. Esterases aspesticidebiomarkersin crayfish(Procambarus clarkii,Crustacea):Tissue distribution,sensitivitytomodel compounds and recovery from inactivationComparative[J]. Biochemistry and Physiology Part C,2007,145:404-412.
[17]John G O,Alan L D,Charles C,et al.Comparing the organophosphorus and carbamate insecticide resistance mutations in cholin-and carboxyl-esterases[J].Chemico-Biological Interactions,2005(157-158):269-275.
Preparation and application of immobilized wheat esterase biosensors
WANG Hui-you1,WANG Tao1,WANG Zhen-yu1,2,YU Wei1
(1.Department of Food Science,College of Forest,Northeast Forest University,Harbin 150040,China; 2.College of Food,Harbin Institute of Techndogy,Harbin 150086,China)
The immobilized wheat esterase membrane was fixed at the glass electrode precise acidimeter probe to form a biosensor and detected the two kinds of usual organophosphorus pesticides of dimethoate and metrifonate. Result:in the range of dimethoate concentration 1×10-8~1×10-3mol/L,it had linear relation with wheat esterase’s inhibition rate.Regression equation was y=13.02x+118.7,correlation coefficient was 0.995,limit detectability(LDC) was 1.7×10-9mol/L.In the range of metrifonate concentration 1×10-8~1×10-3mol/L,it had linear relation with wheat esterase’s inhibition rate.Regression equation was y=13.08x+112.7,correlation coefficient was 0.997,limit detectability(LDC)was 1.1×10-8mol/L.In the actual sample detection,compared to the national standard method of control,we concluded that the recovery rate of using dimethoate detection equation was 87.9%~92.3%of the true value,and the repeated using number of bio-sensitive membrane resulted that in 20 times using the preserved activity was 90%of initial’s.The biosensors had the capacity of rapidity organophosphorus pesticide detection.
immobilization;wheat esterase;biosensing electrode probe;organophosphorus pesticide
TS210.1
A
1002-0306(2011)03-0385-05
有机磷类农药,在我国农业生产上被大量使用。但其残留物毒性较大,人长期摄入有机磷农药可导致肝功能下降、血糖升高、白细胞吞噬功能减退等病理变化,并有致畸、致癌、致突变的作用,严重者可导致中枢神经系统功能异常,因此有机磷农药残留已成为中国的主要食品安全性问题[1-3]。解决此问题主要依靠建立一种准确快速、简单廉价的农药残留检测技术,这已经成为食品安全和环境保护的当务之急。传统的有机磷农药残留检测方法主要是色谱法,该法虽然测定精确、灵敏度高,但样品前处理复杂,仪器庞大,设备昂贵,手续复杂,需专业人员进行操作,因此不适于经常性的现场检测。而二十世纪六十年代以后迅速发展起来的生物传感检测技术以其快速、简便、适合现场操作等特性满足了对食品检验的要求[4-5]。由于大部分的生物传感器都是由生物敏感膜和庞大的数据信号转换装置相连接所组成的,如荧光监测仪,光纤探测器等,所以此类生物传感器并不适合有机磷农药真正的现场检测[6-7]。而采用精密型酸度计作为信号的转换仪器,则可以很好地缩小检测设备的体积,更加方便地进行现场的实验检测。本文对固定化小麦酯酶生物传感器电极探头的制备进行了研究,将生物敏感膜与精密型酸度计的玻璃探头进行组装,检测时通过有机磷农药对小麦酯酶的抑制程度与有机磷农药浓度间的关系反映有机磷农药的含量。同时,对检测时的几个重要参数进行实验,找出了最佳的反应条件,为其在实际应用中提供一定的数据支持和参考依据。
2010-03-12
王会友(1982-),男,硕士研究生,研究方向:生物技术及功能性食品开发。
东北林业大学研究生科技创新资助项目。
