响应面法优化微量热法检测用菌体培养基的实验研究
2011-11-06农卫良秦旭锐石服鑫
徐 斐,农卫良,管 骁,秦旭锐,石服鑫
(上海理工大学医疗器械与食品学院,上海200093)
响应面法优化微量热法检测用菌体培养基的实验研究
徐 斐,农卫良,管 骁,秦旭锐,石服鑫
(上海理工大学医疗器械与食品学院,上海200093)
利用微量热法对酱牛肉中的细菌进行快速定量检测,需要对检测用菌体培养基进行优化从而实现其快速增殖,以期缩短检测时间,同时放大细菌生长热信号。本文采用Plackett-Burman实验设计确定了培养基配方的主要因素后,再用最陡爬坡实验及Box-Behnken实验设计进一步确定了各因素的最优水平。实验结果表明,葡萄糖、pH、胰蛋白胨三个因素是影响酱牛肉中优势细菌生长的主要因素;优化后的最佳培养基配方为:葡萄糖1.42g/L、胰蛋白胨8.45g/L、硫酸镁0.2g/L、氯化钠5g/L、酵母浸膏4.5g/L、pH 7.12。用此培养基培养酱牛肉中的细菌,可实现其快速增殖,并显著缩短生长延滞期。
微量热法,响应面分析,培养基优化,延滞期
1 材料与方法
1.1 材料与仪器
受试菌种 均分离于市售酱牛肉中,由本实验室鉴定、计数。
UV-2800型可见分光光度计 尤尼柯(上海)仪器有限公司;超净工作台、全自动灭菌锅、摇床等上海博讯有限公司。
1.2 实验方法
1.2.1 培养方法 将活化好的各菌种按实际样品中的平均比例混匀后,取5mL菌悬液接种于装有150mL培养基的250mL三角瓶中,置于摇床(100r/min)中37℃培养。
1.2.2 培养基配方优化实验设计
1.2.2.1 显著影响因子的确定 根据菌种的大致营养需求,以7种对菌体生长可能造成较大影响的培养基成分以及pH作为实验设计中的8个影响因素,以培养5h后的细菌生物密度(即发酵液在650nm处的吸光度,反映菌体生长情况)为响应值进行Plackett-Burman实验设计,实验次数共32次,因子选择及实验设计见表1。

表1 Plackett-Burman设计实验中各因素的水平
1.2.2.2 最陡爬坡实验 由于响应面拟合方程只在考察的紧接领域里才充分近似真实情形,在其他区域拟合方程与被近似的函数方程毫无意义。所以,要先逼近各因素最佳值区域后才能建立有效的响应面拟合方程。可以通过做单因素实验或由菌种的特性和发酵工艺来确定因素水平的范围。最陡爬坡法以实验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,能快速地逼近最佳值区域[6]。
1.2.2.3 响应面分析实验 根据最陡爬坡实验确定出的最佳值区域,采用旋转中心点正交实验法,配制不同的培养基。然后将细菌接种后37℃培养5h,测量其生物密度值,并进行数据分析。
本实验设计、数据分析和模型建立均由SAS9.0辅助完成。
1.2.3 培养对比实验 将按比例混合好的菌悬液分别接种到普通营养肉汤培养基与优化培养基中进行水浴摇床培养(37℃,摇床转速100r/min)不同时间(分别为1.5、2.5、3.5、4.5、5.5、6.5h)后,分别测定两种培养液OD650值进行比较。
2 结果与分析
2.1 筛选显著影响因子
本部分实验采用八因子两水平实验设计。选择7种培养基成分作为优化对象改变浓度,其它因素保持一致。测量培养液在5h后的650nm处吸光度,结果如表2所示。

表2 Plackett-Burman设计及实验结果

表3 各因素的主要效应分析表
由表3可以看出,8个因素中对响应值影响显著性依次为胰蛋白胨>pH>葡萄糖>氯化钠>硫酸镁>酵母浸膏>牛肉浸膏>磷酸氢二钾。其中胰蛋白胨、pH以及葡萄糖对细菌生长的影响最为显著,其Pr>F均小于0.05。因此响应面分析过程中确定胰蛋白胨、pH和葡萄糖三个因素为主要影响因素。其中,胰蛋白胨的浓度和pH对OD值的影响是负效应,葡萄糖的浓度对OD值的影响是正效应。且由于磷酸氢二钾及牛肉浸膏对细菌生长的影响极小,因此在后面所配的培养基中不再添加。而硫酸镁、氯化钠、酵母浸膏则选择较优水平,分别添加0.2、5、4.5g/L。
2.2 主要因素水平的确定(最陡爬坡实验)
由Plackett-Burman实验结果可知,在优势菌液体培养过程中,葡萄糖、胰蛋白胨、pH这3个因素对细菌生长有重要的影响,根据这3个因素效应大小的比例设定它们的变化方向及步长进行实验,设计及结果如表4所示。

表4 最陡爬坡实验设计及结果
对各因素进行显著性分析后结果如表3所示。
由表4可以看出,随着实验号的增加响应值先升高后降低。其中2号的响应值最大,而1号的响应值为0.748,大于3号实验的0.699。由此可以推断出最佳培养基应介于1号和2号之间。
2.3 响应面分析法优化培养基结果
根据Plackett-Burman实验以及最陡爬坡实验的实验结果确定的实验因素及水平确定3个因素的水平值,其实际值如表5所示。

表5 响应面分析实验因素水平表
根据旋转中心点正交实验设计原理,进行3因素3水平的响应面分析实验设计23个实验点,其中8个实验点为析因点,零点重复9次[9-10]。具体设计如表6所示。
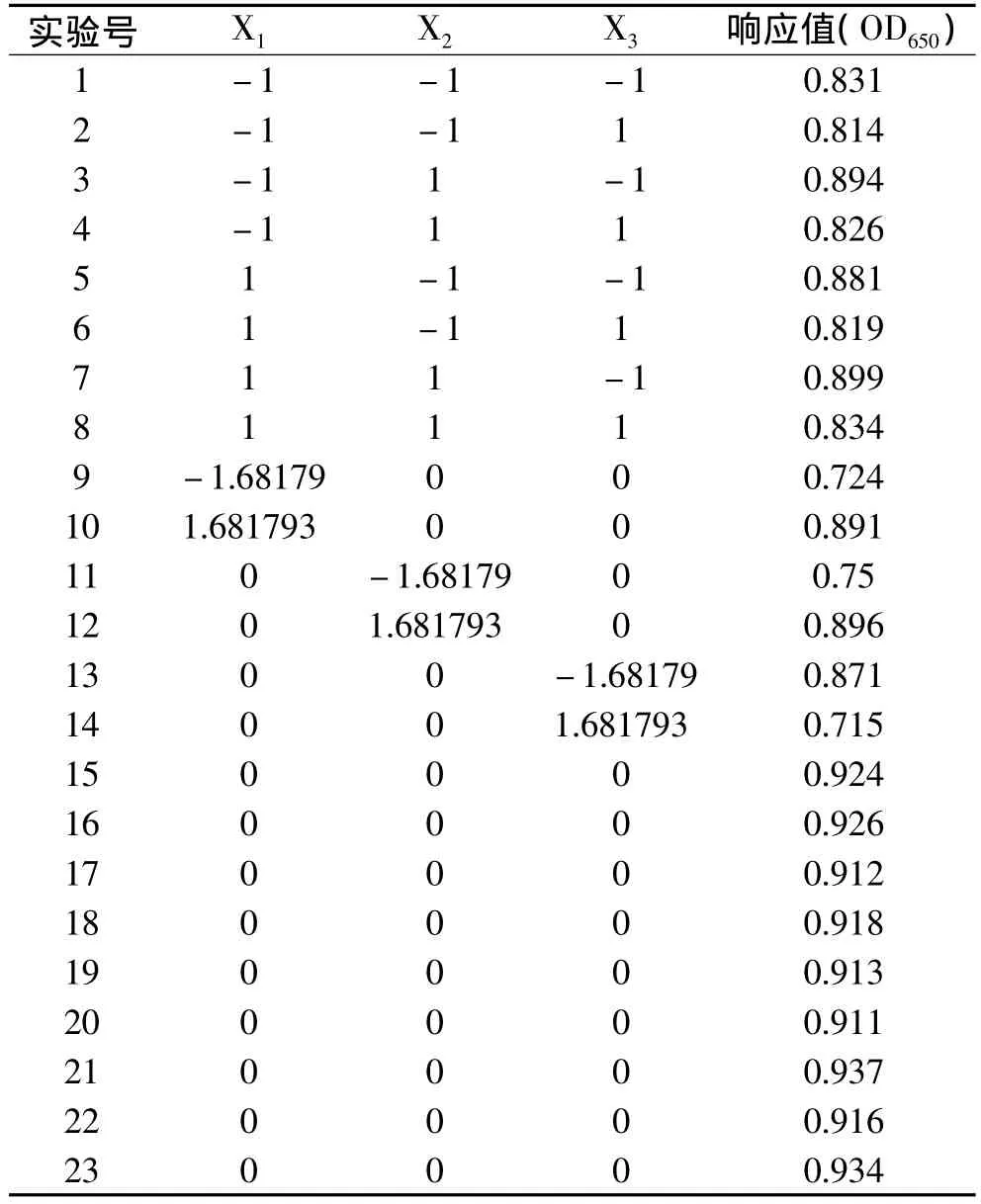
表6 响应面分析实验设计与结果
以细菌接种培养5h后在650nm处的吸光度为响应值,采用SAS9.0软件对表6的实验结果进行方程拟合回归分析,结果如方程式(1)和表7、表8所示。


表7 回归方程系数显著性检验

表8 响应面分析实验方差分析表
由表7的结果可知,方程式(1)的R2值为0.81,可见方程对实验结果的拟合关系良好[11-12]。同时,由表8可看出,方程的一次项、二次项的影响十分显著,交叉项作用反而不是很明显。根据上述回归方程作出响应面立体分析图(见图1~图3),可更直观地反映出各因素对响应值的影响情况。

图1 葡萄糖与胰蛋白胨对菌体生长的影响

图2 胰蛋白胨与pH对菌体生长的影响
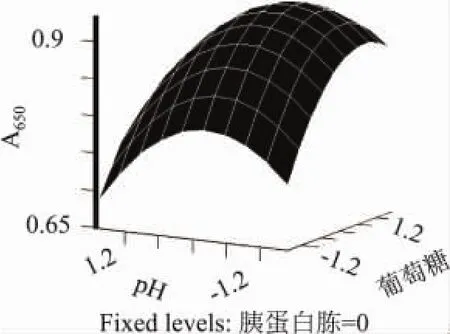
图3 葡萄糖与pH对菌体生长的影响
图1~图3直观地反映了各因素对响应值的影响,葡萄糖、胰蛋白胨、pH对响应值的影响都极为显著,曲面较陡。从图1可以看出,当葡萄糖质量浓度不变时,随着胰蛋白胨的质量浓度增大,响应值先是逐渐增大,达到最大值之后,逐渐减小;胰蛋白胨质量浓度不变时,随着葡萄糖质量浓度的增大,响应值的变化也是先增大后减小。同样从图2、图3可见,随着pH、葡萄糖和胰蛋白胨质量浓度的变化,响应值的变化趋势也是先增后减,呈典型的二次函数变化趋势。
对方程式(1)进行偏导求零,得出该模型响应值存在极值点,对应各因素的取值分别为:X1为0.42164、X2为0.55212、X3为-0.57218,对应的实际值分别为:葡萄糖1.42g/L;胰蛋白胨8.45g/L;pH7.12时,响应值Y即生物密度最大达0.943,微生物生长最好。
2.4 验证实验
根据以上的培养基优化条件进行验证实验,共进行5次摇床培养实验,测得响应值分别为0.940、0.952、0.938、0.959、0.949,平均值为0.947,与回归方程所得的估测值(0.943)差异不显著,说明采用RSA法优化得到的实验参数真实可靠,具有实用价值。
2.5 与普通营养肉汤的对比实验
图4列出了混合优势菌在优化培养基及普通营养肉汤培养基中的生长情况。从图中可以看出,混菌在优化培养基中的生长速度要远大于普通培养基。培养270min后,普通培养基的OD650为0.561,而优化培养基的OD650值达1.061,是普通营养肉汤培养基的1.9倍。而且优化培养基OD值曲线的斜率也明显大于普通培养基。由此表明,细菌在优化培养基中的生长延滞期更短,且生长速度更快、代时短,更有利于短时间内混合菌的大量繁殖,有利于后续的细菌微量热实验。

图4 菌种在两种培养基中的生长状况
3 结论
本文对酱牛肉中的污染菌进行了培养基优化研究,以促进其快速增殖,从而达到放大细菌生长热效应以及缩短放热时间的目的,以利于微量热法对其进行定量研究。通过Plackett-Burman实验设计确定了葡萄糖、pH、胰蛋白胨三因素是影响酱牛肉中优势菌生长的主要因素;经最陡爬坡实验及中心组合实验结合响应面分析法优化出培养基配方为:葡萄糖含量为1.42g/L、胰蛋白胨含量为8.45g/L、pH为7.12、硫酸镁含量为0.2g/L、氯化钠含量为5g/L、酵母浸膏含量为4.5g/L。用此优化培养基培养酱牛肉中的细菌,可促进其快速生长,并缩短其生长延滞期,有利于下一步的细菌微量热的定量实验研究。
[1]章海鹏,管骁,徐斐,等.利用量热法快速检测食品中细菌总数的方法研究[J].食品工业,2009(1):70-73.
[2]王晶,王林,黄晓蓉.食品安全快速检测技术[M].北京:化学工业出版社,2002.
[3]Higuera-Guisset J,Rodríguez-Viejo J,ChacÓn M,et al. Calorimetry ofmicrobialgrowth using a thermopile based microreactor[J].Thermochimica Acta,2005,427:187-191.
[4]Marison I,Liu J-S,Ampuero S,et al.Biological reaction calorimetry:development of high sensitivity bio-calorimeters[J]. Thermochim Acta,1998,309:17-173.
[5]储炬.现代工业发酵调控学[M].北京:化学工业出版社,2002,251.
[6]Cochran W G,Cox G M.Some methods for the study of response surfaces.In Experimental designs[M].New York: Wiley,1992:335-375.
[7]郝学财,余晓斌,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006,27(1):38-41.
[8]江汉湖.食品微生物学[M].北京:中国农业出版社,2005.
[9]张健,高年发.利用响应面法优化丙酮酸发酵培养基[J].食品与发酵工业,2006,32(8):52-55.
[10]XiaoGuan,Huiyuan Yao.Optimization ofViscozyme L-assisted extraction of oat bran protein using response surface methodology[J].Food Chemistry,2008,106:345-351.
[11]Haber A,Runyon R.General statistics(3rd ed)[M]. Henika:Addison-Wesley,Reading,MA,1977.
[12]Kong Q,He G Q,Chen Q H,et al.Optimization of Medium Composition for Cultivating Clostridium butyricum with Response Surface Methodology[J].Journal of Food Science,2004,69(7): 163-168.
Optimization of culture medium for rapid detection of bacterial in food using microcalorimetric method by response surface analysis
XU Fei,NONG Wei-liang,GUAN Xiao,QIN Xu-rui,SHI Fu-xin
(School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China)
During the rapid detection of bacterial in beef using the microcalorimetry method,the optimization of cultural medium is important because it is useful for the reduction of detection time and the enlargement of bacterial growth heat.In this paper,the Plackett-Burman design was used to evaluate the most important factors which affected the bacterial growth firstly.Furthermore,the steepest ascent and Box-Behnken design were used to approach the optimal level of the medium composition.The results showed that the concentration of glucose,tryptone and pH played most important roles in influencing the growth of the dominant bacteria in beef.The optimal cultural medium was determined as follows:glucose 1.42g/L,tryptone 8.45g/L,MgSO40.2g/L,NaCl 5g/L,yeast extract 4.5g/L,pH 7.12.It was possible that the bacterial in beef grew rapidly under the condition of the optimal cultural medium,and the lag phase of the bacterial was shortened greatly.
microcalorimetry;response surface analysis;optimization of cultural medium;lag phase
TS201.1
A
1002-0306(2011)03-0188-05
在影响我国食品安全的诸因素中,微生物污染问题高居首位,开发快捷准确的微生物检测方法尤有必要。国内外近年来开发了一些微生物快速定量检测技术[1-2],包括:酶联免疫吸附分析技术(ELISA)、DNA探针技术、聚合酶链式反应(PCR)技术、ATP生物发光技术、直接表面荧光滤膜计数技术(DEFT)、比浊法、阻抗法等。然而这些方法或多或少都存在自身不可克服的局限性,如仪器复杂昂贵、检测成本高、特异性过强、前处理复杂,造成应用范围有较大局限性。随着微量热技术的发展,利用该技术进行微生物的定量研究已成为可能[3-4]。微量热法主要优势在于检测速度快、操作简单、适用范围广,其原理为利用微生物生长产生的热效应。实际上微生物生长热过程缓慢且热效应小,实现其准确测定对设备要求很高。因此,若能缩短微生物生长放热过程,且放大热信号,则可对速测产生重要意义。微生物自身具有一定的营养需求和生长特性,完全可通过改变其生长环境的办法来改善生长状况,因此可对量热用培养基进行优化,使微生物能在较短时间内放出更多的热,以便于快速检测[2]。微生物的生长代谢受制于培养基的组分如碳源、氮源、生长因子、无机盐等多种因子的影响。培养基的成分对微生物发酵液含菌量有很大的影响[5]。在多因子起作用的生化过程中,如何快速找出主要因子并进行优化并不是一件易事。响应面方法(Response Surface Methodology,RSM)是利用合理的实验设计得到实验数据,并采用回归方程来拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题的一种统计方法[6-7]。本研究根据微生物的营养需要特性[8],采用响应面分析法对酱牛肉中优势菌的量热培养基进行优化研究,以期获得显著缩短细菌生长延滞期的培养基配方,为量热法快速检测微生物研究提供新的思路和方法。
2010-01-12
徐斐(1972-),女,博士,教授,主要从事食品安全快速检测方面的研究。
上海市教委科研创新项目(08ZZ77);上海市研究生创新基金项目(JWCXSL0902);上海高校选拨培养优秀青年教师科研专项基金(slg-07047)。
