大黄中α-淀粉酶抑制因子的研究
2011-11-06宋彦显闵玉涛马庆一
宋彦显,闵玉涛,刘 江,马庆一,*
(1.中州大学,河南郑州450044; 2.郑州轻工业学院,河南郑州450002)
大黄中α-淀粉酶抑制因子的研究
宋彦显1,闵玉涛1,刘 江2,马庆一2,*
(1.中州大学,河南郑州450044; 2.郑州轻工业学院,河南郑州450002)
采用甲醇粗提、石油醚、二氯甲烷、乙醚、乙酸乙酯、乙醇索氏极性梯度提取、pH梯度萃取以及硅胶制备板纯化并结合各组分α-淀粉酶抑制活性跟踪方法对大黄中α-淀粉酶抑制因子的分布进行了系统研究。结果表明,乙酸乙酯和乙醇组分对α-淀粉酶的抑制率分别为35.0%和26.9%;前者的pH梯度萃取组分为NaHCO3、Na2CO3、NaOH、剩余乙酸乙酯,对α-淀粉酶的抑制率依次为:66.5%、46.7%、58.1%和49.0%。其中NaHCO3组分用硅胶制备板纯化并水解,经薄层分析认定其苷元是大黄酸。纯化后对α-淀粉酶的抑制率不升反降的事实暗示了粗样中杂质的协同作用。
大黄,α-淀粉酶,抑制因子,糖尿病
1 材料与方法
1.1 材料与设备
大黄 郑州中药城;猪胰α-淀粉酶 自制;试剂 均为国产分析纯。
80-1离心机,721分光光度计,HH-S11-2电热恒温水浴锅,RE52CS旋转蒸发器,IOTA-1电热鼓风干燥箱,新飞BCD-245D冰箱,GL21高速冷冻离心机。
1.2 实验方法
1.2.1 相关试剂的配制和材料制备
1.2.1.1 明胶试剂 10g氯化钠,1g明胶,加水定容至100mL。

表1 测定加样表
1.2.1.2 三氯化铁试剂 5%三氯化铁的水溶液或醇溶液。
1.2.1.3 溴甲酚绿试剂 0.1%溴甲酚绿乙醇液。
1.2.1.4 显色剂的配制 精确称取1.66g邻苯二甲酸、0.93g苯胺,将其溶于100mL水饱和的正丁醇中。
1.2.1.5 展开剂 正丁醇∶冰醋酸∶水(3∶1∶1)。
1.2.1.6 0.7%的CMC溶液的配制 称取羧甲基纤维素0.7g,量取蒸馏水100mL,先加入5mL蒸馏水润湿泡开的羧甲基纤维素,再缓缓加水,边加水边用牛角勺搅拌以防止溶液中出现大的悬浮颗粒,若溶液中还存在颗粒,应适当加热溶化,无CMC颗粒时,加入剩余的蒸馏水混匀备用。
1.2.1.7 DNS试剂的配制 酒石酸钾钠18.2g,溶于50mL蒸馏水中,加热,于热溶液中依次加入3,5-二硝基水杨酸0.03g、NaOH 2.1g、苯酚0.5g,搅拌至溶,冷却后用蒸馏水定容至100mL,贮于棕色瓶中,室温保存。
1.2.1.8 薄层分析板的制备和活化 称取7g薄层层析用硅胶于研钵中,量取22mL配制好的CMC溶液加入其中,慢慢碾磨使两者充分混合,并防止混入气泡,将8块小玻片(2.5cm×7.5cm)并排放置,将混合均匀的硅胶倾于小玻璃片上,用玻璃棒将其反复推铺均匀(玻璃棒比小玻璃片高出2mm左右),拿起小玻璃片在手上颠至均匀后,放平,令其自然阴干。将晾干的板置于烘箱中,缓慢升温至115℃,活化1h后取出,放于玻璃干燥器皿中自然冷却即可。
1.2.2 大黄中α-淀粉酶抑制因子的提取 称取烘干粉碎至40目的大黄粉200g,甲醇回流提取(固液比1∶5)三次,抽滤后合并提取液,浓缩至浸膏状,加入硅藻土,搅拌均匀后用滤纸包裹,依次用石油醚、乙醚、乙酸乙酯、乙醇索氏提取48h。
1.2.3 大黄中α-淀粉酶抑制因子的定性实验[2]
1.2.3.1 碱液实验、醋酸镁实验和硼酸实验 碱液实验:加入10%NaOH,若呈现红色,加H2O2,红色不褪,加酸,红色褪去为阳性;醋酸镁实验:加入1% MgAc2出现红色为阳性;硼酸实验:将乙醇提取液点在滤纸片上,喷洒1%硼酸水溶液,如呈现黄橙、红色或荧光,表明含蒽醌及甙类。
1.2.3.2 α-萘酚实验(Molisch紫环反应) 取检品的水溶液1mL,加入5%萘酚乙醇溶液数滴振摇后,沿管壁滴入5~6滴浓硫酸,使之成两液层,待2~3min后,两层液面出现紫红色环者为阳性(糖、多糖或甙类)。
1.2.3.3 三氯化铁实验与明胶实验 三氯化铁实验:取检品的水溶液1mL,加三氯化铁试液1~2滴,呈现绿色、污绿色、蓝黑色或暗紫色者为阳性(可水解鞣质显蓝—蓝黑色,缩合鞣质显绿色—污绿色)。明胶实验:取检品的水溶液1mL,加氯化钠明胶溶液2~3滴,生成白色沉淀物则记作阳性。
1.2.3.4 盐酸-镁粉实验 取检品的乙醇溶液1mL,加放少量镁粉,然后加浓盐酸4~5滴,置沸水浴中加热2~3min,呈现红色者为阳性(游离黄酮类或黄酮甙)。
1.2.3.5 溴甲酚绿实验 在干燥的滤纸上滴一滴待检液体,待干燥后喷洒溴甲酚绿指示剂,在蓝色的背景上显黄色记为阳性(有机酸)。如果展开剂中含有乙酸,在喷洒显色剂之前应于120℃烘烤除去。
1.2.4 梯度提取物对α-淀粉酶抑制活性跟踪 用二甲基亚砜溶解甲醇粗提物、石油醚提取物,用水溶解剩余各梯度提取物,使其浓度为1mg/mL,共得到6个样品溶液。临用前取α-淀粉酶(146U/mg)稀释2500倍。参照程秀丽[3]的方法并加以改进,实验组分为空白管、对照管、样品管和颜色干扰管,各管加样如表1所示。
提取物对α-淀粉酶抑制率的计算:
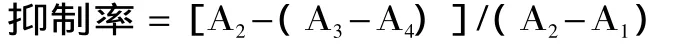
其中:A1-空白;A2-对照;A3-加抑制剂;A4-颜色对照(甲醇粗提和石油醚提取物的抑制率计算中,A2采用二甲基亚砜对照组的值,其他采用对照组吸光度值)。
1.2.5 排除提取液活性测定中显色干扰的方法
1.2.5.1 薄层层析法 酶解淀粉液点在薄层板上,因蒽醌极性较弱,会走到硅胶板的最顶端,将蒽醌与生成的糖分开,挖掉酶解淀粉生成的糖最后停留的位置处的硅胶,经过碾磨,用蒸馏水浸提1h,再加DNS显色定容,540nm下测吸光度值即可去除显色干扰。
1.2.5.2 活性炭脱色法 将少量的活性炭置于1mL经抑制剂作用但还未显色的酶解淀粉体系(酶已灭活)混合5min,用热的95%乙醇洗脱活性炭上吸附的糖,8000r/min离心5min后取上清液,定容后DNS显色,540nm下测吸光度值。
1.2.5.3 有机溶剂萃取法 针对大黄甲醇粗提物或乙醚组分(用二甲基亚砜溶解)。取两只试管,编号1、2。在1号管中加入0.6mL的酶反应体系液(酶已灭活),在2号管中加入0.6mL的总反应体系液,各滴加1滴稀盐酸,使体系呈弱酸性,再加入2mL的无水乙醚(或乙酸乙酯),充分振荡,静置,大黄粗提液中对DNS显色有干扰作用的弱酸性成分进入上层酯层,弃上酯层。再按上述萃取操作两次,直至酯层几乎不显颜色,加0.2mL 5%NaOH后加DNS显色。

表4 各提取组分的吸光度值
1.2.5.4 破坏蒽醌法(H2O2氧化法) 将20μL H2O2加入0.2mL反应体系中(于坩埚内),充分振荡反应1min用氧化法破坏蒽醌,然后将此坩埚在沸水浴中蒸干。调零,空白对照亦如此操作,以减少误差。用蒸馏水少量多次地将坩埚中的干物质转移到比色管中,加0.2mL DNS,显色,定容至10mL,在540nm下测吸光度值。
1.2.6 乙酸乙酯组分的分离
1.2.6.1 乙酸乙酯组分的pH梯度萃取 将梯度提取得到的乙酸乙酯溶液浓缩、定容,以等体积 5% NaHCO3溶液萃取两次,酯层待用,合并水相,用盐酸酸化至pH为3.0,水相用NaCl饱和,用乙酸乙酯反萃取,弃水层。上层的有机相记作NaHCO3组分。NaHCO3溶液萃取过的酯层再以等体积5%Na2CO3溶液萃取两次,酯层待用,合并水相,盐酸酸化,用乙酸乙酯反萃取,弃去水层。上层所得记作Na2CO3组分。Na2CO3溶液萃取过的酯层再以等体积 1% NaOH分两次振荡萃取,合并水层萃取液,酯层记作乙酸乙酯组分。水层萃取液加盐酸至酸性,用乙酸乙酯反萃,弃去水层。上层所得记作NaOH组分。分别做制备层析,展开剂为乙酸乙酯∶甲醇∶水(100∶25∶15)。
1.2.6.2 乙酸乙酯NaHCO3组分的纯化及蒽醌苷的双相酸水解 用乙酸乙酯∶甲醇∶水(100∶25∶15)为展开剂对NaHCO3组分做制备层析,进一步纯化。纯化后得到的组分经双相水解后,取少量该组分浓缩油状物,置于50mL圆底烧瓶,加入10mL二氯甲烷和10mL 20%硫酸,在40℃恒温水浴中搅拌反应30min。用分液漏斗分出二氯甲烷组分,加一小勺无水硫酸钠干燥20min,滤去硫酸钠固体,取滤液在薄层硅胶分析板上点样。以石油醚∶乙酸乙酯(7∶3)为展开剂,观察颜色斑点,并与乙醚组分的结果对照。
2 结果与讨论
2.1 梯度提取
2.1.1 梯度提取得率 见表2。

表2 大黄各梯度组分的得率
2.1.2 定性实验 由表3可知,石油醚提取液中主要含有机酸,乙醚提取液主要含有蒽醌苷元,而乙酸乙酯、乙醇提取液中主要含有蒽醌苷。

表3 大黄各梯度成分定性实验结果
2.1.3 提取液对α-淀粉酶的抑制效果 按1.2.4的方法测定,结果如表4。
因大黄中的主要成分蒽醌与显色剂DNS中的碱反应显红色或紫红色,严重干扰还原糖与DNS的显色。故按1.2.4方法不可行,因此要着力解决蒽醌干扰显色的问题。
2.2 排除显色干扰方法的选择
薄层层析法因硅胶板规格不一,导致淀粉水解产物的最终位置有差异,在还未显色之前“盲刮”,需碾磨、浸提和过滤等反复转移,使得结果不能成理想的酶反应线性关系。活性炭脱色法虽能脱除蒽醌的颜色,但吸附大量的糖,不易洗干净,造成的误差极大。有机溶剂萃取法只能除去提取液中一部分颜色干扰。H2O2破坏蒽醌法易产生H2O2残留,会氧化3,5-二硝基水杨酸,影响显色。实验中采用了三种方法除去H2O2:沸水浴加热法、真空浓缩法和沸水浴加热坩埚中蒸干法。沸水浴加热法难以除去H2O2,真空浓缩法操作繁琐,沸水浴加热坩埚中蒸干法效果较好,故均采用此法。
2.3 乙醇提取液对α-淀粉酶的抑制作用的酶反应动力学实验
从图1可以看出,以15min时的吸光度计算抑制率,乙醇组分的抑制率26.9%。

图1 乙醇组分对淀粉酶的抑制活性
2.4 乙酸乙酯组分的进一步分离及所得各组分对α-淀粉酶的抑制效果
由图2可知,前15min内吸光度与时间成线性关系,以15min时的吸光度计算各成分的抑制率,结果显示各成分的抑制率分别为:原乙酸乙酯组分35.0%,NaHCO3组分66.5%,Na2CO3组分 46.7%,NaOH组分58.1%,剩余组分49.0%,其中NaHCO3组分抑制率明显高于其它组分。
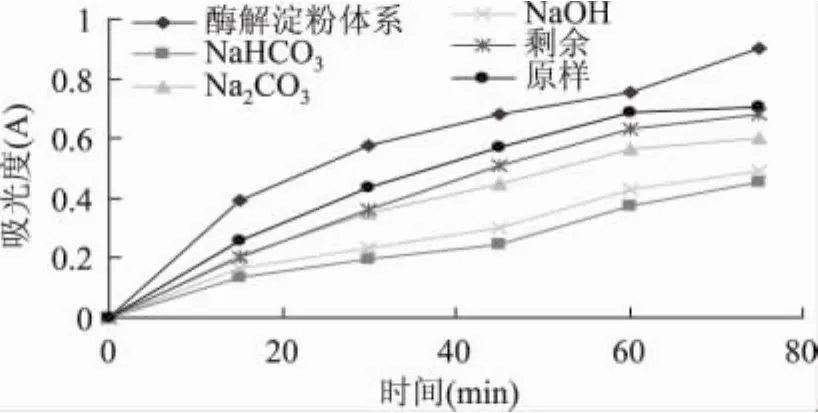
图2 乙酸乙酯pH梯度萃取各组分对α-淀粉酶的抑制活性
2.5 乙酸乙酯NaHCO3萃取组分的纯化
由2.4可知,NaHCO3组分抑制率最高,因此采用用乙酸乙酯∶甲醇∶水(100∶25∶15)为展开剂进行制备层析,对其进一步纯化。经纯化得到1个主要组分记为1#,考察1#对 α-淀粉酶的抑制效果,结果如图3。

图3 1#对淀粉酶的抑制活性
以30min的吸光度计算抑制率,结果其抑制率为22.2%。
将1#双相水解(20%硫酸酸化和二氯甲烷1∶1),得到苷元,将其与乙醚组分同板进行薄层层析(石油醚∶乙酸乙酯,7∶3),并根据文献报道的Rf值,可知得到的苷元是大黄酸。因此,可以确定大黄酸为苷元的蒽醌苷是α-淀粉酶的抑制因子。
3 结论
3.1 大黄经甲醇粗提,石油醚,二氯甲烷,乙醚,乙酸乙酯,乙醇索氏梯度提取得到五个组分。化学和生物活性跟踪实验结果显示,石油醚提取液中主要含有机酸,乙醚提取液主要含有蒽醌苷元,而乙酸乙酯、乙醇提取液中主要含有蒽醌苷。
3.2 探讨了四种解决蒽醌色素干扰DNS显色的途径:a.薄层层析分离;b.活性炭脱色;c.有机溶剂萃取; d.H2O2氧化。结果发现,H2O2氧化法(沸水浴坩埚蒸干清除过量H2O2)去除蒽醌干扰效果较好。
3.3 以H2O2氧化法除蒽醌色素干扰DNS显色的方法考察乙酸乙酯和乙醇组分对α-淀粉酶抑制作用,结果均表现出一定的抑制作用,其抑制率分别为35.0%和26.9%。
3.4 乙酸乙酯组分经pH梯度萃取进一步分离、纯化,检测发现,四个组分NaHCO3、Na2CO3、NaOH和剩余乙酸乙酯均对 α-淀粉酶有抑制活性,其中以NaHCO3组分活性最高,它们的抑制率依次为: 66.5%、46.7%、58.1% 和 49.0%。对乙酸乙酯NaHCO3组分用硅胶制备板法纯化,得到1#,其对α-淀粉酶的抑制率为22.2%。NaHCO3组分纯化后对α-淀粉酶的抑制率反而降低,暗示了粗样中杂质的协同作用。用水解法经薄层分析得知,1#的苷元是大黄酸。
[1]高小平,张蔚瑜,邹文俊,等.中药提取物中α-葡萄糖苷酶抑制剂的筛选[J].天然产物研究与开发,2003,15(6): 536-538.
[2]北京医学院.中草药成分化学[M].北京:人民卫生出版社,1980:19.
[3]程秀丽.α-淀粉酶抑制剂的活性测定[J].药剂探讨,2004,3(4):71-72.
Study on inhibitors of α-amylase in rhubarb
SONG Yan-xian1,MIN Yu-tao1,LIU Jiang2,MA Qing-yi2,*
(1.Zhongzhou University,Zhengzhou 450044,China; 2.Zhengzhou University of Light Industry,Zhengzhou 450002,China)
α-amylase inhibitory factors in rhubarb were studied systematically by the method of a combination of extraction with methanol,Soxhlet&pH gradient extraction,purification by using preparative silica gel plates,and α -amylase inhibitory activity monitoring of the various components.The results showed that ethyl acetate and ethanol components of the α-amylase inhibition rates were 35.0%and 26.9%,respectively.α-amylase inhibitory rates of the pH gradient components of ethyl acetate,NaHCO3,Na2CO3,NaOH,and the remaining ethyl acetate were:66.5%,46.7%,58.1%and 49.0%respectively.The NaHCO3fraction was purified by using preparative silica gel plates,then hydrolyzed and analyzed with thin layer silica gel.The result indicated that its aglycone was rhein. The fact of a reducing inhibitory rate after purification implied that impurities in crude samples may have synergetic effect with the major ingredient.
rhubarb;α-amylase;inhibitory factor;diabetes
TS201.2+5
A
1002-0306(2011)03-0184-04
糖尿病是一种由遗传和环境因素相互作用而引起的,以高血糖为主要标志的临床综合症。近年来其发病率呈逐年上升趋势。根据糖尿病对胰岛素的依赖与否,可分为Ⅰ型(胰岛素依赖型)和Ⅱ型(非胰岛素依赖型),患者中约90%左右为Ⅱ型,其主要症状为餐后高血糖,由其引起的并发症是糖尿病患者死亡的重要原因之一。在消化过程中,淀粉等碳水化合物首先在α-淀粉酶催化作用下转化为糊精和麦芽糖。后者进一步水解为葡萄糖,经小肠吸收进入血液,餐后2h内Ⅱ型糖尿病人的胰高血糖素比健康人高100%,使血糖积累,导致餐后高血糖。α-淀粉酶抑制剂可抑制酶的活性,从而推迟淀粉水解产生单糖的时间,达到降低血糖峰值、平抑血糖浓度的目的。因而α-淀粉酶抑制因子的研究是防治糖尿病以及肥胖症的重要研究领域之一。大黄长期在中国传统经典医学中被认为是一种有降糖作用的中草药,其水提液具有α-淀粉酶抑制活性的事实已见报道[1],但其作用机制以及活性组分的详情尚不清楚。本课题则以大黄的分离纯化并结合α-淀粉酶抑制活性跟踪为手段进一步披露了其活性的细节,从而为其继续研究与开发增加了感性材料。
2009-12-21 *通讯联系人
宋彦显(1979-),女,硕士研究生,助教,主要从事天然产物提取及功能性食品研究。
