赖氨酸-葡萄糖美拉德反应产物对铜离子的螯合作用
2011-11-06孙丽平庄永亮汪东风
孙丽平,庄永亮,汪东风
(1.昆明理工大学化学与工程学院食品工程研究中心,云南昆明650224; 2.中国海洋大学食品科学与工程学院食品科学实验室,山东青岛266003)
赖氨酸-葡萄糖美拉德反应产物对铜离子的螯合作用
孙丽平1,庄永亮1,汪东风2
(1.昆明理工大学化学与工程学院食品工程研究中心,云南昆明650224; 2.中国海洋大学食品科学与工程学院食品科学实验室,山东青岛266003)
美拉德反应产物(Maillard reaction products,MRPs)具有抗氧化活性,特别是金属螯合作用。本文制备了一定条件下的赖氨酸-葡萄糖MRPs,采用零交一阶导数分光光度法研究了MRPs对铜离子的螯合作用,分析了螯合铜离子对MRPs抗氧化活性的影响。结果表明,螯合铜离子使MRPs中具有紫外光吸收的小分子物质发生电子重排,不影响大分子黑素类物质的发色团结构;一些铜螯合位点对MRPs的还原能力和自由基清除能力有贡献。
美拉德反应,抗氧化,金属螯合,一阶导数分光光度法
1 材料与方法
1.1 材料与仪器
D-葡萄糖(D-Glucose,Glu)、L-赖氨酸盐酸盐(L-Lysine,Lys)、紫尿酸胺(tetramethylmurexide,TMM) 生化试剂;甲醇 色谱级;DPPH· 购自Sigma公司;其他 均为分析纯;整个实验用水 超纯水。
UV-2102PC紫外-可见分光光度计 上海尤尼柯;螺口密封玻璃管(16×160mm) 德国Schott; DKU-3恒温油槽 上海精宏;Delta 320 pH计 美国梅特勒-托利多。
1.2 Lys-Glu体系MRPs的制备
取0.015mol的Lys和Glu溶于50mL超纯水中,用1mol/L的碳酸钠溶液调节pH为6.68。分装溶液(5mL)至螺口玻璃管中,充氮气2min,密封,120℃油浴加热8h,六个平行,加热结束,冰水浴迅速冷却。4℃存放至测试。

表1 MRPs的抗氧化活性及不同浓度的铜离子对其抗氧化能力的影响
MRPs溶液随加热时间延长由无色、浅黄色、黄色、橘色、棕色至褐色,澄清透明。原液浓度计为反应物总浓度,即100.8mg/mL,测试时适度稀释。
1.3 MRPs紫外-可见吸收光谱分析
将MRPs原液用超纯水100倍稀释(1∶100,v/v),以未加热样品为对照,测定溶液198~552nm的吸收光谱。测定参数:1cm双面石英比色杯,1nm扫描精度,1.8nm光谱通带宽度,扫描六次。分析样品在紫外和可见区的特征吸收峰,记录最大吸收峰波长(λmax),分析美拉德产物的产生情况。
1.4 MRPs抗氧化活性分析
测定MRPs的还原能力-还原Fe3+→Fe2+的能力[2]、自由基清除能力-DPPH自由基清除活性[2]和铜离子螯合能力-紫尿酸胺双波长分光光度法[3]。
1.5 零交一阶导数分光光度法分析MRPs对铜离子的螯合作用
取20倍稀释(1∶20,v/v)的MRPs溶液0.5mL于5mL离心管,加入1.5mL Hex缓冲液和0.5mL溶于缓冲液的硫酸铜溶液(0~5mmol/L),混匀,室温下放置1h。以同样处理的未加热样品为对照,测定溶液198~552nm的紫外-可见吸收光谱并转换成一阶导数图谱。
1.6 不同浓度的铜离子对 MRPs抗氧化活性的影响
取用1.5中螯合铜离子后的MRPs溶液,按照1.4方法测定不同铜离子浓度对MRPs抗氧化能力的影响,无铜MRPs的抗氧化能力为对照。
2 结果与讨论
美拉德反应是连续的多途径并行的瀑布式化学过程,通常被分为三个阶段:初级阶段、高级阶段和终级阶段[4]。初级阶段开始于羰基和氨基缩合、环化、脱水等,产生Amadori/Henys化合物;高级阶段Amadori/Henys化合物降解,释放氨基化合物,羰基化合物降解为邻酮糖类物质;邻酮糖类物质裂解和Strecker降解反应[5]产生大量的活性小分子物质;小分子物质自身或相互间聚合,进入终级阶段,产生颜色大分子黑素类物质。
2.1 MRPs紫外-可见吸收光谱分析
紫外-可见吸收光谱分析(图1中谱带1)表明,MRPs在近紫外区220、294nm和可见光360nm处有特征吸收峰。
美拉德反应高级阶段产生的大量活性小分子物质,如酮类和醛类衍生物等[4],在近紫外区有强吸收。这些小分子物质组成极其复杂,不能一一鉴定分析[6-9]。294nm吸收峰在各种美拉德反应体系中都有报道[2,6-9]。但220nm吸收峰鲜有报道,可能是已有研究直接测定MRPs特定波长(294、360、420nm等)下的吸光值,较少进行光谱扫描。小分子有机酸产物,如甲酸、乙酸等在此波长下有特征吸收,一些酰胺类物质也有吸收;邻酮糖类物质[5]可能也对220nm吸收峰有贡献。反应高级阶段后,小分子产物聚合到大分子碳骨架上,成为大分子产物的发色团结构,在可见光区360nm产生吸收峰。
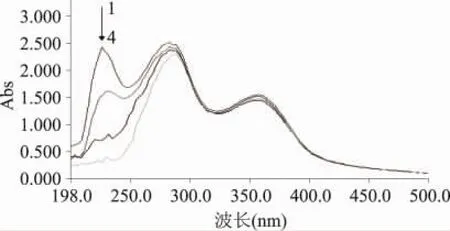
图1 不同铜离子浓度环境中MRPs紫外-可见吸收光谱组合图注:1:0mmol/L;2:1mmol/L;3:2mmol/L;4:5mmol/L。
2.2 MRPs的抗氧化活性
本实验条件下的MRPs具有一定的还原能力、自由基清除能力和金属螯合能力(表1)。美拉德反应中氨基还原酮类产物具有较强的还原能力[4];反应高级阶段产物能够提供氢原子[10]表现还原能力;从美拉德反应机制角度讲[11],中性条件下主要为电子传递机制,使体系表现还原能力。具有供氢和供电子能力的美拉德高级阶段产物能够使DPPH·发生电荷转移而消除;同时MRPs混合物中的自由基产物也能够直接与DPPH·结合为稳定物质。MRPs的金属螯合能力被认为是终级阶段大分子黑素类物质的作用[12],具体机理不清楚。氨基酸[13]和初级阶段的西夫碱类[14]是有效的金属螯合剂,所以反应体系中的未反应的氨基酸和产生的西夫碱等对铜离子应具有螯合作用,这个问题在美拉德反应研究中未见讨论。
2.3 零交一阶导数分光光度法分析MRPs对铜离子的螯合作用
本实验条件下的MRPs在不同铜离子浓度环境中的紫外-可见光吸收图谱组合如图1所示。随铜离子浓度增加,220nm最大吸收峰逐渐消失;294nm有轻微的减色效应,大分子黑素类物质的360nm特征峰几乎没有变化,表明铜离子与MRPs发生了作用,使MRPs中的一些小分子物质发生电子重排[1]。这说明具有供氢和供电子活性的小分子物质具有螯合铜离子的作用,螯合铜离子后自身发生电子重排,全部或部分损失对光吸收的能力。但铜离子螯合后不影响大分子产物的发色团结构。
MRPs是极其复杂的混合物,一阶导数图谱较零阶图谱更有效地分析铜离子螯合作用。如图2所示,与零阶图谱的三个特征峰相对应,MRPs的一阶导数图谱具有三个较规则的振幅(图2A),分别是D210~230、D270~300和 D340~390,表明本实验条件下 MRPs混合物是由三类结构不同的物质组成的,而每类物质在结构上较为类似,这可能是体系只有一种糖和氨基酸,产物组成相对比较简单。与零阶图谱变化规律类似,在不同铜离子浓度环境中,MRPs的一阶导数图谱随铜离子浓度增加而不断变化,主要是振幅D210~230消失(图2B~图2D)。零交一阶导数图谱分析表明,初始pH为中性,120℃加热8h的Glu-Lys产物中的小分子物质对金属螯合有一定的作用,大分子黑素类产物的发色团结构不易被金属离子影响。

图2 不同铜离子浓度环境中MRPs紫外-可见吸收光谱一阶导数图谱注:A:0mmol/L;B:1mmol/L;C:2mmol/L;D:5mmol/L。
2.4 不同铜离子浓度对MRPs抗氧化能力的影响
在不同铜离子浓度环境中MRPs的还原能力和DPPH·清除能力明显降低,但是下降趋势不同,还原能力一直下降至对照样品的55%左右,而DPPH·清除能力先下降至对照的66%左右,然后随铜浓度的增加上升至对照的73%左右,这个现象在美拉德反应研究中未见报道。上述零交一阶导数图谱分析表明MRPs螯合铜离子后,一些活性小分子物质发生电荷重排,可能失去供氢和供电子能力,使还原力和自由基清除能力损失,说明一些铜螯合位点对这两方面的抗氧化作用是有贡献的。
3 结论
初始pH6.68,120℃加热8h后的Lys-Glu美拉德反应产物在还原能力、自由基清除能力和金属螯合三个方面都有效果;零交一阶导数图谱分析表明,MRPs中的小分子物质对螯合铜离子有一定的作用,螯合铜离子后自身发生电子重排;大分子黑素类产物的发色团结构不受铜离子影响;螯合铜离子后MRPs还原能力和自由基清除能力下降,说明一些铜离子螯合位点对MRPs的还原能力和自由基清除能力有贡献。
[1]Bersuder P,Hole M,Smith G.Antioxidants from a heated histidine-glucose model system.Investigation of the copper(Ⅱ) binding ability[J].J Am Oil Chem Soc,2001,78:1079-1082.
[2]Kanokwan M,Soottawat B,Munehiko T.Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system[J].Food Chem,2005,93:189-196.
[3]Maillard M N,Billaud C,Chow Y N,et al.Free radical scavenging,inhibition of polyphenoloxidase activity and copper chelating properties of model Maillard systems[J].LWT,2007,40:1434-1444.
[4]Hodge J E.Dehydrated foods,chemistry of browning reactions in model systems[J].J Agric Food Chem,1953(1):928-943.
[5]Davidek T,Clety N,Aubin S,et al.Degradation of the Amadori compound N-(1-deoxy-D-fructose-1-yl)glycine in aqueous systems[J].J Agric Food Chem,2002,50:5472-5479.
[6]Ajandouz E H,Tchiakpe L S,Dalleore F,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model system[J].J Food Sci,2001,66:926-931.
[7]Jing H,Kitts D D.Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems[J].Arch Biochem Biophys,2004,429:154-163.
[8]Kanokwan M,Soottawat B,Munehiko T.Effect of reactant concentrations on the Maillard reaction in a fructose-glycine modelsystem and the inhibition ofblack tiger shrimp polyphenoloxidase[J].Food Chem,2006,98:1-8.
[9]孙丽平,庄永亮,张莉,等.酶解小麦蛋白产物-还原糖美拉德反应的光谱研究[J].分析化学,2009,37(9):1359-1362.
[10]Yen G C,Hsieh P P.Antioxidative activity and scavenging effects on active oxygen of xylose-lysine Maillard reaction products[J].J Sci Food Agric,1995,67:415-420.
[11]Cämmerer B,Kroh L W.Investigation of the contribution of radicals to the mechanism of the early stage of the Maillard reaction[J].Food Chem,1996,57:217-221.
[12]Morales F J,Fernández-Fraguas C,Jiménez-Pérez S.Ironbinding ability of melanoidins from food and model systems[J]. Food Chem,2005,90:821-827.
[13]屈景年,刘义,涂麟俊,等.L-丙氨酸和L-组氨酸与铜离子混配合物的热化学[J].化学通报,2002(11):786-790.
[14]Jean G B,Odile D,Jacqueline D,et al.Protection of U937 cells against oxidative injury by a novel series of iron chelators[J].Free Radical Bio Med,1998,25:881-890.
Study on Cu2+-chelating function of Maillard reaction products from lysine-glucose model system
SUN Li-ping1,ZHUANG Yong-liang1,WANG Dong-feng2
(1.Research Center of Food Engineering,College of Chemistry and Engineering,Kunming University of Science and Technology,Kunming 650224,China;2.The Laboratory of Food Science,College of Food Science and Technology,Ocean University of China,Qingdao 266003,China)
The antioxidant activity of MRPs from lysine-glucose model system was investigated,especially its Cu2+-chelating function by zero-crossing first-derivative spectrophotometry was studied.The results showed that Cu2+-chelating to MRPs made the electronic rearrangement in low molecular weight intermediates,and partly destroyed the reducing power and DPPH-scavenging ability.The results indicated that the antioxidant properties of MRPs were a result of multiple mechanisms,and Cu2+-binding sites had reducing power or DPPH·scavenging ability.
Maillard reaction;antioxidant activity;metal-chelating effect;first derivative spectrophotometry
TS201.2
A
1002-0306(2011)03-0169-03
MRPs被认为是具有抗氧化活性的天然产物,能够延缓脂质氧化、抑制多酚的酶促褐变等。美拉德反应过程非常复杂,MRPs是混合物,产物组成和性质因反应条件而有较大的差异,抗氧化效果是混合物的综合表现。目前对于MRPs的抗氧化机理报道较少,而MRPs对金属离子具有螯合作用被认为是其抗氧化机理之一[1]。赖氨酸对美拉德反应最为敏感,葡萄糖是食品加工和生物体中最常见的还原糖,赖氨酸-葡萄糖美拉德反应产物普遍存在,研究其抗氧化效果和金属螯合作用是很有意义的。为此,本文制备了一定条件下的赖氨酸-葡萄糖MRPs,测定了其抗氧化效果,利用零交一阶导数分光光度法研究了MRPs对铜离子的螯合作用,分析了不同铜离子浓度对抗氧化效果的影响,以期为MRPs的抗氧化机理及对微量金属元素吸收利用的影响等研究提供资料。
2010-02-25
孙丽平(1981-),女,博士,讲师,研究方向:食品安全与营养。
