微渗析-微分析联用技术在活体研究中的应用
2011-11-03杨志勇
杨志勇
(大理学院药学与化学学院,云南大理 671000)
微渗析-微分析联用技术在活体研究中的应用
杨志勇
(大理学院药学与化学学院,云南大理 671000)
微渗析取样是一种高效的生物活体取样技术,可与多种微纳分析设备组成联用对活体进行实时、在线分析。本文评述其技术原理、联用方式,应用范围及其局限性,并对其发展趋势进行预测,引用文献31篇。
微渗析;活体取样;在线联用;评述
1 引言
在生命医学、药理学、神经科学研究中,微渗析(Microdialysis,MD)是一种广泛用于体内研究药物的取样技术〔1-3〕。较之取血或组织匀浆法等传统取样方法,MD具有以下显著优势:①提供作用部位的药物浓度及其代谢变化等信息;②样品不含蛋白质、酶等大分子物质,只含游离的药物;③样品无需复杂的分离净化处理,无体液损失,组织损伤小;④可持续取样,获得药物代谢中间过程信息;⑤可在同一脏器的不同区域或多个脏器同时取样,研究药物在同个脏器中不同区域或不同脏器的分布和代谢;⑥可在清醒、自由活动的动物个体上取样,在接近正常生理条件下得到实验结果,更有科学性和实际意义。
因此,微渗析是一种在不破坏(或很少破坏)生物体内环境的前提下,对生物体细胞间液的内源性或外源性物质进行连续取样的技术。
2 微渗析技术
2.1 微渗析技术的原理 当取样探针插入生物体取样部位后,探针上的渗析膜对生物大分子如酶等可进行过滤截留,小分子物质通过渗析膜的扩散遵守Fick’s扩散定律。当灌流液以一定速度通过微渗析探针,在膜的两侧则产生了浓度梯度。如果探针周围组织中药物的浓度(细胞外液,Extracellular Fluid)大于灌注液中的浓度,药物会扩散进入探针中(见图1)。此时,将药物在渗析液中的浓度(Cd)和在组织液中的浓度(Cm)的比值称为回收率(相对回收率,relative recovery)R=Cd/Cm〔4〕。
2.2 探针回收率的测定 探针的回收率测定是微渗析定量的基础。目前常用的几种探针回收率测定的方法主要有:无净流出量变化点法(point of no net flux)〔5〕;动态无净流出量变化点法(dynamic no net flux)〔6〕,反向渗析法(Retrodialysis)〔7〕。
一般认为,探针回收率是由膜的有效面积、膜的材料特性〔8〕、灌注液流速、被测物质性质及取样温度决定的〔9〕。
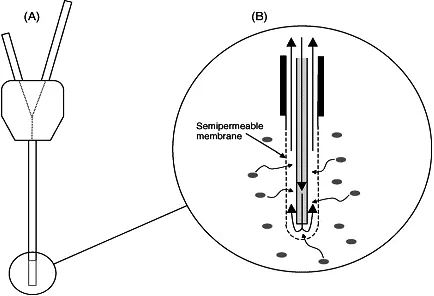
图1 微渗析取样原理图〔3〕
2.3 微渗析技术的局限性 与任何一项取样技术一样,微渗析用于体内取样时也存在局限性。尽管微渗析取样探针的尺寸比较小,在手术植入探针过程中对组织、脏器依然会造成创伤;同时,由于探针的物理结构,使其在精细部位如大脑局部区域取样的空间分辨率不够,所以,取样只能是接近于动物的正常生理状态下的试验结果。
此外,微渗析回收率与灌流速度是一对矛盾〔10〕,在使用微渗析技术时,往往要在灌流速度、方法回收率和时间分辨率等因素间进行条件优化。
3 微渗析与分析技术的联用
3.1 离线分析(Offline approaches) 微渗析取样是持续性的过程,而大多数的分析方法从进样到完成分析是间歇性的。早先的微渗析取样-分析技术中,往往采用将样品集中收集,而后进行统一的分析,即所谓离线分析。此时,进样量和灌流速度决定了能得到的最高的时间分辨率。显然,离线分析无法对活体实时分析;而自样品采集至进样分析过程中的任何的衍生、萃取等前处理都将导致实验结果产生很大的误差。
3.2 在线分析(Online approaches) 由于渗析液中不含蛋白质,故可直接进样分析,即所谓微渗析与分析系统在线联用。在线联用系统中,探针能够在两次分析的间隔时间完成取样。所以,分析速度将决定总体的时间分辨率。对于在线联用、尤其是实时分析而言,需考虑所建立的分析方法的时间分辨率是否足够完成所研究的生理过程。
3.2.1 微渗析-高效液相色谱(MD-LC) 微渗析与窄径柱高效液相色谱(Microbore liquid chromatography,MLC)联用是迄今为止最常见的在线联用方式。MD-MLC系统通常由LC泵,配有定量环的进样器、色谱柱、检测器、数据记录仪等组成(见图2)。

图2 微渗析-高效液相色谱联用装置示意图〔11〕
MLC常采用反相柱或离子交换柱,具有高灵敏度,分析速度快的特点。在MD-MLC中,所有引起谱带展宽,进样死体积和检测池死体积都应该避免,连接管路的长度应尽可能缩短〔12〕。
MD-MLC联用技术的关键在于二者之间的接口。采用传统的六通阀进样,由于渗析液不能完全进入色谱柱而引起进样误差。由此,发展出了多定量环技术,使渗析液自探针分别进入两个或多个定量环,从而减少进样误差并保证一定的时间分辨率。
McLaughlin等分别采用窄径柱和常规色谱柱对安定及其代谢物进行测定,系统时间分辨率分别为14、23 min〔13〕;Mathy等使用窄径柱(1×150 mm)对氟康唑在老鼠血液和皮肤中的浓度进行同时在线监测,时间分辨率从40 min提高到24 min〔12〕。
毛细管柱色谱的内径在50~500 μm,长度在5~200 cm范围,较MLC有更小的进样量和更高的分离效率。当其与MS进行联用时,能使分析物更好的离子化,从而获得更高的检测灵敏度〔14〕。
在线的MD-LC分析中,检测方式决定于分析对象及要求的检测灵敏度。目前,紫外检测仍然在药代动力学研究中广泛使用;电化学检测能对单胺类等神经递质进行高灵敏度检测;荧光检测具有较好的灵敏度,在MD-MLC系统联用中较多被采用,但须对分析物进行衍生处理〔15〕。值得注意的是,由于质谱检测不但具有较高的检测灵敏度,同时能提供分析物质的结构信息。MD-MLC-MS被用于对体内乙酰胆碱的在线检测和对双氯芬酸的透皮过程研究〔16〕。
3.2.2 微渗析-毛细管电泳(MD-CE) 毛细管电泳具有进样量小,分析速度快的特点,非常适合与MD联用进行活体在线分析。MD-CE联用有更好的时间分辨率。MD-CE的关键在于二者之间的接口技术。
Hogan等〔17〕在MD-CE接口应用一种可旋转的微进样阀,微进样阀把连续的渗析流分割成为不连续的样品塞流(每个60 nL),然后被缓冲液传送至一个存有分离缓冲的缓冲池,在此,缓冲输送毛细管出口与分离毛细管的进口保持一定间隙并准确对齐(见图3)。通过电动进样使样品塞流进入CE,多余的样品被后续的缓冲液冲离进样位置。在这一接口中,非常仔细地对准传输毛细管和分离毛细管的管口,并保持二者之间有合适的间隙是操作成功的关键。

图3 采用“间歇连接”接口的微渗析-毛细管电泳联用装置示意图〔18〕
Lada和Kennedy〔19〕报道了另外一种接口技术,即流量控制接口。接口由两块钢板夹住一个聚四氟乙烯垫片构成,钢板上面开一小孔限制流量。渗析液探针的出口和毛细管的入口正好对齐并相距一个垫片的距离。钢板的上下分别开有两个小孔用于引入和放出电泳缓冲液,形成与渗析-电泳流路相垂直的另一流路(见图4)。在电泳过程中,控制流路中的缓冲液从垂直方向冲洗探针引入渗析液并提供电泳所需的缓冲液。关闭控制流路时,渗析液没有阻力进入毛细管从而完成进样。在此系统中,也可通过断开分离电压使渗析液在毛细管入口处累积至一定浓度,然后电动进样数秒,再断开进样电压,此时,控制流路重新开始将多余的渗析液自毛细管入口处冲掉,重新升压进行分离。控制流路接口具有极小的死体积,可控制探针中渗析液按nL级的流速流动,使系统的时间分辨率保持较低。这种进样接口要求探针入口和毛细管入口必须完全对准。此外,控制流路的流速大小、渗析液在毛细管口富集时间均是保证接口正常工作的必要条件。

图4 采用“流量控制”接口的微渗析-毛细管电泳联用装置示意图〔19〕
Lada等〔19〕运用流量控制接口,结合MD-CEUV技术,对老鼠大脑中抗坏血酸盐进行了测定,实验的时间分辨率大概在110 s。
在检测方式上,LIF检测具有较高的灵敏度,可对多种生物活性物质进行检测〔20〕,在MD-CE联用中被广泛采用;此外,电化学检测也具有相对高的灵敏度,可对具有氧化还原活性的生物内源性物质进行检测〔21〕。
由于CE进样量较小,CE-MS较LC-MS的灵敏度偏低,因而MD-CE-MS的联用方式较为少见。Takada等〔22〕报道单纯采用CE-MS测定样品中的y-氨基丁酸(GABA),其检测限为10~5 m,采用微渗析自老鼠大脑中取样后,但在同样的分析条件下不能测出GABA。
3.2.3 微渗析-芯片电泳联用(Microdialysis-microchip electrophoresis,MD-MC) MD与LC、CE联用的问题之一在于分离设备体积过大,无法自由移动,在一些特殊场合,不便于对实验动物进行实时分析。近年来,随着芯片电泳技术的发展,MD-MC联用技术得以发展。相对于传统的CE,芯片电泳在手掌大小的一块芯片上,将样品制备、衍生、进样和分离检测集成在一起,具有更小的进样量和更快的分离速度。
Huyhn等〔23〕首先报道了MD-MC联用技术,芯片采用钠钙玻璃制备,并刻蚀双T字通道,注射泵将缓冲液持续地灌流通过探针(4 mm CMA/12),并将渗析液通过PEEK管引入MC,PEEK管与MC之间通过一个密封套(Upchurch Scientific)实现连接。在分离通道垂直的方向施加阻断电压将连续的渗析液流分割为单个的塞流。系统被成功应用于对β-半乳糖苷酶活性的监测。当酶催化β-半乳糖苷酶中标记的荧光素释放时,底物和产品均可采用LIF进行检测。系统时间分辨率约5~7 min。
类似的装置也被用于研究氨基酸、肽〔24〕,报道的时间分辨率达30~40 s。Kennedy小组则采用改进的MD-MC技术对体内氨基酸类神经递质进行连续监测,时间分辨率为2~4 min〔25〕。
3.2.4 微渗析-生物传感器联用(Microdialysis coupled to biosensors) 生物传感器可对生化过程中的物质进行识别并产生相应的电信号。由于没有分离过程,生物传感器与MD联用时有较好的时间分辨率,但大多数生物传感器只能对单一分析物进行检测。生物传感器的种类很多,大多利用酶反应产生电、光信号进行检测。理想的生物传感器可在一定的时间范围内对病人的体液成分进行连续地监测。在线的MD-Biosensor联用系统要求对复杂的生物环境中对分析物产生高灵敏度和选择性的响应;同时,应能对极少的样品量进行分析〔26〕。
Gramsbergen等采用MD-Biosensor研究了自由活动的老鼠在缺血条件下体内的葡萄糖、乳酸水平变化;实验采用流动注射进样,酶电极进行安培检测〔27〕;也有报道采用传感结合化学发光检测对兔子体内的葡萄糖水平进行监测〔28〕。最近的研究是将亚甲绿吸附于单壁碳纳米管制备电极,并与MD联用,对老鼠大脑缺血和再灌注条件下葡萄糖及乳酸水平进行监测〔21〕。目前MD-Biosensor联用技术可对葡萄糖、乳酸,丙酮酸〔29-30〕、谷氨酸、乙酰胆碱、多巴胺〔31〕,过氧化氢〔29〕等进行在线监测研究。
4 展望
目前,微渗析取样主要用于对体内物质的动态变化进行连续性监测。这就要求对渗析液进行快速、灵敏的分析,以获得满意的时间分辨率。随着各种微分离技术的进步,微渗析与它们之间的联用将能够更加准确、客观地对体内生化过程进行实时分析。其中,微渗析-芯片电泳的联用以其分析成本低、分速度快、较好的时间分辨率以及结构简单、操作方便等优点尤为引人注目。可以预见,随着芯片制造技术和接口技术的发展,将催生出可植入人或动物体内的微渗析-芯片电泳装置,对生物体内过程进行监测。另外,对于LC、CE这些传统的分离技术,采用质谱等高灵敏度检测方法并结合微渗析取样技术,将能够更加广泛地在生物、医药、环境等领域获得应用。
〔1〕C.S.Chaurasia.AAPS-FDA workshop white paper: microdialysis principles,application,and regulatory perspectives〔J〕.J.Clin.Pharmacol.,2007,47:589-603.
〔2〕J.C.Goodman,C.S.Robertson.Microdialysis:is it ready for prime time〔J〕.Curr.Opin.Crit.Care,2009,15:110-117.
〔3〕N.Plock,C.Kloft.Microdialysis-theoretical background and recent implementation in applied life-sciences〔J〕. Eur.J.Pharm.Sci.,2005,25:1-24.
〔4〕P.M.Bungay,P.F.Morrison,R.L.Dedrick.Steady-state theory for quantitative microdialysis of solutes and water in vivo and in vitro〔J〕.Life Sci.,1990,46:105-119.
〔5〕C.S.Chaurasia.In vivo microdialysis sampling:theory and applications〔J〕.Biomed.Chromatogr.,1999,13:317-332.
〔6〕M.Stahl.Human microdialysi〔sJ〕.Curr.Pharm.Biotechnol.,2002,3:165-178.
〔7〕J.E.Edwards,K.R.Brouwer,P.J.McNamara.GF120918,a Pglycoprotein modulator,increases the concentration of unbound amprenavir in the central nervous system in rats. Antimicrob〔J〕.Agents Chemother.,2002,46:2284-2286.
〔8〕K.L.Snyder.Diffusion and calibration properties of microdialysis sampling membranes in biological media〔J〕. Analyst,2001,126:1261-1268.
〔9〕 L.Groth.Cutaneousmicrodialysismethodologyand validation〔J〕.Acta Derm.Venerol,1996,76(Suppl):1-61.
〔10〕N.R.Ekberg.Measurement of glucose and metabolites in subcutaneous adipose tissue during hyperglycemia with microdialysis at various perfusion flow rates〔J〕.Clin. Chim.Acta,2005,359:53-64.
〔11〕M.Leggas,Y.Zhuang,J.Welden,et.al..Microbore HPLC method with online microdialysis for measurement of topotecan lactone and carboxylate in murine CSF〔J〕.J Pharm.Sci.,2004,93:2284-2295.
〔12〕F.X.Mathy.On-line determination of fluconazole in blood and dermal rat microdialysates by microbore highperformance liquid chromatography〔J〕.J.Chromatogr. B,2003,787:323-331.
〔13〕K.J.McLaughlin,A.A.Faibushevich,C.E.Lunte. Microdialysis sampling with online microbore HPLC for the determination of tirapazamine and its reduced metabolites in rats〔J〕.Analyst,2000,125:105-110.
〔14〕H.M.Shackman,M.Shou,N.A.Cellar,et.al.. Microdialysiscoupled on-line to capillary liquid chromatography with tandem mass spectrometry for monitoring acetylcholine in vivo〔J〕.J Neurosci.Meth.,2007,159:86-92.
〔15〕T.Yoshitake,R.Iizuka,J.Kehr,et.al..Determination of serotonin in microdialysis samples from rat brain by microbore column liquid chromatography with postcolumn derivatization and fluorescence detection〔J〕.J Neurosci.Meth.,2001,109:91-96.
〔16〕B.X.Mayer.Comparison of UV and tandem mass spectrometric detection for the high-performance liquid chromatographic determination of diclofenac in microdialysis samples〔J〕.J.Pharm.Biomed.Anal.,2003,33:745-754.
〔17〕B.L.Hogan,S.M.Lunte,J.F.Stobaugh,et.al..Online Coupling of in vivo Microdialysis Sampling with Capillary Electrophoresis〔J〕.Anal.Chem.,1994,66:596-602.
〔18〕M.I.Davies.Microdialysis sampling coupled on-line to microseparation Techniques〔J〕.Chem.Soc.Rev.,1997,26:216-222.
〔19〕M.W.Lada,G.Shaller,M.H.Carriger,et.al..On-line interface between microdialysis and capillary zone electrophoresis〔J〕.Anal.Chim.Acta,1995,307:217-225.
〔20〕M.Shou,C.R.Ferrario,K.N.Schultz,et.al..Monitoring dopamine in vivo by microdialysis sampling and on-line CE-laser-induced fluorescence〔J〕.Anal.Chem.,2006,78:6717-6725.
〔21〕Y.Lin,N.Zhu,P.Yu,et.al..Physiologically relevant online electrochemicalmethod forcontinuousand simultaneous monitoring of striatum glucose and lactate following global cerebral ischemia/reperfusion〔J〕.Anal. Chem.,2009,81:2067-2074.
〔22〕Y.Takada,M.Yoshida,M.Sakain,et.al..Detection ofaminobutyric acid in a ratbrain using in vivo microdialysis-capillary electrophoresis/mass spectrometry Rapid Commun〔J〕.Mass Spec.,1995,9:895-896.
〔23〕B.H.Huynh,B.A.Fogarty,R.S.Martin,et.al..On-line coupling of microdialysissampling with microchip-based capillary electrophoresis〔J〕.Anal.Chem.,2004,76:6440-6447.
〔24〕B.H.Huynh,B.A.Fogarty,P.Nandi,et.al..A microchip electrophoresis device with on-line microdialysis sampling and on-chip sample derivatization by naphthalene 2,3-dicarboxaldehyde/2-mercaptoethanol for amino acid and peptide analysis〔J〕.J Pharm.Biomed. Anal.,2006,42:529-534.
〔25〕Z.D.Sandlin,M.Shou,J.G.Shackman,et.al.. Microfluidic electrophoresis chip coupled to microdialysis for in vivo monitoring of amino acid neurotransmitters〔J〕. Anal.Chem.,2005,77:7702-7708.
〔26〕M.Zhang,L.Mao.Enzyme-basedamperometric biosensors for continuous and on-line monitoring of cerebral extracellular microdialysate〔J〕.Front Biosci.,2005,10:345-352.
〔27〕J.B.Gramsbergen,J.Skjoth-Rasmussen,C.Rasmussen,et.al..Online monitoring of striatum glucose and lactate in the endothelin-1 ratmodel of transient focal cerebral ischemia using microdialysis and flow-injection analysis with biosensors〔J〕.J Neurosci.Meth.,2004,140:93-110.
〔28〕B.Li,Z.Zhang,Y.Jin.Chemiluminescence flow sensor for in vivo on-line monitoring of glucose in awake rabbit by microdialysis sampling〔J〕.Anal.Chim.Acta,2001,432:95-100.
〔29〕M.M.Rhemrev-Boom,K.Venema,R.Tiessen,et.al.. On-line continuous monitoring of glucose or lactate by ultraslow microdialysis combined with a flowthrough nanoliter biosensor based on poly(m-phenylenediamine)ultrathin polymer membrane as enzyme electrode〔J〕. Analyst,2001,126:1073-1079.
〔30〕T.Yao,T.Yano,H.Nishino.Simultaneous in vivo monitoring ofglucose, llactate, and pyruvate concentrations in rat brain by a flow-injection biosensor system with an on-line microdialysis sampling〔J〕.Anal. Chim.Acta,2004,510:53-59.
〔31〕T.Yao,G.Okano.Simultaneous determination of lglutamate,acetylcholine and dopamine in rat brain by a flow-injection biosensor system with microdialysis sampling〔J〕.Anal.Sci.,2008,24:1469-1473.
Application of Microdialysis-microanalysis Coupling Technique in Vivo Studies
YANG Zhiyong
(School of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China)
Microdialysis sampling is an effective biological sampling technique in vivo,which has been coupled with many micronano analysis equipments for real-time,on-line analysis in vivo.In this review of 31 documents,the technical principle,combination mode,application range and limitation of microdialysis are stated and its development is predicted.
microdialysis;sampling in vivo;on-line coupling;review
R969[文献标志码]A[文章编号]1672-2345(2011)12-0016-05
大理学院博士科研启动金项目(ky1019207610)
2011-04-12
2011-09-06
杨志勇,讲师,博士,主要从事液相色谱、毛细管电泳技术在体内药物分析中的应用研究.
(责任编辑 毛本勇)
