冷冻干燥对乳酸菌代谢活力的影响
2011-11-02李宝坤田丰伟刘小鸣赵建新宋元达
李宝坤,田丰伟,刘小鸣,赵建新,张 灏,宋元达,陈 卫,*
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122; 2.石河子大学食品学院,新疆石河子832000)
冷冻干燥对乳酸菌代谢活力的影响
李宝坤1,2,田丰伟1,刘小鸣1,赵建新1,张 灏1,宋元达1,陈 卫1,*
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏无锡214122; 2.石河子大学食品学院,新疆石河子832000)
以保加利亚乳杆菌和植物乳杆菌ST-Ⅲ为研究对象,用15%蔗糖、10%海藻糖、15%蔗糖+2%谷氨酸钠及10%脱脂乳为冷冻保护剂,与不加冷冻保护剂的样品进行冻干后菌种活力的对比,测定冷冻干燥后菌体中己糖激酶、丙酮酸激酶、乳酸脱氢酶的活力,胞外蛋白及胞内Ca2+的浓度变化。结果表明:冷冻干燥对菌体的己糖激酶和丙酮酸激酶影响不显著,对乳酸脱氢酶具有显著性的影响。同时,不加保护剂菌体的胞外蛋白含量明显高于添加保护剂的,而胞内Ca2+却远低于其他组。这一结果说明,冷冻干燥使代谢关键酶如乳酸脱氢酶失活,同时对细胞膜造成了损伤,从而引起细胞代谢活力的下降。
冷冻干燥,乳酸菌,保护剂,乳酸脱氢酶,膜损伤
1 材料与方法
1.1 材料与仪器
植物乳杆菌 ST-Ⅲ(Lactobacillus plantarum ST-Ⅲ)和保加利亚乳杆菌(Lactobacillus bulgaricus)由江南大学食品学院食品生物技术实验室提供;培养基 MRS;Fluo3-AM钙离子荧光探针 碧云天生物技术研究所;考马斯亮蓝G-250 美国Amresco公司;己糖激酶、丙酮酸激酶、乳酸脱氢酶试剂盒南京建成生物公司;保护剂 15%蔗糖(w/v)、10%海藻糖(w/v)、15%蔗糖+2%谷氨酸钠(w/v)、10%脱脂乳(w/v);其他试剂 均为分析纯。
岛津 2450紫外-可见光分光光度计,日立F-7000荧光分光光度计,LABCONCO冷冻干燥机。
1.2 冻干后存活率的测定
利用平板计数法检测以15%蔗糖,10%海藻糖,15%蔗糖+2%谷氨酸钠及10%脱脂乳作为冷冻保护剂与不加冷冻保护剂冻干前后菌体数量,将冻干后的菌粉用PBS复水至冻干前相同体积,采用MRS倒平板法,37℃(植物乳杆菌)或42℃(保加利亚乳杆菌)下培养48h,计数。实验重复3次,每次3个平行。根据NA/NB×100%计算存活率,NA是冻干后细胞数,NB为冻干前细胞数。
1.3 无细胞提取液制备
将冻干前后的菌液离心,用0.85%NaCl溶液清洗2次后,再用等量的磷酸盐缓冲液(0.2mol磷酸钾,2mmol EDTA,pH7.0)悬浮。取3mL细胞液在冰浴中进行3s∶9s的超声破碎100个循环。在4℃,10000 ×g离心10min,取上清液保存,用于相关酶活检测。
1.4 己糖激酶(HK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)的测定
采用南京建成生物公司的相应试剂盒进行测定。
1.5 细胞内Ca2+测定采用Fluo3-AM荧光探针法
取5mmol/L的Fluo3-AM/DMSO溶液0.6μL,加入到复水后的 3mL菌液中(1.0×109cfu/mL),Fluo3-AM的终浓度为1μmol/L,避光条件下,37℃孵育30min,然后离心(10000×g,5min)弃上清液,用生理盐水洗涤一次后,重悬于3mL生理盐水中。将负载好的样品置于荧光分光光度计内,以488nm为激发波长,观察525nm处的荧光强度。
1.6 蛋白质的测定
考马斯亮蓝染色法[9]。
1.7 数据统计分析
采用Origin7.5作图,采用One-way ANOVA法统计分析其显著性,P值小于0.05为显著水平。
2 结果与讨论
2.1 不同保护剂对乳酸菌冷冻干燥存活率的影响
冷冻干燥是一个剧烈的、综合的胁迫过程,涉及到冷冻胁迫、冰晶引起的机械损伤、高渗胁迫、脱水干燥等,导致菌体的存活率降低。为了提高菌体的存活率、保持菌体活力,在冷冻干燥前通常会添加一些冷冻保护剂。本研究采用15%蔗糖(w/v)、10%海藻糖(w/v)、15%蔗糖+2%谷氨酸钠(w/v)及10%脱脂乳(w/v)作为冷冻保护剂,与不加冷冻保护剂的样品进行冻干后菌种存活率的对比,结果见图1。
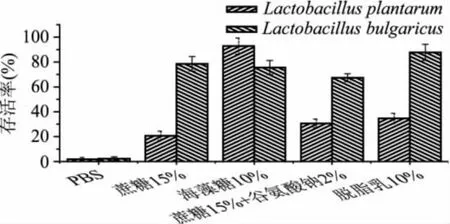
图1 不同保护剂对乳酸菌冷冻干燥存活率的影响
由图1可以看出,添加保护剂可以明显提高菌种的存活率,但也可以看出,不同的保护剂对不同菌种的保护效果是有所差异的。对植物乳杆菌ST-Ⅲ来说,最佳的保护剂为10%的海藻糖,其存活率为92.8%;而对于保加利亚乳杆菌来说,最佳的保护剂为10%的脱脂乳,其存活率为87.7%。
2.2 不同保护剂对乳酸菌冷冻干燥后己糖激酶活力的影响
己糖激酶广泛存在于各种动物、植物和微生物中,为EMP代谢途径中的关键酶之一,其活性大小与乳酸菌的糖代谢速率相关,本研究测定冷冻干燥后不同保护剂对其的影响,结果如图2所示。
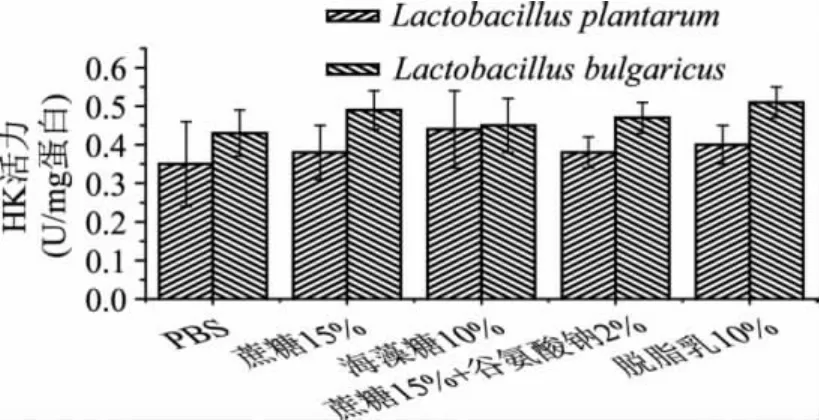
图2 不同保护剂对冷冻干燥后菌体己糖激酶活力的影响
由图2可以看出,对于植物乳杆菌和保加利亚乳杆菌,虽然在不同的保护剂中己糖激酶的活力有所不同,但相对于未加保护剂的冻干菌体来说,没有显著性的差异。这一结果说明,冻干对己糖激酶影响不大,己糖激酶不是乳酸菌冻干损伤的主要代谢酶。
2.3 不同保护剂对乳酸菌冷冻干燥后丙酮酸激酶活力的影响
丙酮酸激酶也是EMP代谢途径中的关键酶之一,在糖酵解系统里,其催化磷酸烯醇式丙酮酸转变为丙酮酸,磷酸烯醇式丙酮酸的高能磷酸键在催化下转移给ADP生成ATP,反应不可逆,丙酮酸激酶是糖酵解途径中的限速酶之一。本研究测定冷冻干燥后不同保护剂对其影响,结果如图3所示。
由图3可以看出,经过不同的处理,冷冻干燥后,两种乳酸菌的丙酮酸激酶的活力变化不大,说明冷冻干燥对丙酮酸激酶的影响不大,同时可以推测出,丙酮酸激酶不是乳酸菌冷冻干燥损伤的关键代谢酶。
2.4 不同保护剂对乳酸菌冷冻干燥后乳酸脱氢酶活力的影响
乳酸脱氢酶是乳酸菌代谢的关键酶,正常发酵过程中,乳酸脱氢酶催化丙酮酸还原为乳酸,它的活力大小反映了菌株的产酸能力。本研究分别测定了冷冻干燥后不同保护剂对其影响,结果如图4所示。

图3 不同保护剂对冷冻干燥后菌体丙酮酸激酶活力的影响
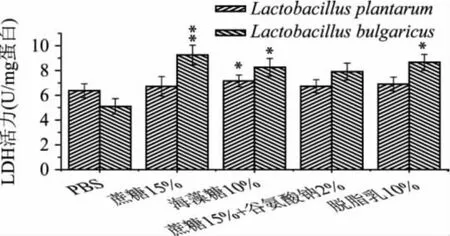
图4 不同保护剂对冷冻干燥后菌体乳酸脱氢酶活力的影响注:*,P<0.05;**,P<0.01;图5、图6同。
由图4可以看出,不同的保护剂下乳酸脱氢酶的活力有显著性的差异。对于植物乳杆菌ST-Ⅲ来说,海藻糖的保护效果具有显著性水平(P<0.05),在没有保护剂的情况下乳酸脱氢酶的活力为6.37± 0.56U/mg蛋白,而在海藻糖中为7.16±0.47U/mg;对于保加利亚乳杆菌来说,蔗糖的保护效果达到极显著水平(P<0.01),海藻糖和脱脂乳达到显著水平(P<0.05),分别为 9.25±0.79、8.26±0.72、8.66± 0.65U/mg蛋白,而未加保护剂的情况下仅仅为5.1± 0.63U/mg。
2.5 不同保护剂对乳酸菌冷冻干燥后胞内Ca2+浓度的影响
本研究采用Fluo3-AM荧光探针法测定冻干后乳酸菌细胞内Ca2+浓度,比较不同冷冻干燥保护剂对细胞内Ca2+浓度的影响,实验结果如图5所示。
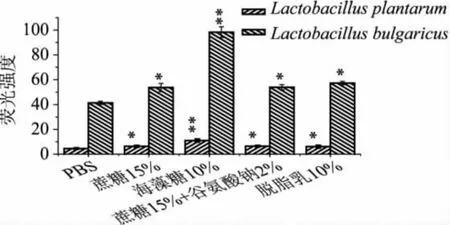
图5 不同保护剂对冷冻干燥后菌体胞内Ca2+浓度的影响
由图5可知,在相同的OD条件下,植物乳杆菌ST-III和保加利亚乳杆菌菌体中的Ca2+浓度有所不同,但经过不同的冻干处理后,变化趋势相似。在未添加保护剂时Ca2+荧光强度最低,在海藻糖中的Ca2+荧光强度最大。说明海藻糖对乳酸菌具有良好地保护效果,可以很好地保护膜的完整性。这是因为在菌体脱水和复水的过程中,海藻糖中羟基可以和磷脂双分子层形成氢键,保持了膜的稳定性[10],从而减少了胞内Ca2+的流失。
2.6 不同保护剂对乳酸菌冷冻干燥后胞外蛋白浓度的影响
因脱脂乳中含有较多蛋白质,所以导致实验数据偏大,影响观测结果,在此将其略去,测定结果见图6。
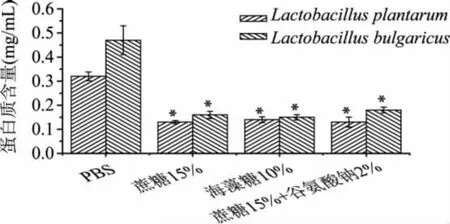
图6 冻干后胞外蛋白的含量
由图6可知,未添加保护剂的菌体冻干后,菌液胞外蛋白含量比添加保护剂组的要高,说明在未添加冷冻保护剂的情况下,冻干会导致菌体的细胞膜破损,细胞膜通透性增大,胞内蛋白溶出细胞外,保护剂在保护细胞膜完整性上起到很重要的作用。
3 结论
在冷冻干燥的过程中,保护剂对不同菌种的保护效果不同,对植物乳杆菌ST-Ⅲ来说,最佳的保护剂为10%的海藻糖,其存活率为92.8%,而对于保加利亚乳杆菌来说,最佳的保护剂为10%的脱脂乳,其存活率为87.7%。冷冻干燥对菌体的己糖激酶和丙酮酸激酶影响不显著,对乳酸脱氢酶具有显著性的影响,其中以海藻糖的保护效果最好。这一结果说明在冷冻干燥的过程中乳酸脱氢酶与菌体的活力相关。同时还测定了冻干后菌体胞外蛋白及胞内Ca2+的浓度变化,研究发现,不加保护剂菌体的胞外蛋白含量明显高于添加保护剂的,而胞内Ca2+却远低于其他组,说明冷冻干燥过程对细胞膜造成了损伤,从而引起细胞代谢活力的下降。
[1]Carvalho A S,Silva J,Ho P,et al.Impedimetric method for estimating the residual activity of freeze-dried Lactobacillus delbrueckii ssp.bulgaricus[J].International Dairy Journal,2003,13:463-468.
[2]张英华,霍贵成,郭鸰.乳酸菌冷冻干燥技术研究进展[J].东北农业大学学报,2005,36(6):799-803.
[3]Morgana C A,Herman N,White P A,et al.Preservation of micro-organismsby drying:A review[J].Journalof Microbiological Methods,2006,66:183-193.
[4]乔发东,南庆贤.浓缩乳酸菌发酵剂冷冻干燥介质的选择[J].中国乳品工业,1998,26(4):13-15.
[5]张英华,霍贵成,郭鸰.乳酸菌冷冻干燥保护剂的筛选[J].食品科技,2006,31(11):72-75.
[6]李家鹏,张学刚,乔晓玲,等.响应面法优化植物乳杆菌冷冻干燥保护剂配方的研究[J].食品科学,2008,29(6): 146-150.
[7]Saarela M H,Alakomi H L,Puhakka A,et al.Effect of the fermentation pH on the storage stability of Lactobacillus rhamnosus preparations and suitability ofin vitro analyses of cell physiological functions to predict it[J].Journal of Applied Microbiology,2009,106:1204-1212.
[8]Broadbent J R,Lin C.Effect of heat shock or cold shock treatment on the resistance of Lactococcus lactis to freezing and lyophilization[J].Cryobiology,1999,39:88-102.
[9]林加涵,魏文铃,彭宣宪.现代生物学实验(下册)[M].北京:高等教育出版社,施普林格出版社,2001:34-36.
[10]Tang Ming,Waring A J,Hong Mei.Trehalose-protected lipid membranes fordeterminingmembraneprotein structureand insertion[J].Journal of Magnetic Resonance,2007,184: 222-227.
Effect of freeze drying on the metabolic viability of lactic acid bacteria
LI Bao-kun1,2,TIAN Feng-wei1,LIU Xiao-ming1,ZHAO Jian-xin1,ZHANG Hao1,SONG Yuan-da1,CHEN Wei1,*
(1.State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food,Shihezi University,Shihezi 832000,China)
The survival rates of Lactobacillus plantarum ST-Ⅲ and Lactobacillus bulgaricus in the presence of cryoprotectants such as 15%sucrose,10%trehalose,15%sucrose+2%sodium glutamate and 10%reconstituted skim milk(RSM)were estimated.In addition,we determined the activities of hexokinase(HK),pyruvate kinase (PK),lactate dehydrogenase(LDH),extracellular proteins was higher and intercellular Ca2+immediately following the freeze-drying.The results showed that the differences in HK and PK activities with and without the cryoprotectants during freeze-drying were not significant,but activities of LDH were significantly different prior to and after freeze-drying.Meanwhile,the results showed extracellular proteins was higher and intercellular Ca2+was lower in absence of cryoprotectants than in the presence of cryoprotectants.These results suggested that freezedying inactivated key enzymes(LDH)and damaged membrane structure and function.These led to decrease in viability of lactic acid bacteria during freeze-drying.
freeze-drying;lactic acid bacteria;cryoprotectants;lactate dehydrogenase;damage of membrane
TS201.3
A
1002-0306(2011)09-0203-04
乳酸菌(LAB)是一类重要的微生物,在食品工业上常常用做发酵剂及益生菌制品。工业上使用的乳酸菌依赖其浓度及保藏技术,要求其在长期保藏的过程中能保持活力及其功能[1]。冷冻干燥保藏是制备高效发酵剂常用的技术手段之一,其主要步骤为先把物质中的水分,主要是游离水预先进行降温冻结成固态的冰,然后在真空的条件下使物质中的冰晶升华,待冰晶升华后再除去部分吸附水,而物质本身留在冻结时的冰态固架中,因此其干燥后体积不变,疏松多孔,最终得到残水量很少(1%~4%)的干制品[2]。冷冻干燥技术是众多菌种保藏方法中最理想的方法之一,但是冻干过程不可避免地会造成部分乳酸菌损伤,甚至死亡[3]。多年以来,针对冷冻干燥带来乳酸菌活力低下的问题,国内外开展了大量的研究工作。在乳酸菌冷冻干燥方面,深入研究乳酸菌在冷冻干燥过程中的微生物学性质和存活机理,结合添加冷冻干燥保护剂[4-6]、乳酸菌生长培养控制[7]、细胞生理状态调控[8]和冷冻干燥工艺参数选择等多种手段,以提高冻干乳酸菌的活力,一直是乳酸菌冷冻干燥研究的重点。本文以植物乳杆菌ST-Ⅲ(Lactobacillus plantarum ST-Ⅲ)和保加利亚乳杆菌(Lactobacillus bulgaricus)为研究对象,检测不同保护剂中冷冻干燥后菌体存活率及冻干对糖代谢关键酶的影响,分析冷冻干燥造成菌体失活的主要因素,为乳酸菌冷冻干燥提供理论支持。
2010-05-16 *通讯联系人
李宝坤(1979-),男,教师,在读博士研究生,研究方向:食品微生物学。
国家自然基金(20836003,30871952);“十一五”国家科技支撑计划重点项目(2009BADC1B02,2009BADB9B05)。
