毛豆腐提取物的自由基清除活性研究
2011-11-02赵新淮
杭 梅,赵新淮
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨150030)
毛豆腐提取物的自由基清除活性研究
杭 梅,赵新淮*
(东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨150030)
利用20%、40%、60%乙醇溶液(v/v)、pH4.5水、pH6.5水作为提取溶剂,对发酵时间为3、5、7、9d的毛豆腐分别进行提取,测定提取物中蛋白质的提取率、水解度,以及采用DPPH、ABTS法评价提取物的体外自由基清除活性。研究结果表明,随着毛豆腐发酵时间的延长,提取物中蛋白质的提取率、水解度均逐渐增加,并且提取物的自由基清除活性也明显地提高;通过比较还发现,毛豆腐乙醇提取物的自由基清除活性高于水提取物,且随着乙醇浓度的提高,提取物的自由基清除活性提高。排阻色谱分析结果证明,发酵9d后毛豆腐中蛋白质充分水解,5种提取物的主要成分为肽与氨基酸。
毛豆腐,提取物,提取率,水解度,自由基清除活性,排阻色谱
1 材料与方法
1.1 材料与仪器
豆腐 购自市场;毛霉 从自然发酵生产的豆制品中分离获得;1,1-二苯基-2-苦基苯肼(DPPH)、2,2-连氮-双-(3-乙基苯并噻唑啉-6-磺酸)(ABTS) 美国Sigma公司;其它所用试剂 为分析纯试剂;所用水 蒸馏水。
UV-2401PC型紫外可见分光光度计 日本岛津公司;AL204型分析天平 梅特勒-托利多仪器中国有限公司;Kjeltec TM2300型自动凯氏定氮仪 瑞士Foss公司;DHP-9272型电热恒温培养箱 哈尔滨东联电子技术开发有限公司;手提式压力蒸汽灭菌器镇海金鑫医疗器械有限公司;H-1型微型漩涡混合器、DS-1高速组织捣碎机 上海精科实业有限公司;YH-4BS型远红外恒温干燥箱 天津市中环实验电炉有限公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 毛豆腐的制作 a.取豆腐,将豆腐对半切块,121℃灭菌30min后,稍风干除去水滴,然后摆放在竹制的蒸笼内,豆腐块之间应保持一定距离,以利于发酵。b.取毛霉制成菌悬液,用毛刷将菌悬液均匀涂于各表面,再覆盖好后放入培养箱。c.培养箱温度控制在15~20℃之间。发酵过程中,豆腐表面出现白色绒毛;发酵后期豆腐软化并有毛豆腐特有的香气。
1.2.2 一些化学指标的测定
1.2.2.1 水分的测定 105℃烘干法[13]。
1.2.2.2 水溶性蛋白质含量的测定 凯氏定氮法[14]。分别将不同天数发酵好的毛豆腐在 121℃灭酶30min,取出冷却,除去菌膜后用高速组织捣碎机捣碎。取一定量样品进行凯氏定氮分析,计算总蛋白质含量,换算系数为5.71。然后,取75g样品用蒸馏水定容到250mL,高速组织捣碎机中12000r/min捣碎1.5min,并在5000r/min离心15min,得到上清液进行凯氏定氮分析,计算水溶性蛋白质含量,换算系数为5.71。实验平行3次。
1.2.3 毛豆腐提取物的制备及蛋白质提取率测定取75g毛豆腐分别与20%、40%、60%乙醇溶液(v/v)或pH4.5、pH6.5的水(1mol/L磷酸调节pH)混合并定容到250mL作为样品,之后在高速组织捣碎机中 12000r/min捣碎 1.5min,5000r/min离心15min,分离上清液得到毛豆腐提取物。乙醇溶液提取物通过旋转蒸发除去乙醇后,定容至原体积。各提取物和原始样品分别进行凯氏定氮分析,确定蛋白质提取率。实验平行3次。
蛋白质提取率(%)=[上清液中蛋白质含量(mg/mL)/总蛋白质含量(mg/mL)]×100%
1.2.4 蛋白质含量、游离氨基含量与蛋白质水解度的测定
1.2.4.1 蛋白质含量测定 参照凯氏定氮法[14]。
1.2.4.2 氨基含量与蛋白质水解度(DH)测定 参照OPA法[15-16],水解度计算公式[17]如下:

式中:5.71为大豆蛋白质的换算系数;0.35mmol/g为大豆蛋白质的游离氨基含量;7.8mmol/g为大豆蛋白质的肽键含量;N1为提取物的氮含量(mg/mL)。
1.2.5 抗氧化活性分析
1.2.5.1 DPPH自由基的清除 文献18并略作改动,样品浓度均为0.5mg/mL。
1.2.5.2 ABTS自由基清除能力 文献19并略作改动,样品浓度均为4mg/mL。
1.2.6 排阻色谱分析 参照文献20并略作修改,利用AKTA explorer蛋白质快速层析系统、Superdex-25 10/300 GL(10mm×300 mm)色谱柱分析,最大压力设定为0.15MPa,磷酸盐缓冲溶液(pH 12)为洗脱液,流速为0.5mL/min,检测波长为215nm。开机后,分别用2个柱体积的超纯水和洗脱液清洗色谱柱至电导率稳定。样品蛋白质浓度为2mg/mL;样品过0.22μm水膜后进样量为0.5mL,并用缓冲液洗脱。
选用细胞色素 C、胰岛素、氧化型谷胱甘肽、L-酪氨酸,作为测定提取物分子质量的标准物质。先用缓冲溶液单独配制1mg/mL的标准溶液,在上述条件下分析;然后再用缓冲液将4种标准物质配制为1mg/mL的混合溶液,同样在上述条件下处理、分析。
1.2.7 数据的统计分析 采用 Excel 2003软件和SPSS 13.0软件对数据进行处理和分析。
2 结果与分析
2.1 发酵过程中毛豆腐的重要组成变化
毛豆腐发酵过程中,水分会因蒸发而丢失,蛋白质等组成会发生变化,如表1所示。随着毛豆腐发酵时间的延长,水分含量降低,总蛋白质含量逐渐增加,并且水溶性蛋白质有非常显著的增加,说明毛霉分泌的蛋白酶具有蛋白质分解能力,随着发酵时间的延长而不断水解大豆蛋白质,导致产生分子量较小的肽与氨基酸,使得水提取物中的蛋白质含量显著增加。
2.2 毛豆腐提取物中可溶性蛋白质的提取率
在不同的溶剂提取条件下,不同发酵时间的毛豆腐中可溶性蛋白质的提取率如表2所示。随着发酵时间的延长,毛霉分泌蛋白酶的水解作用加大,蛋白质的水解增加,导致可溶性蛋白质的提取率增加。故此,不同提取溶剂下的可溶性蛋白质的提取率均呈现出增加的趋势。
对发酵毛豆腐与未发酵毛豆腐分别采用5种溶剂进行提取,用pH 6.5水得到的可溶性蛋白质最多、提取率最高,而60%乙醇得到的可溶性蛋白质最少、提取率最低。3种乙醇提取物中,可溶性蛋白质的提取率随乙醇浓度的增加而降低,这与提取溶剂的极性降低有关。由于pH4.5为大豆蛋白的等电点,蛋白质溶解度低,所以,pH4.5水的可溶性蛋白质提取率比pH6.5水的提取率更低。整体上看,第9d时,无论采用何种提取溶剂,可溶性蛋白质的提取率最大。
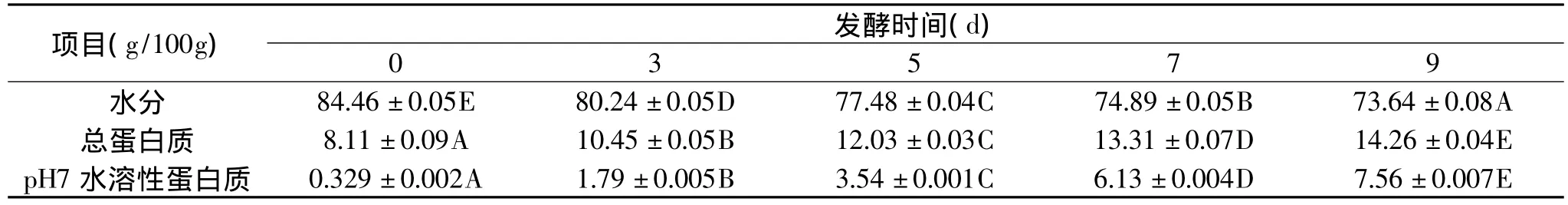
表1 不同发酵时间毛豆腐的一些化学指标变化

表2 不同发酵时间毛豆腐提取物中的蛋白质提取率(%)
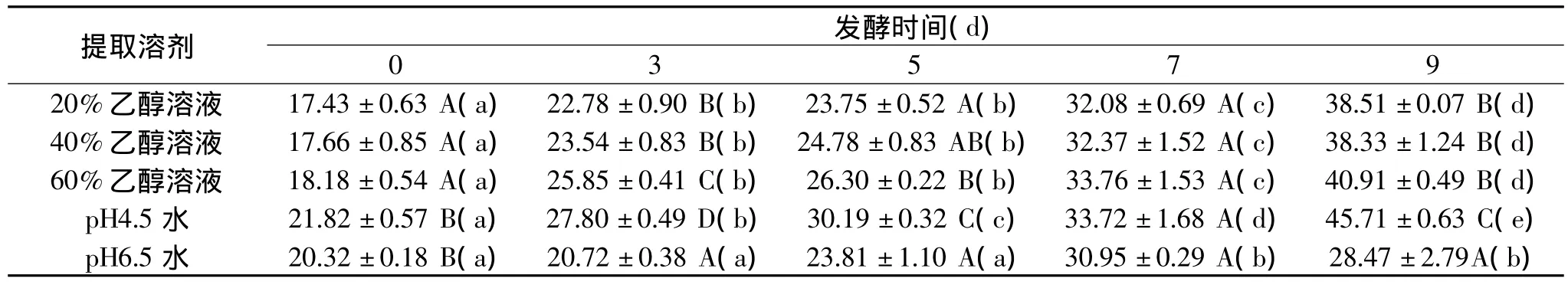
表3 不同发酵时间毛豆腐提取物中的蛋白质水解度(%)

表4 不同发酵时间毛豆腐提取物的DPPH自由基清除活性(%)
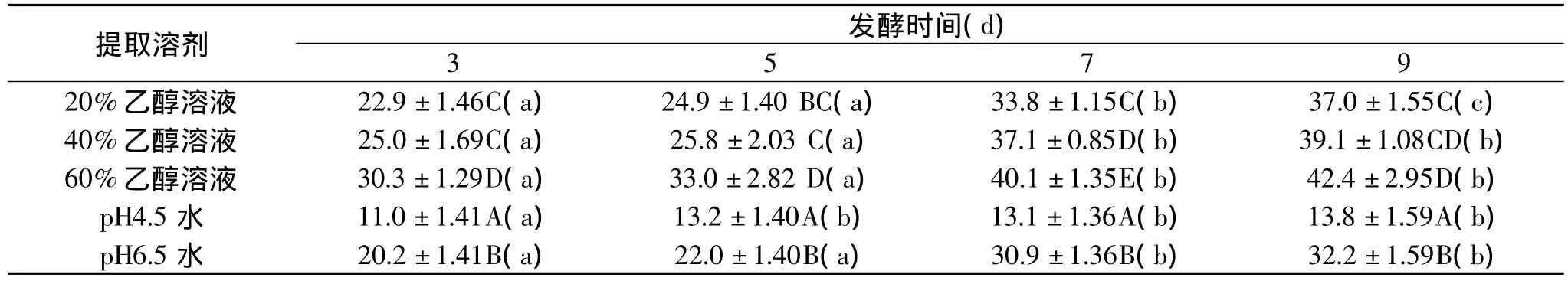
表5 不同发酵时间毛豆腐提取物的ABTS自由基清除活性(%)
2.3 毛豆腐提取物中蛋白质的水解度
不同发酵时间,不同提取溶剂得到的毛豆腐提取物中,蛋白质的水解度测定结果如表3所示。由于所测得的蛋白质水解度数值范围在17%~45%,证明所得到的提取物中蛋白质成分是大豆蛋白的水解物。数据表明,随着毛豆腐发酵时间的延长,大豆蛋白的水解作用逐渐增加,所以产生更多的小肽和氨基酸,整体上提取物中蛋白质的水解度随着发酵时间的延长而增大。pH4.5水提取毛豆腐时,由于大豆蛋白质沉淀,提取物中含有最多的小肽和氨基酸、最少的蛋白质,提取物的蛋白质水解度最大。pH6.5水不仅提取小肽和氨基酸,也提取部分蛋白质,所以提取物的蛋白质水解度最小。由于乙醇浓度越高,提取物中蛋白质含量越低而小肽和氨基酸越高,所以乙醇溶液提取物中蛋白质的水解度,整体上与乙醇浓度成正比,60%乙醇溶液提取物中蛋白质的水解度最大。
2.4 毛豆腐提取物对DPPH自由基和ABTS自由基的清除活性
对发酵时间为3、5、7、9d的毛豆腐分别用5种提取溶剂进行提取,然后对提取物的自由基清除活性进行评价,并以大豆分离蛋白为对照进行比较,得到表4和表5的结果。我们选用大多数研究中常用的DPPH、ABTS自由基作为评价对象。
分析结果表明,大豆分离蛋白对DPPH自由基的清除率为 3.79%,对 ABTS自由基的清除率为4.97%。相比之下,随着发酵时间延长,不同溶剂提取的毛豆腐提取物对DPPH、ABTS自由基的清除活性增强,并且远远高于大豆分离蛋白。这说明毛霉发酵有效地提高毛豆腐的抗氧化活性。整体上,毛豆腐pH 4.5水提取物对2种自由基的清除率活性变化幅度最小,低于毛豆腐pH 6.5水提取物,但大于大豆分离蛋白,而且发酵时间越长其清除活性均呈现增加的趋势,这与他人研究的腐乳前期发酵过程中自由基清除活性的变化一致[21]。尤为突出的是,毛豆腐的乙醇提取物显示出比毛豆腐的水提取物有更高的自由基清除活性,并且60%乙醇溶液提取出的提取物的自由基清除活性最大,20%乙醇溶液提取出的提取物的自由基清除活性最小。所以,极有可能是由于乙醇溶液的非极性增加,导致提取物中具有更多的疏水性小肽和氨基酸,从而提高提取物的自由基清除活性。之前的研究也揭示贝类发酵物的抗氧化活性与提取物中氨基酸的疏水性有关[22]。
是否由于大豆中存在的异黄酮被乙醇溶液提取,从而对乙醇提取物的自由基清除活性评价产生了影响。在研究过程中,我们对乙醇溶液提取物进行活性碳处理,利用活性碳吸附作用除去可能存在的异黄酮。结果发现,毛豆腐乙醇提取物经活性碳处理后,对2种自由基的清除率确实有所降低,但是降低幅度约为7%~9%,可能与活性炭对部分肽或氨基酸的吸附作用有关。不过可以肯定的是,异黄酮对提取物的自由基清除活性评价影响甚微。另外,其他人在对豆豉的抗氧化性研究中也发现,抗氧化性与可溶性成分有关,而与异黄酮关系不大[23]。所以,我们的结论与其一致。至于毛豆腐提取物中哪些肽成分具有较好的自由基清除活性,还有待于进一步的研究。
2.5 排阻色谱分析图谱
由于发酵9d后毛豆腐的5种提取物的自由基清除活性均最好,所以利用排阻色谱对这5种提取物进行分析,结果如图1所示。
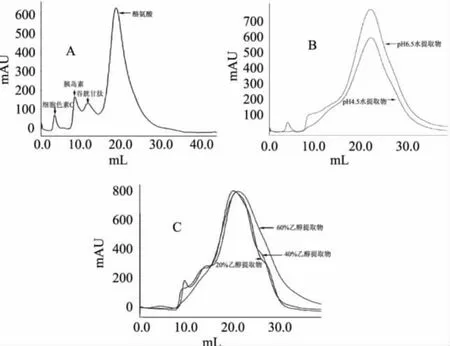
图1 排阻色谱分析图谱
在标准样品中,细胞色素C、胰岛素、氧化型谷胱甘肽、L-酪氨酸的分子质量分别为12200、5733、612.6、181.2,相应的洗脱体积分别为3.5、8.6、11.9、19.2mL。从图1B、图1C中可以看出,5种提取物主要组成成分的洗脱体积范围大致在9.8~21.2mL之间。因此,根据标准样的洗脱体积,初步断定5种提取物中大分子质量物质为分子质量小于5733的肽类,而小分子质量的物质则为游离氨基酸,表明毛豆腐发酵过程中一些大豆蛋白充分降解,产生了肽和游离氨基酸。从图1B、图1C的谱图还可以看出,不同溶剂得到的提取物,其组成还是有一定差别的,例如,pH6.5水提取物中,与pH4.5水提取物相比,就含有更多的大分子质量肽,而3种乙醇液提取物的组成也是有区别的。乙醇的含量越低,提取物中大分子质量的肽也就相对多一些。这些组成的差异,可能是导致其自由基清除活性不同的原因。
3 结论
3.1 在0~9d的发酵过程中,毛豆腐的水分含量逐渐降低,蛋白质含量逐渐增加,同时水溶性蛋白质含量也有显著增加。
3.2 利用5种提取剂:20%、40%、60%(v/v)乙醇溶液,pH4.5水,pH6.5水;分别对发酵时间不同的毛豆腐进行提取,所得到的各种提取物中,可溶性蛋白质的提取率随毛豆腐发酵时间延长而增加,最高可达到33.9%;pH6.5水提取物可溶性蛋白质提取率高于pH4.5水提取物;随着提取溶剂中乙醇浓度的增加,乙醇溶剂提取物中可溶性蛋白质的提取率下降。
3.3 各种提取物中蛋白质的水解度在17%~45%,并随毛豆腐发酵时间的延长而增加,说明提取物蛋白质成分为大豆蛋白质的水解物。pH4.5水提取物中蛋白质的水解度,大于pH6.5水提取物中蛋白质的水解度;并且,随着提取溶剂中乙醇浓度的增加,提取物中蛋白质的水解度也增加。
3.4 随着毛豆腐发酵时间的延长,提取物对DPPH、ABTS自由基的清除活性也增加,大小顺序为:60%乙醇溶液提取物>40%乙醇溶液提取物>20%乙醇溶液提取物>pH6.5水提取物>pH4.5水提取物。结果显示,提取溶剂对提取物的自由基清除活性具有影响作用,但有待于进一步的分析研究。
3.5 排阻色谱分析结果表明,发酵9d后,毛豆腐的各种提取物的主要组成为肽与氨基酸,不同提取物的组成有区别,可能是其自由基清除活性不同的重要原因。
[1]Fukushima D.Recent progress in research and technology on soybean[J].Food Science and Technology Research,2001,7 (1):8-16.
[2]Yang JH,Mau JL,Ko PT.Antioxidant properties of fermented soybean[J].Food Chemistry,2000,71(2):249-254.
[3]Huang MT,Osawa T,Ho CT,et al.Food Phytochemicals for Cancer Prevention[M].Washington DC:American Chemical Society,1993.
[4]王瑞芝.中国腐乳酿造[M].北京:中国轻工业出版社,1998.
[5]张雪梅,蒲彪.腐乳的研究概况与发展前景[J].食品与发酵工业,2005,31(5):94-97.
[6]郑晓婷,赵新淮.毛霉发酵对豆制品的质构和微观结构的影响[J].食品与发酵工业,2008,34(9):33-35.
[7]Chen H,Muramoto K,Yamauchi F.Structural analysis of anti -oxidative peptides from soybean β-conglycinin[J].Journal of Agricultural and Food Chemistry,1995,43(3):574-578.
[8]尤新.功能性发酵制品[M].北京:中国轻工业出版社,2000.
[9]Zhang JH,Tatsumib E,Ding CH,et al.Angiotensin I-converting enzyme inhibitory peptides in douchi,a Chinese traditional fermented soybean product[J].Food Chemistry,2006,98(3):551-557.
[10]Kuba M,Tana C,Tawata S,et al.Production of angiotensin-I-converting enzyme inhibitory peptides from soybean protein with monascus purpureus acid proteinase[J].Process Biochemistry,2005,40(6):2191-2196.
[11]Fumio Y,Kunio S.Immunological effects of dietary peptides derived from soybean protein[J].Nutrition Biochemistry,1993,4(8):450-456.
[12]黄丽虹.大豆多肽的生理功能及应用[J].食品科技,1999(3):50-51.
[13]GB 5009.3-2010,食品中水分的测定[S].
[14]GB/T 5009.5-2003,食品中蛋白质的测定[S].
[15]Church FC,Swaisgood HE,Porter DH,et al. Spectrophotometric assay using o- phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J].Journal of Dairy Science,1983,66(6):1219-1227.
[16]Spellman D,McEvoy E,O’Cuinn G,et al.Proteinase and exopeptidase hydrolysis of whey protein:Comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis[J].International Dairy Journal,2003,13(6):447 -453.
[17]赵新淮,冯志彪.蛋白质水解物水解度的测定[J].食品科学,1994,15(11):65-67.
[18]Nsimba RY,Kikuzaki H,Konishi Y.Antioxidant activity of various extractsand fractionsofChenopodium quinoa and Amaranthus spp.seeds[J].Food Chemistry,2008,106(2):760 -766.
[19]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9-10):1231-1237.
[20]Chu K T,Ng TB.First report of a glutamine-rich antifungal peptide with immunomodulatory and antiproliferative activities from family Amaryllidaceae[J].Biochemical and Biophysical Research Communications,2004,325(1):167-173.
[21]全明海,李里特.腐乳生产过程中自由基清除能力的变化[J].中国调味品,2006(10):22-25.
[22]Rajapakse N,Mendis E,Jung WK,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38 (2):175-182.
[23]Wang D,Wang LJ,Zhu FX,et al.In vitro and in vivo studies on the antioxidant activities of the aqueous extracts of Douchi(a traditional Chinese salt-fermented soybean food)[J].Food Chemistry,2008,107(4):1421-1428.
Study on the free radical scavenging activity of the extracts from mao-tofu in vitro
HANG Mei,ZHAO Xin-huai*
(Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China)
Mao-tofu fermented for 3,5,7,9 days were extracted by five extraction solvents,including 20%,40%, 60%ethanol solution(v/v),pH 4.5 and pH 6.5 water,respectively.The extracting yield of the proteins and the degree of hydrolysis of the proteins in the extracts were analyzed.The free radical scavenging activities of the extracts on DPPH,ABTS radicals were evaluated.The results showed that the longer the fermentation time was,the higher the extracting yield and the degree of hydrolysis of the proteins in the extracts were,and the higher the free radical scavenging activity of the extract was.It was also found that the free radical scavenging activities of ethanol extracts of mao-tofu were higher than water extracts,and the free radical scavenging activity of ethanol extracts increased with the concentration of ethanol applied in extraction.The analysis results from size exclusion chromatography confirmed that the five extracts obtained from mao-tofu fermented for 9 days were mainly peptides and amino acids,indicating the occurrence of hydrolysis of soybean proteins.
mao-tofu;extracts;extracting yield;degree ofhydrolysis;radical scavenging activity;size exclusion chromatography
TS214.2
A
1002-0306(2011)09-0169-05
大豆在发酵过程中产生多种抗氧化成分,例如多肽类。许多研究证明,大豆发酵制品比没发酵之前显示出更强的抗氧化活性[1]。Yang等的研究表明,发酵后的大豆显示出更强的DPPH自由基清除能力[2]。Easki等报道,日本豆酱、纳豆和天贝在发酵过程中产生了抗氧化成分[3]。毛豆腐是我国徽州的著名小吃,在我国有较大的消费人群[4],它是利用豆腐通过微生物发酵所制成的一种干酪型产品,可以有效地提高大豆的消化率和生物价[5]。毛霉是生产毛豆腐的主要菌种,这主要是因为毛霉能分泌蛋白酶,将蛋白质分解生成氨基酸和多肽等,使食品具有独特的风味和细腻的质地,受到消费者的喜爱。以往对毛豆腐的研究主要偏重于发酵过程中的化学成分、微细结构和组织形态的变化[6],而对毛豆腐中蛋白质的生物活性的研究甚少。过去的研究工作表明,大豆蛋白肽具有抗氧化[7]、降胆固醇[8]、降血压[9-10]、提高免疫力[11]、抗癌[12]等生物功能。因此,研究毛豆腐中肽类的抗氧化性质很有必要。本研究采用5种不同溶剂提取发酵后的毛豆腐样品,分析各种提取物中蛋白质的含量及水解程度,并评价各提取物对两种自由基的体外清除活性,确定发酵时间和溶剂种类对毛豆腐提取物抗氧化能力的影响;然后利用排阻色谱初步评价了提取物的组成情况。
2010-08-31 *通讯联系人
杭梅(1984-),女,在读硕士研究生,研究方向:食品科学。
